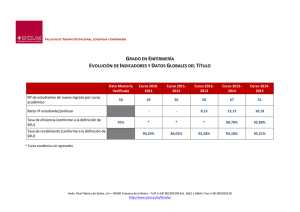
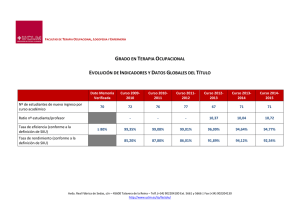
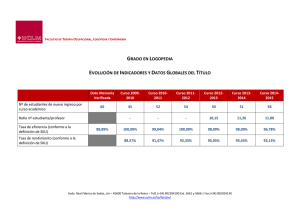
Clase Insecta, Orden Thysanoptera
Anuncio

Contribución al conocimiento de la Fauna del Orden Thysanoptera (Clase Insecta, Orden Thysanoptera) en Euskal Herria Dr. Arturo Goldarazena NEIKER, Instituto Vasco de Investigación y Desarrollo Agrario Objetivo de este trabajo El objetivo de este trabajo es estudiar la biodiversidad de la fauna del orden Thysanoptera en Euskal Herria, haciendo especial hincapié en su identificación, distribución y rango de plantas hospedadoras. Este trabajo ha de enenderse como una introducción al conocimiento de este grupo de insectos en nuestro país, más que una revisión en el sentido taxonómico estricto. Ello es debido a la falta de estudios debido a la escasez de especialista en dicho orden de insectos microscópicos. Debido a la escasa duración de este contrato que ha posibilitado el estudio. Algunos géneros se tratan en profundidad, pero otros se han estudiado más superficialmente debido a su gran complejidad. El trabajo abarca la identificación de 53 géneros y 133 especies. Características únicas de los trips Además de lo característico de sus partes bucales asimétricas, en la que la mandíbula derecha no está desarrollada más allá del esclerito basal en las larvas y adultos, los trips también presentan otras características propias que no se dan en otros hemipteroides. El nombre ordinal “Thysanoptera” se deriva de unas palabras griegas que significan “alas ciliadas” y se refiere a las curiosas alas estrechas que poseen los trips adultos. Sin embargo, las alas estrechas con cilios marginales también están presentes en muchos otros insectos pequeños. También hay que tener en cuenta que muchos trips adultos carecen de alas. En alemán el nombre común, “Blassenfüße”, se refiere a que el tarso de los trips carece de la uña típica presente en el resto de los insectos. En su lugar lleva un arolio reversible adhesivo. El nombre común en inglés “thrips”, se deriva de una palabra griega que significa “gusano de la madera” y se refiere al hecho de que muchas especies de trips que no son plaga están asociadas con hongos de madera muerta. La historia natural de las especies de trips es también única entre los insectos. Después de que el huevo eclosiona, hay dos estadios larvales móviles que se alimentan activamente. Sin embargo, éstos están seguidos por dos estadios pupales independientes que no se alimentan (en Phlaeothripidae hay tres estadios pupales). Por el contrario, la mayoría de las especies de insectos presentan una única pupa. Los huevos de los trips se insertan normalmente en el interior de los tejidos vegetales, de una vez y con la ayuda de un ovopositor en forma de sable que poseen las hembras. Sin embargo, todos los Phlaeothripidae depositan los huevos en la superficie de sus fuentes alimenticias, sean plantas u hongos. Clasificación En el mundo hay descritas aproximadamente 5500 especies de trips. Las zonas calientes y las regiones tropicales presentan la mayor diversidad mientras que las regiones más frías son más pobres en número de especies. Sin embargo, la fauna de trips de las regiones templadas ha sido estudiada más intensamente que la de los paises tropicales. La fauna de la región Afrotropical es muy poco conocida. Un listado de trabajos taxonómicos de todo el mundo puede consultarse en ThripsID (Moritz, Morris & Mound, 2001). Las especies del orden Thysanoptera se clasifican en aproximadamente 750 géneros y 9 familas (Mound & Morris, 2004). De todas ellas, el suborden Terebrantia comprende 8 familias incluyendo la familia Thripidae, mientras que el suborden Tubulifera comprende una única familia, Phlaeothripidae. La actual clasificación de los Thysanoptera, a todos los niveles, tiene un sustento filogenético muy débil (Morris & Mound, 2004). Es particularmente problemático el hecho de que aproximadamente el 50% de los géneros reconocidos incluyan una sóla especie, la clasificación supragenérica disponible no es efectiva y muchos taxones están basados en la presencia de estados de carácter autapomórficos (Mound & Morris, 2004). Rango de hospedadores Muchos de los datos publicados sobre las plantas hospedadoras de los trips son muy confusos. En condiciones de tiempo cálido los trips vuelan y se dispersan activamente e incluso los adultos ápteros de algunas especies se distribuyen rápidamente por el viento. Muchos autores erran al distinguir entre las plantas en las que los trips adultos han sido encontrados con aquellas plantas en las que dichas especies de trips ponen los huevos y se reproducen satisfactoriamente. Por el contrario, no es raro que entomólogos económicos centren su atención en una especie particular de trips de un cultivo mientras que ignoran que una parte desconocida de su meta-población está presente en otras plantas en las proximidades del mismo. Surgen más complicaciones sobre el concepto de planta hospedadora en las especies que poseen distintas plantas hospedadoras dependiendo de las áreas en las que viven (por ejemplo Neohydatothrips gracilicornis en el norte y sur de Europa, o Aeolothrips ericae en Inglaterra y Alemania). Además, un adulto virulífero seguramente tiene el potencial de transmitir un tospovirus a la planta en la que no puede reproducirse satisfactoriamente. Por lo tanto, las verdaderas plantas hospedadoras de una especie de concreta de trips son muy difíciles de determinar. La obtención de una información precisa es muy importante, tanto en el estudio poblacional de las especies plaga como en estudios más generales sobre la radiación evolutiva y la explotación del hospedador por parte de estos insectos. La mayor parte de las plagas importantes de trips son polífagas. Thrips tabaci y Frankliniella occidentalis pueden reproducirse en una amplio rango de especies de plantas, además ambas especies pueden alimentarse de huevos de ácaros pudiendo considerarse en ese caso beneficiosas. Estos trips están normalmente asociados con las flores y hojas jóvenes de sus plantas hospedadoras. Especies del género Scirtothrips dañan especialmente los tejidos jóvenes. Por el contrario, las especies polífagas de Panchaetothripine como Heliothrips haemorroidalis y Hercinothrips bicinctus se alimentan primariamente de hojas viejas, de forma que las hojas normalmente presentan gotas fecales oscuras depositadas por los trips. Las larvas de muchas especies de trips plaga se esconden debajo de los pelos de las hojas, cerca de sus venas principales. Debido a esto, con frecuencia, no se observan las larvas y puede que su captura sea muy dificultosa cuando se pretenda estimar el tamaño de las poblaciones. Los trips como plagas Los trips adultos y las larvas dañan las plantas debido a que se alimentan de ellas, (daños directos) y/o porque son vectores de tospovirus. Todos los Thysanoptera tienen un par de piezas bucales suctoras, lacinias maxilares a modo de agujas que están co-adaptadas con la lengua y márgenes acanalados que encierran un único canal. Solamente está desarrollada la mandíbula izquierda que la utilizan para pinchar las células vegetales antes de que sus contenidos sean ingeridos a través del tubo alimenticio formado por los estiletes maxilares. Por el contrario, otros insectos miembros del orden Hemiptera tienen piezas bucales suctoras formadas por dos mandíbulas, dos estiletes maxilares y estás a su vez engloban canales separados para la inyección de saliva y la ingestión de comida. La alimentación de trips en hojas jóvenes normalmente produce su distorsión; en casos extremos puede impedir el crecimiento de la planta o incluso provocar su defoliación. Las hojas distorsionadas y parcialmente cloróticas de estas plantas pueden parecer que han sido atacadas por un virus, pero este tipo de daño puede estar causado por la saliva tóxica de los trips y debe ser disntinguido de las auténticas infecciones virales.(ver la sección de tospovirus). Ciclos de vida Los estados de desarrollo de los trips pertenecientes al suborden Terebrantia incluyen el huevo, dos estados larvarios (larva de primero y segundo estadio) y dos estadios ninfales (proninfa y ninfa). En algunos miembros de Phlaeothripidae, los huevos son depositados en un sustrato alimenticio, usualmente horizontalmente pero algunas veces de forma vertical. Todos los miembros de esta familia presentan dos estados pupales y estos se dan juntos con larvas y adultos. En muchas especies de Terebrantía los huevos son insertados en los tejidos de las plantas por medio del ovopositor, aunque en unas pocas especies el ovopositor es débil y los huevos son depositados en la superficie de la planta. El huevo es oval y alargado u oblongo, adoptando diferentes formas según las especies. Las larvas se alimentan activamente y son móviles. Por el contrario los estadios ninfales no se alimentan y tienen escasa movilidad. Las proninfas presentan esbozos alares y aparecen algunos caracteres sexuales secundarios, que permiten diferenciar sexos. Frente a esta regla general que se da en la mayor parte de las especies de Terebrantia hay excepciones como el caso de Franklinothrips en donde no hay estado de proninfa (Lewis 1973). Los insectos adultos pueden presentar un desarrollo alar variable. Hay especies ápteras, mientras que otras son macrópteras dependiendo de varios factores (Heming 1991). Los trips tienen reproducción partenogenética de diversos tipos (Lewis 1973). Las hembras son diploides y los machos haploides, procediendo éstos de huevos no fertilizados. Los trips del Suborden Terebrantia presentan tres tipos de partenogénesis: Telítoca. El macho es extremadamente raro o desconocido de forma que la especie se perpetua a partir de hembras no fecundadas Ej: Heliothrips haemorrhoidalis Bouche. Arrenótoca. Las hembras no fecundadas ponen huevos que dan lugar a machos haploides. Se da en muchas especies como por ejemplo en Frankliniella occidentalis Pergande Deuterótoca. Las hembras no fecundadas ponen huevos que dan lugar a hembras, pero si la reproducción tiene lugar a temperaturas frescas aparecen machos. Es decir, los cambios en la proporción de machos en las poblaciones pueden estar ocasionados por la temperatura. Ej: Parthenothrips dracaenae (Lewis, 1997; Mound, 1996 b). Dispersión. Hay dos mecanismos de dispersión. La dispersión activa, en la cual el insecto gasta energía para desplazarse y la dispersión pasiva en donde el trips no desarrolla actividad alguna a la hora del desplazamiento. El viento juega un papel importante en la dispersión pasiva de las especies aladas. Los trips que vuelan activamente sobre el cultivo, son elevados por corrientes ascendentes de aire y luego desplazados por corrientes en sentido horizontal. Si el viento es fuerte, pueden ser desplazados a distancias largas (Bournier 1983). Los estudios de distribución vertical de las poblaciones a alturas superiores a las de los cultivos indican que las densidades poblacionales capturadas descienden rápidamente a medida que la altura crece (Bournier, 1983). La distribución de los trips en las plantas guarda relación con los hábitos alimenticios de éstos. Los trips polenófagos se agregan en las flores (Frankliniella occidentalis, Frankliniella panamensis, entre otros), los filófagos en las hojas o frutos (Thrips palmi, Heliothrips haemorrhoidalis). Algunas especies pueden explorar en diferentes órganos de la planta, presentando diversos tipos de distribución. En ocasiones, se pueden encontrar densidades poblacionales muy elevadas en las plantas situadas en el perímetro de la parcela, cerca del cultivo. Este “efecto borde” es más pronunciado en el lado próximo a un cultivo contaminado (debido a una dispersión eólica o al vuelo activo de los adultos que emigran a un cultivo nuevo). (Lewis, 1997). Hábitos alimenticios Los trips presentan un régimen alimenticio muy variado que puede resumirse de la siguiente forma: Especies micófagas. Se estima que más de la mitad de las especies conocidas del Orden Thysanoptera se alimentan de hongos. Estas pertenecen al suborden Tubulifera y se alimentan de los hongos que crecen sobre la superficie de las hojas, debajo de las cortezas de los árboles, en galerías excavadas por otros insectos o en los restos vegetales en contacto con el suelo (William 1997). Unas especies ingieren esporas y explotan hábitats bastante efímeros, siendo abundantes en los trópicos (Mound & Teulon 1995). Otras se alimentan de hifas absorbiendo su contenido o ingiriéndolas y colonizan hábitats más estables como zonas de hojarasca de cultivos caducifolios o herbáceos estacionales (Mound 1997; Mound & Teulon 1995). Especies fitófagas. Los adultos y las larvas de otras especies se alimentan de los contenidos celulares de los tejidos vegetales. Aunque hay especies capaces de alimentarse en diferentes órganos de las plantas, otras se nutren de órganos concretos (Plasencia & Climent 1996). Por ejemplo Thrips palmi, Thrips tabaci, Heliothrips haemorroidalis se alimentan casi exclusivamente de hojas mientras que especies del género Scirtothrips se alimentan sobre frutos. Hay especies que pueden alimentarse de diferentes partes de la planta (flores, hojas y frutos) y constituyen las plagas más importantes (Frankliniella occidentalis, Thrips tabaci, Thrips palmi etc). Especies carnívoras (o depredadoras). Hay unas 300 especies de las que se tiene conocimiento de actividad depredadora (Zur Strassen 1995). Las larvas y los adultos pican a sus presas y absorben su contenido. Algunas de estas especies pueden tener un efecto beneficioso en el control de plagas. Muchas especies de la familia Aeolothripidae son depredadoras facultativas, alimentándose tanto de polen como de ácaros (Kirk 1984; Willson et al. 1996; Mound & Kibby 1998). Aeolothrips melaleucus se ha citado como depredador de ácaros tetraníquidos (Lewis, 1973; Kirk 1984). Dentro de los Terebrantia, distintas especies del género Franklinothrips y algunas de Orothrips se comportan como depredadoras de ácaros, trips o huevos de psílidos. El género Scolothrips preda específicamente sobre ácaros tetraníquidos y tanto sus larvas como adultos se alimentan de arañas rojas. También en la familia Phlaeothripidae hay especies depredadoras dentro de los géneros Aleurodothrips, Karniothrips, Leptothrips, Podothrips etc, alimentándose de ácaros, cóccidos diaspinos y otros pequeños artrópodos. Importancia económica En la actualidad hay 550 especies de trips consideradas plagas que son las causantes de las mayores pérdidas en los cultivos de interés comercial, apenas el 1% de todas las especies descritas (Mound & Marullo 1996). Debido a su pequeño tamaño, su detección es difícil, aunque se disponen de herramientas informáticas interactivas que facilitan la labor de identificación de las mismas (Moritz et al. 2004). Las especies que tienen un corto tiempo de generación, amplio rango alimenticio y reproducción partenogenética tienen que ser tenidas en cuenta como futuras plagas potenciales, que en determinadas condiciones ambientales óptimas pueden formar agregación sobre un cultivo (Mound & Marullo 1996). Los ataques severos pueden producir defoliación, aborto de flores y deformación de hojas y frutos (Ellsworth et al. 1995). Los daños indirectos causados por ser vectores de virus del género Tospovirus (Familia Bunyaviridae) son también muy importantes. Entre los virus transmitidos, destacan el virus del bronceado del tomate (TSWV), el virus de la necrosis del cacahuete (maní) (PBNV) y el virus del mosaico del maní (PYSV) (Hunter & Hsu 1995; Mound, 1996; Ullman et al., 1995; Wijkamp et al., 1995). Dentro del suborden Terebrantia, la mayor parte de las especies plaga pertenecen a los géneros Thrips y Frankliniella. Son dos de los géneros más biodiversos, pues contienen un gran número de especies, 275 y 175 respectivamente (Cárdenas & Corredor, 1993; Mound, 1996; Mound, 1997). Las especies plaga que causan mayores problemas en cultivos de flores, frutales y hortalizas en Colombia son Frankliniella occidentalis, Thrips palmi y Thrips tabaci, esto se debe al gran impacto que han venido presentando sobre algunos cultivos (Estrada et al., 1994; Vergara, 1998, Zapata et al, 1994). Métodos y técnicas de estudio Introducción Excepto para unas pocas especies de trips , es casi imposible la identificación de ejemplares vivos o no preparados. La existencia de formas claras y oscuras en muchas de las especies más comunes, a menudo asociada con diferencias considerables en el tamaño del cuerpo entre ambos sexos y también entre ejemplares del mismo sexo, requiere la elaboración muy cuidadosa de los ejemplares en preparaciones microscópicas que posteriormente deberán formar parte de una colección. Cualquier distorsión, daño o mal disposición del ejemplar, puede provocar que no se pueda identificar. Los mejores métodos y técnicas para la realización de preparaciones microscópicas deben escogerse teniendo en cuenta dos cosas: los que son apropiadas para realizar identificaciones rutinarias rápidas y los que se deben utilizarse para investigaciones de carácter taxonómico y que por lo tanto requieren ser archivadas para formar parte de una colección entomológica (Mound and Kibby 1998). Además, las larvas de muchas especies de trips están sin describir y es imposible identificarlas. Cualquiera que piense desarrollar un programa de control de plagas que incluya a los trips, necesita identificar rápidamente las especies que están provocando daños, para de esta forma diseñar la estrategia de control más apropiada de acuerdo a las condiciones económicas y ecológicas. Moritz. Mound, Morris y Goldarazena (2004) desarrollan un programa informático que provee de ambos sistemas de identificación visual para todos los estadíos ontogenéticos, incluyendo también los huevos puestos dentro del tejido de la planta y también usando técnicas moleculares basadas en ITS-RFLP. Captura El mejor método para capturar trips, además de colectarlos individualmente y de forma manual de las plantas utilizando un pincel de brocha fina, es agitar la vegetación sobre una pequeña bandeja de plástico usando un cuchillo pesado. Con sumo cuidado, las plantas individuales, las flores y hojas, pueden ser golpeadas separadamente para de esta forma recoger los trips anotando su procedencia. Además, incluso en los días más calientes y soleados, los trips están tan aturdidos por la agitación brusca de la planta que se adhieren a la superficie del plástico antes de volar o saltar. Los trips pueden ser despegados de la bandeja con el pincel fino y deben introducirse en los tubos de captura, en cuyo interior debe ser colocada una etiqueta informativa escrita con lápiz. Un líquido conservante apropiado para capturar trips antes de realizar los montajes microscópicos es la solución AGA, (mezcla formada por alcohol etílico al 60%, glicerina y ácido acético en la propoción 6:1:1 respectivamente) (Mound & Pitkin, 1972, Palmer et al. 1989). Preparación de los insectos para su esrtudio microscópico: Deshidratación y aclarado Muchas especies deben ser maceradas cuidadosamente para eliminar el contenido corporal. Si esto no se hace, (por ejemplo en el caso de que se necesite conservar su coloración natural, entonces hay que empezar por el paso 4), puede que no sean visibles algunos caracteres de la superficie dorsal y ventral como la escultura o determinadas sedas pequeñas. Los ejemplares deberían manipularse utilizando minucias entomológicas, (alfileres muy pequeños y finos), montados en cera sellante sobre palitos de cerillas . Una herramienta sencilla para “pescar” los trips puede ser fabricada con un hilo curvado de metal, a modo de lanceta. 1. Colocar los trips en un vidrio de relojero , sustituir el AGA con etanol limpio al 60% y almacenar durante al menos 24 horas. 2. Eliminar el etanol con una pipeta, añadir unas pocas gotas de agua destilada y el mismo número de gotas de una solución fría de NaOH al 5%. Los ejemplares claros pueden requerir una hora solamente, otros deben matenerse durante toda la noche; los ejemplares oscuros hay que aclararlos durante 2 o más días. El período concreto sólamente puede ser determinado con exactitud por la propia experiencia y debe ser siempre tan corto como sea posible para minimizar el daño en el ejemplar. 3. Transferir el ejemplar de la solución de NaOH a agua destilada durante unas pocas horas, pasarlo posteriormente a alchol al 60%, empleando un alfiler entomológico o una lanceta curvada. Cada ejemplar debe ser frotado suavemente para eliminar la mayor parte del contenido corporal. Las patas y las antenas deben ser estiradas y separadas del cuerpo. 4. Almacenar los ejemplares en alcohol al 60% durante 24 horas. 5. Sustituir el alcohol al 60% por etanol al 70% y dejarlos durante aproximadamente 1 hora; los ejemplares no macerados deben ser punzados en el abdomen para facilitar la entrada de los alcoholes y deben extenderse las patas, las antenas y las alas. 6. Sustituir con alcohol al 80% y dejar durante 20 minutos. 7. Sustituir con alcohol al 95% y dejar durante 10 minutos. 8. Sustituir con alcohol absoluto y dejar durante 5 minutos. 9. Sustituir con alcohol absoluto fresco y dejar durante otros 5 minutos. 10. Pasar los ejemplares a aceite de clavo y dejarlos durante media hora aproximadamente, antes de proceder a montarlos en preparaciones microscópicas. Elaboración de preparaciones microscópicas 1. Coloque un cubre limpio sobre la plataforma en donde se va a realizar la preparación; ponga una gota de Bálsamo de Canadá sobre el centro del cubre y sobre ésta un único ejemplar de trips boca a arriba, del lado ventral (es aconsejable y útil marcar el centro de la plataforma de montaje con una cruz para que el ejemplar quede situado en el centro de la preparación). La plataforma de montaje puede ser una cartulina dura, sobre la que se dibuja un esquema de la propia preparación. 2. Estire las patas y las alas y enderece las antenas presionando sobre los artejos basales con una aguja entomológica fina. 3. Ponga una pequeña gota de bálsamo en el centro de un porta microscópico limpio, inviértalo y colóquelo debajo, sobre el ejemplar que está en el cubre, de forma firme y suave. 4. Tan pronto como toque la superficie, reinvierta la preparación con el cubre adherido; esta técnica normalmente previene la formación de burbujas que pueden arruinar las preparaciones. 5. Las preparaciones microscópicas deberán colocarse inmediatamente en una estufa a 37 ºC hasta que se endurezcan; unos pocos minutos en una placa caliente puede ayudar a eliminar el exceso de xileno, acelerando el proceso de secado. Identificaciones más rápidas, para determinaciones rutinarias, se pueden realizar con medio Hoyer, aunque en este caso las preparaciones son semipermanentes y deben sellarse inmediatamente si se desea conservarlas en una colección. Para ello se puede utilizar esmalte de pintura o glicel. Etiquetado del material Es muy importante etiquetar el trips montado con sus datos originales. 1. Con la cabeza del trips dirigido hacia usted, la etiqueta derecha debe indicar: - la planta hospedadora - el país - la localidad y la fecha - el nombre del colector (código numérico). 2. La etiqueta del lado izquierdo debe indicar el sexo, el morfo, el género y la especie con su autor. Caracteres sistemáticos a estudiar Escultura de la cabeza, pronoto y metanoto La escultura característica de Panchaetothripinae tiene una reticulación muy desarrollada o escultura irregular. Por el contrario los géneros más comunes dentro de Thripinae, como por ejemplo Frankliniella y Thrips, presentan una escultura en la cabeza y en el pronoto mucho más débil formada por líneas transversales. Unos pocos Thripinae presentan una débil reticulación en la cabeza, como Aptinothrips y algunas especies de Anaphothrips, aunque en especies del género Echinothrips la reticulación está mucho más marcada. Algunas especies de Dendrothripinae también poseen una escultura compleja aunque con poca reticulación. Estiletes maxilares En los Terebrantia los estiletes están restringidos al cono bucal. En los Phlaeothripidae los estiletes maxilares son normalmente mucho más largos, y están profundamente retraídos hacia la cabeza. Hay una serie de músculos asociados con ellos, las guías maxilares. Las especies del género Haplothrips tienen una extensión antero medial de cada guía formando un puente maxilar. Los estiletes de Idolothripinae son excepcionalmente anchos para permitir la ingestión de las esporas fúngicas. Número de artejos antenales Aunque unas pocas especies de Thripinae poseen antenas con 9 artejos, en donde el artejo VI está parcialmente o completamente subdividido, la mayor parte de las especies tienen 8 artejos antenales. Muchas especies de Thripinae poseen solamente 7 artejos antenales porque los dos artejos que habitualmente forman el estilo terminal están fusionados en un único artejo. Esto ocurre en la mayor parte de las especies más comunes del género Thrips, pero en algunas especies como Thrips hawaiiensis la antena puede tener indistintamente 7 u 8 artejos; esta variación se puede dar incluso en las dos antenas (izquierda o derecha) del mismo individuo. En unas pocas especies, los 3 artejos terminales pueden también fusionarse dando lugar a una antena con 6 artejos. Forma de los artejos antenales II y III Los artejos antenales II y III son más o menos simétricos en la mayor parte de los Thripidae, pero uno u otro segmento son frecuentemente asimétricos en los Thripinae asociados a gramíneas, en donde el margen externo está más o menos prolongado. Pedicelo del artejo antenal III Los adultos de la mayor parte de las especies de Thripidae tienen la base del artejo antenal III alargada, pero en algunas especies de Frankliniella, especialmente las de la región Caribeña -(también las del sudeste de los Estados Unidos)-, la base del artejo antenal III está ensanchada y/o expandida de forma variada. Algunas de estas especies con el pedicelo ensanchado en forma de botella pueden ser identificadas rápidamente, pero no se ha estudiado la variación inter e intra poblacional de la morfología de la región basal de dicho artejo. El significado de la variación entre muestras de las especies amarillentas más comunes del género Frankliniella, como por ejemplo F. gardeniae, es desconocido y la distinción de especies en este grupo requiere de estudios más profundos. Forma de los sensoria de los artejos antenales III y IV Los individuos adultos de Thripidae poseen los conos sensoriales emergentes en los artejos antenales III y IV. Estos conos sensoriales son frecuentemente bifurcados, pero en muchas especies son sencillos, especialmente en las especies asociadas a gramíneas. Dentro del género Echinothrips, la forma de los conos sensoriales es variable entre especies. Sensorio bifurcado del artejo antenal IV En muchas especies de Thripidae el cono sensorial del artejo antenal IV no se extiende más allá de la base del artejo V, pero en otro grupo de especies se extiende mucho más lejos, incluso más del 30% de la longitud del artejo V. Este carácter taxonómico es muy útil para distinguir entre dos especies comunes de Hercinothrips en los Panchaetothripinae. Par de sedas situadas delante del ocelo anterior Hay 3 pares de sedas asociadas con los ocelos en Thripinae. • El par III se coloca entre o justo por fuera de los márgenes anterolaterales del triángulo ocelar. • El par II se coloca anterolaterlmente, próximo al margen de los ojos compuestos. • El par de sedas ocelar I, formado por sedas situadas muy próximas la una de la otra, se coloca delante del primer ocelo. La presencia del par de sedas ocelar I es un poderoso carácter discrimante para identificar a los Thripinae. Estas sedas están presentes en especies de los géneros Frankliniella y Megalurothrips, pero están ausentes en especies de los géneros Thrips y Stenchaetothrips. Se debe tener mucho cuidado con los ejemplares en los que la cabeza esté aplastada. En estos ejemplares, las sedas largas interoculares pueden ser confundidas con las sedas ocelares situadas en la superficie dorsal. Sedas ocelares II Las sedas que forman el par ocelar II son normalmente inconspicuas. Sin embargo, en las especies de trips de la región Oriental asociadas a gramíneas de los géneros Stenchaetothrips y Fulmekiola, estas sedas son especialmente largas, normalmente claramente más largas que el par de sedas ocelar III. Sedas del par ocelar III Las sedas ocelares del par III se sitúan cerca de los márgenes anterolaterales del triángulo ocelar en los adultos de Thripinae. Sin embargo, la posición de este par de sedas, cuando se colocan dentro del triángulo ocelar, es un buen discriminante en la identificación de las especies de trips, especialmente cuando, como en Scirtothrips dorsalis, estas sedas se colocan entre los ocelos posteriores. Distancia entre las bases de las sedas ocelares III La distancia entre las bases de las sedas ocelares III es a veces un discriminante útil, aunque esta distancia está frecuentemente interrumpida en las preparaciones microscópicas de escasa calidad por lo que este carácter taxonómico debe ser utilizado con mucha precaución. Sedas postoculares principales Las sedas postoculares principales no son fáciles de medir, por lo que este carácter no es un buen discriminante. Sin embargo, son claramente más largas en Frankliniella occidentalis que en su especie próxima, Frankliniella intonsa, mientras que en Bradinothrips musae estas sedas son excepcionalmente largas. Sedas postoculares I Dentro del género Frankliniella, la presencia o ausencia del par de sedas medial situado en la fila de sedas postoculares suele ser un buen carácter para diferenciar especies. Sin embargo, hay muy pocos estudios buenos sobre la variación inter e intra poblacional de este carácter en las especies de Frankliniella sudamericanas, pudiendo ocurrir que este carácter taxonómico no sea tan válido como sugiere la literatura publicada al respecto. En el trips oriental del arroz, Stenchaetothrips biformis, la presencia de estas sedas es variable. Los Phlaeothripidae normalmente tienen un par de sedas posteroculares principales y unas pocas especies presentan sedas engrosadas sobre tubérculos en la zona de las mejillas. Número de pares de sedas alargadas pronotales El número de pares de sedas alargadas situadas en el pronoto es un carácter discriminante útil cuando estamos identificando Thripinae. Los miembros del género Scolothrips tienen 6 pares de sedas largas. La mayor parte de las especies de Frankliniella pueden distinguirse de otros Thripinae por la presencia de 4 o 5 pares de sedas largas. Los miembros del género Thrips normalmente tienen 2 pares de sedas largas como muchas especies de varios géneros. En Phlaeothripidae normalmente hay cinco pares de sedas pronotales principales, las sedas anteromarginales, anteroangulares, mediolaterales, epimerales y posteroangulares y el prosterno normalmente lleva dos pares de escleritos mediales, las placas praepectales y el probasisterno. Número de pares de sedas alargadas posteroangulares del pronoto El número de pares de sedas largas posteroangulares es un carácter muy útil cuando estamos identificando Thripinae.La ausencia de estas sedas largas excluye rápidamente muchas de las especies plaga más comunes, además de las especies incluidas en el género Anaphothrips. Si los ejemplares no se preparan con cuidado, especialmente a la hora de elaborar las preparaciones microscópicas, las sedas largas pueden destruirse. La presencia originaria de dichas sedas puede ser reconocida por el tamaño de los poros basales situados en el margen posterior del pronoto, de los que las sedas se han desprendido. Alas Unas pocas especies de Thripinae tienen adultos de ambos sexos que carecen de alas (ápteros) y otras pocas especies los adultos son micrópteros pues poseen alas poco desarrolladas (no más largas que la anchura del tórax). Varias especies asociadas a gramíneas tienen hembras con las alas muy desarrolladas, pero posee machos ápteros. Frankliniella fusca produce adultos de ambos sexos de los dos tipos (macrópteros y micrópteros). En Phlaeothripidae las alas anteriores no tienen venas, pero normalmente hay hay tres o cuatro sedas sub-basales cerca del margen anterior. Estas alas a veces, están constreñidas medialmente y poseen un número variable de cilios duplicados en posición posterior distal. Color de las alas anteriores Las diferentes tonalidades de sombreado (claro y oscuro) requieren una considerable experiencia para ser evaluadas. Este carácter taxonómico no es un buen discriminante para los usuarios con poca experiencia. Cuando se tienen dudas, hay que intentar buscar otro carácter taxonómico. Color del extremo apical del ala anterior El color del ápice del ala anterior es muy útil como discriminante solamente cuando su color es diferente del color de la región subapical del ala anterior, como en algunas especies de Caliothrips. Superficie del ala anterior En muchas especies de Thripidae, la superficie de las alas anteriores está cubierta por microtricos. El ala de Parthenothrips está muy reticulada y en las especies de Retithrips lleva dos o más callosidades a modo de burbuja. Margen anterior del primer par de alas La vena costal del ala anterior lleva una fila de sedas robustas y una fila de cilios más finos, aunque una de esas filas no está desarrollada en algunas especies. Cilios del margen posterior del primer par de alas Los cilios situados en el margen posterior del ala anterior son normalmente ondulados aunque en algunas especies son rectos. Dentro del género Scirtothrips esta diferencia incluso se da entre especies muy cercanas y próximas. Sedas costales situadas en la región medial del primer par de alas La relación entre la longitud de las sedas costales situadas en el ala anterior respecto a la anchura del ala es un discriminante útil para muchos taxones en Thripidae. Fila de sedas de la vena principal del ala anterior La condición de la fila de sedas situadas en la vena principal y en la vena secundaria del ala anterior son discriminantes importantes en la identificación de Thripidae. Todas las especies de Frankliniella tienen filas de sedas continuas en ambas venas. También varias especies del género Thrips tienen esta fila de sedas casi completa, aunque muchas especies de Thrips poseen la fila interrumpida, incompleta. Las especies de Echinothrips, Hydatothrips y Neohydatothrips tienen la fila de sedas de la vena principal continua, pero carecen de sedas en la vena secundaria. Fila de sedas de la vena secundaria del ala anterior La condición de la fila de sedas situadas en la vena principal y en la vena secundaria del ala anterior son discriminantes importantes en la identificación de Thripinae. Todas las especies de Frankliniella tienen filas de sedas continuas en ambas venas, al igual que unas pocas especies del género Thrips. Las especies de Echinothrips, Hydatothrips y Neohydatothrips carecen de sedas en la vena secundaria. Todas las especies del género Thrips tienen una fila continua de sedas sobre la vena secundaria. Clavus del ala anterior La seda terminal situada en el clavus del ala anterior es normalmente más larga que la seda subterminal. En unas pocas especies, la seda subterminal es claramente más larga que la seda terminal. Este carácter taxonómico es particularmente útil en la diferenciación de especies Orientales del género Thrips, como T. florum y T. hawaiiensis. Ápice de las tibias anteriores El ápice de las tibias anteriores es normalmente simétrico alrededor de la base del primer artejo tarsal. En Arorathrips mexicanus el ápice (apex) de la tibia anterior se prolonga alrededor del margen externo del tarso anterior. Las especies del género Odontothrips tienen una o dos pequeñas uñas colocadas en el ápice ventral interno de la tibia anterior. Tarsos mediales y posteriores Cada tarso medial y posterior puede estar formado por uno o dos artejos, dependiendo de las especies. En Phlaeothripidae el margen apical del tarso puede estar prolongado en un garfio, el hamus, situado ventralmente al pretarso. Triángulo metanotal En unas pocas especies de Panchaetothripinae el metanoto lleva un triángulo prominente con rica escultura. Sensilos campaniformes del metanoto El metanoto normalmente lleva un par de sensilos campaniformes (poros) sobre su mitad posterior. Estos sensilos campaniformes se encuentran desarrollados en muchas especies de Thripinae y aunque es un discriminante muy útil entre Frankliniella occidentalis y Frankliniella intonsa, a veces su presencia es variable dentro de las especies. Posición de las sedas mediales del metanoto El par de sedas mediales situado en el metanoto se coloca en el margen anterior del esclerito en todas las especies de Frankliniella y Megalurothrips. La posición de estas sedas es variable entre especies del género Thrips, algunas veces se colocan en el margen anterior aunque más frecuentemente se sitúan bastante más atrás en el esclerito. Área medial del metanoto La escultura del metanoto es a menudo un poderoso discriminante en la identificación de determinadas especies. Muchas especies poseen un área de reticulación equiangular, aunque a veces pueda ser bastante débil. Otras especies tienen una escultura característica, mucho más compleja. Líneas de escultura situadas en el área central del metanoto Los detalles acerca del patrón de las líneas de escultura del metanoto son importantes en el reconocimiento de las especies. Unas pocas especies carecen de cualquier escultura visible, aunque muchas especies de Thripidae tienen un patrón muy característico de líneas. Endofurca metatorácica Las especies de la subfamilia Dendrothripinae y también unas pocas especies de Panchaetothripinae, tienen la endofurca metatorácica desarrollada en una estructura alargada con un par de brazos curvados a modo de lira antigua. En otras especies el par de brazos forma una estructura con forma de Y. La mayor parte de los Thripinae tienen una endofurca metatorácica sencilla y transversal. Unas pocas especies presentan una espínula longitudinal desarrollada en la región medial. Sedas lateromarginales del terguito abdominal II El número de sedas que forma una fila longitudinal en los márgenes laterales del terguito II, 3 o 4, es un discriminante útil entre las distintas especies del género Thrips. En las especies del género Frankliniella la seda anterior de esta fila normalmente se coloca lateralmente en el pleurito, no sobre el margen del terguito II. Escultura de los tercios laterales de los terguitos III – VI Este carácter taxonómico es muy útil dentro del género Caliothrips (Panchaetothripinae), cuyas especies son similares en tamaño y color y pueden ser rápidamente diferenciadas por la forma de la escultura lateral de los terguitos abdominales. Superficie de los tercios laterales de los terguitos abdominales Los tercios laterales de cada terguito abdominal poseen filas de numerosos diminutos microtricos, en muchas especies, concretamente en Scirtothrips y en el grupo Hydatothrips. Las especies del género Dendrothripoides tienen un alineamiento característico de microtricos muy grandes con unas bases muy anchas. Las especies del género Pseudodendrothrips tienen un patrón muy característico de filas de pequeñas líneas longitudinales situadas lateralmente en los terguitos abdominales. En Phlaeothripidae el terguito I está muy reducido a una placa llamada pelta y los terguitos II-VII normnalmente llevan dos pares de sedas sigmoidales cuya función es la de servis de anclaje para las alas. El par de sedas principal situado en el margen posterior del terguito IX se denominan respectivamente B1, B2 y B3. Par medial de sedas presentes en los terguitos abdominales IV-V Las especies de Sericothripinae y Dendrothripinae normalmente tienen un par medial de sedas alargadas colocadas en los terguitos abdominales que están muy próximas en la región medial. Este carácter taxonómico también se da en algunos Panchaetothripinae. Sedas similares también aparecen en algunas especies, no en todas, de Scirtothrips. La mayor parte de las especies de Thripinae tienen las sedas mediales tergales pequeñas e inconspicuas. Marcas de color en los terguitos IV-VI El patrón del sombreado en los terguitos y en las costillas tergales antecostales es útil para distinguir entre especies de Scirtothrips. Par de ctenidios presentes en los terguitos abdominales V-VIII Este es uno de los caracteres más importantes para diferenciar géneros de Thripinae. Los pares de ctenidios se desarrollan lateralmente en los terguitos solamente en los géneros Frankliniella y Thrips. Estas estructuras consisten en una pequeña y oblicua fila de microtricos regulares situada en una costilla con escultura. Los ctenidios no deben confundirse con los acúmulos irregulares de microtricos que se desarrollan lateralmente cerca de los espiráculos en algunos géneros como Megalurothrips. Ctenidios del terguito abdominal VIII Es uno de los caracteres más útiles para diferenciar géneros de Thripinae. En el género Frankliniella y en los géneros próximos a éste los ctenidios situados en el terguito VIII se colocan anterolateralmente a los espiráculos. En el género Thrips y en géneros próximos los ctenidios situados en el terguito VIII se colocan posteromedialmente a los espiráculos. Peine posteromarginal de microtricos del tergito VIII La presencia o ausencia del peine de microtricos del margen posterior del terguito VIII es un discriminante muy poderoso para la identificación de las especies. Sin embargo, en las preparaciones microscópicas de escasa calidad el margen posterior del terguito VIII puede aparecer enrollado, de forma que el peine de microtricos queda enmascarado. A veces esta distorsión puede no ser tenida en cuenta, pero puede ser fácilmente reconocida porque los márgenes posteriores se vuelven gruesos y el propio margen queda definido por una línea transversal anormalmente gruesa. Microtricos posteromarginales del tergito VIII La estructura de los microtricos y el peine que producen varía más o menos de forma continua entre las especies. A pesar de esto, la forma de peine es un discriminante válido. En algunas especies los microtricos son largos, delgados y regulares. En unas pocas especies los microtricos coalescen en grupos irregulares, en otras especies tienen bases triangulares anchas con los ápices alargados y puntiagudos. Por último, hay especies en las que los microtricos están muy poco desarrollados y son irregulares. Área de escultura situada cerca del espiráculo en el terguito VIII Las especies del género Chaetanaphothrips tienen un área de escultura muy característica que se prolonga anteromedialmente a cada espiráculo en el terguito VIII. Esta estructura no se encuentra en esta posición en otros Thripidae. Sedas del terguito abdominal X Las mayor parte de las hembras adultas de las especies de Thripidae poseen sedas alargadas en el extremo apical del abdomen. Las hembras adultas del género Limothrips tienen un par de fuertes sedas a modo de espinas colocadas en el terguito X. Las hembras de las especies del género Corynothrips tienen sedas largas en el terguito X que son rizadas en la zona lateral cerca del ápice. En Rhipiphorothrips los ápices de estas sedas son también rizados. Pleuroterguitos abdominales Thrips tabaci se diferencia fácilmente de otras especies del género Thrips por la presencia de filas espaciadas de microtricos en los pleuroterguitos abdominales. Sedas discales de los pleuroterguitos abdominales Este carácter taxonómico es muy útil para diferenciar algunas especies del género Thrips, a pesar de que es un carácter variable en la especie australiana Thrips imaginis. Esternito abdominal II de la hembra Las hembras adultas en Thripinae normalmente carecen de áreas glandulares esternales, al contrario que los machos, en donde estas estructuras son muy comunes. Las hembras de Chaetanaphothrips signipennis tienen pequeñas áreas glandulares transversales en el esternito III. Las hembras de Frankliniella australis normalmente tienen un par de pequeñas áreas glandulares en el esternito III, aunque la presencia y el tamaño de dichas áreas varía entre individuos. En Phlaeothripidae, a menudo aparecen sedas accesorias en número variable, dispuestas en la región medial de los esternitos posteriores. Los machos de Phlaeothripinae normalmente tienen áreas porosas glandulares sobre los esternitos VIII y en algunos géneros como Abiastothrips hay un área glandular reticulada sobre los esternitos V-VII. La estructura de la genitalia del macho, la zona terminal apical esclerotizada del aedeagus, es un carácter válido para la identificación de especies en el género Haplothrips. Forma de la cabeza Las antenas de Thripidae normalmente sobresalen alineadas con el margen anterior de los ojos compuestos, pero en algunas especies la cabeza se proyecta claramente por delante de los ojos compuestos. Sin embargo, este carácter taxonómico a veces depende de la orientación que toma la cabeza del ejemplar montado en la preparación microscópica. Esternito abdominal II Es un carácter útil en el género Frankliniella. La mayor parte de los miembros de este género no poseen sedas discales esternales, pero unas pocas especies amarillas como Fr. williamsi tienen 1 o 2 sedas discales situadas medialmente en el esternito II. Esternitos abdominales IV-VI Es un carácter taxonómico importante para diferenciar especies del género Thrips. Los esternitos abdominales normalmente tienen 3 pares de sedas marginales, pero en el disco de cada esternito algunas especies portan una fila de sedas transversal regular o irregular. En la especie T. setipennis, estas sedas discales se colocan cerca del margen posterior. Unas pocas especies tienen las sedas discales restringidas a las áreas laterales de los esternitos. Un grupo de especies orientales del género Thrips carece de sedas discales en el esternito VII. Número de sedas discales presentes en el esternito abdominal V El número de sedas discales situadas en la región medial de los esternitos abdominales es un carácter taxonómico importante para diferenciar especies del género Thrips. Sin embargo, el número de sedas discales varía dentro de las especies, a diferencia de las sedas marginales de los esternitos cuyo número es constante. Sedas discales del esternito abdominal VII Es un carácter útil para diferenciar especies del género Thrips, porque un grupo de especies orientales tiene las sedas discales en la región medial de los esternitos abdominales pero carecen de sedas discales en el esternito VII. Sedas mediales marginales del esternito abdominal VII El par medial de sedas marginales del esternito VII presenta una posición variable respecto al margen en los diferentes miembros de Thripinae. En las especies de Frankliniella este par de sedas se coloca en el margen. En las especies del género Thrips el par medial de sedas del esternito VIII se coloca normalmente delante del margen del esternito. Sedas submediales marginales del esternito abdominal VII En las especies más comunes de Thripidae las sedas submediales y laterales del margen del esternito VII se colocan en el margen, mientras que el par medial de sedas marginales se coloca submarginalmente, concretamente en muchas especies del género Thrips. Taeniothrips picipes es una excepción porque tanto el par de sedas marginal submedial como el medial se colocan muy por delante del margen, aunque las sedas laterales de estos tres pares de sedas parten del margen. Microtricos de los esternitos abdominales V-VI Un carácter taxonómico muy útil para diferenciar las especies del género Scirtothrips es la extensión del campo de microtricos de los esternitos abdominales. Color del cuerpo Dentro de la familia Thripidae, el color del cuerpo varía entre las especies. Los individuos adultos de las especies que son marrones oscuros cuando alcanzan la madurez son de color pálido o incluso de dos colores durante algún tiempo después de que emergen del estadio pupal. El empleo de este carácter taxonómico requiere una considerable experiencia y no debería ser utilizado en los primeros pasos de la identificación. En algunas especies comunes como Thrips tabaci el color del cuerpo depende de las temperaturas que se dan durante el desarrollo larvario y la pupación, de forma que los adultos son marrones en épocas frías y amarillos cuando el tiempo es más cálido. Unas pocas especies de trips fitófagos están conspicuamente bicoloreados por lo que a menudo se pueden distinguir de forma rápida. RESULTADOS Suborden Terebrantia Familia Aeolothripidae Género Aeolothrips Aeolothrips albicinctus Aeolothrips collaris Aeolothrips cursor Aeolothrips ericae Aeolothrips gloriosus Aeolothrips intermedius Aeolothrips melaleucus Aeolothrips propinquus Aeolothrips tauricus Aeolothrips tenuicornis Género Rhipidothrips Rhipidothrips brunneus Familia Melanthripidae Género Melanthrips Melanthrips fuscus Melanthrips pallidior Género Orothrips Orothrips priesneri Familia Thripidae Género Heliothrips Heliothrips haemorrhoidalis Género Dendrothrips Dendrothrips ornatus Dendrothrips saltator Género Sericothrips Sericothrips bicornis Sericothrips staphylinus Género Neohydatothrips Neohydatothrips gracilicornis Género Drepanothrips Drepanothrips reuteri Género Scirtothrips Scirtothrips inermis Género Chirothrips Chirothrips aculeatus Chirothrips manicatus Chirothrips spinulosus Género Limothrips Limothrips angulicornis Limothrips cerealium Limothrips denticornis Género Anaphothrips Anaphothrips obscurus Género Rubiothrips Rubiothrips ferrugineus Rubiothrips silvarum Rubiothrips sordidus Rubiothrips validus Género Aptinothrips Aptinothrips elegans Aptinothrips karnyi Aptinothrips rufus Aptinothrips stylifer Género Tamaricothrips Tamaricothrips tamaricis Género Oxythrips Oxythrips ajugae Oxythrips bicolor Oxythrips nobilis Oxythrips quercicola Oxythrips tristis Oxythrips ulmifoliorum Género Frankliniella Frankliniella intonsa Frankliniella occidentalis Frankliniella pallida Frankliniella tenuicornis Género Kakothrips Kakothrips firmoides Género Taeniothrips Taeniothrips picipes Género Ceratothrips Ceratothrips ericae Género Tenothrips Tenothrips discolor Tenothrips frici Tenothrips pilosus Género Mucterothrips Mycterothrips albidicornis Mycterothrips latus Género Eremiothrips Eremiothrips dubius Eremiothrips manolachei Género Stenothrips Stenothrips graminum Género Odontothrips Odontothrips cytisi Odontothrips ignobilis Odontothrips ulicis Género Scolothrips Scolothrips latipennis Género Bolacothrips Bolacothrips jordani Género Thrips Thrips angusticeps Thrips atratus Thrips brevicornis Thrips dilatatus Thrips flavus Thrips fuscipennis Thrips incognitus Thrips juniperinus Thrips major Thrips mediterraneus Thrips minutissimus Thrips nigropilosus Thrips paucisetosus Thrips physapus Thrips pillichi Thrips tabaci Thrips trehernei Thrips urticae Thrips validus Thrips verbasci Thrips vuilleti Thrips vulgatissimus Familia Phlaeothripidae Idolothripinae Género Allothrips Allothrips pillichelus Género Bacillothrips Bacillothrips nobilis Género Bolothrips Bolothrips cingulatus Bolothrips dentipes Bolothrips icarus Bolothrips insularis Género Compsothrips Compsothrips albosignatus Compsothrips maroccanus Género Cryptothrips Cryptothrips nigripes Género Megalothrips Megalothrips bonanii Género Megathrips Megathrips inermis Género Priesneriella Priesneriella clavicornis Género Pseudocryptothrips Pseudocryptothrips meridionalis Phlaeothripinae Género Amphibolothrips Amphibolothrips marginatus Género Apterygothrips Apterygothrips piceatus Apterygothrips priesneri Género Bebelothrips Bebelothrips latus Género Cephalothrips Cephalothrips coxalis Cephalothrips monilicornis Género Haplothrips Haplothrips acanthoscelis Haplothrips aculeatus Haplothrips andresi Haplothrips anthemidinus Haplothrips crassicornis Haplothrips distinguendus Haplothrips frustrator Haplothrips fuliginosus Haplothrips hispanicus Haplothrips marrubicola Haplothrips niger Haplothrips phyllopillus Haplothrips reuteri Haplothrips setiger Haplothrips tritici Género Hindsiothrips Hindsiothrips bonessi Hindsiothrips navarrensis Género Hoplothrips Hoplothrips longisetis Hoplothrips pedicularius Hoplothrips semicaecus Hoplothrips ulmi Género Karnyothrips Karnyothrips sp. Género Liothrips Liothrips reuteri Liothrips setinodis Género Phlaeothrips Phlaeothrips coriaceus Género Tylothrips Tylothrips osborni Género Gynaikothrips Gynaikothrips ficorum Género Poecilothrips Poecilothips albopictus CLAVE DE LAS FAMILIAS DE LOS TISANOPTEROS DE EUSKAL HERRIA 1.- Segmento abdominal X tubular en ambos sexos; hembra sin ovopositor visible, macho con la base del tubo excavada ventralmente. Ala anterior sin venas longitudinales y carente de sedas excepto en el margen anterior o sub-basal; superficie del ala sin microtricos ………………… Phlaeothripidae -Segmento abdominal en ambos sexos no tubular, siempre dividido ventralmente y frecuentemente con una hendidura longitudinal, hembra con ovopositor conspicuo. Ala anterior normalmente con tres venas longitudinales bien desarrolladas, llevando al menos la superior un número variable de sedas; superficie del ala con abundantes microtricos de pequeño tamaño…….. 2 2.- Terguito abdominal X de las hembras con un par de tricobotrios (sedas sensoriales que parten de estructuras básales especializadas). Hembras con ovopositor poco desarrollado. Esternito VII conspicuo, bien desarrollado. Animales de pequeño tamaño…..Merothripidae -Terguito abdominal X de las hembras sin tricobotrios ………………… 3 3.- Sensoria situados en los artejos III y IV con forma de banda, anchos o estrechos, nucnca bajo la forma de tricomas; antena con 9 artejos; alas anteriores anchas con los apices redondeados, sedas de las venas pequeñas…….. Aeolothripidae -Sensoria situados en los artejos III y IV, bajo la forma de tricomas bifurcados o sencillos; antena con siete u ocho artejos normalmente, (en raras ocasiones con seis o nueve); alas anteriores con los márgenes apicales normalmente puntiagudos, sedas de las venas largas ……………. Thripidae FAMILIA AEOLOTHRIPIDAE 1.- Protórax con sedas posteroangulares y posteromarginales de gran tamaño. Vértex con al menos un par de sedas prominentes. Cabeza con al menos dos pares de sedas largas detrás de los ojos; artejos antenales VII-IX claramente separados; palpos labiales con dos artejos; segundo artejo de los tarsos anteriores sin uña……. Melanthrips -Protórax sin sedas de gran tamaño en sus ángulos y márgenes posteriores. Vértex sin sedas conspicuas………… 2 2.- Antena con todos los artejos independientes, no fusionados. Artejo antenal III alargado en forma de maza. Artejos antenales III y IV con dos áreas sensoriales distales y ovales. Primer par de alas con dos bandas transversales……. Orothrips Antena con los tres o los cinco últimos artejos unidos. Artejo antenal III de tamaño similar al resto de los artejos, de aspecto normal. Artejos antenales III y IV con una única área sensorial…………… 3 3.- Artejos antenales VII-IX fusionados. Pronoto con un par de largas sedas posteroangulares. …………….. Rhypidothrips -Artejos antenales V-IX fusionados. Pronoto sin sedas posteroangulares conspicuas…… ………………………………. Aeolothrips GÉNERO AEOLOTHRIPS 1.- Cuerpo bicoloreado. Cabeza, tórax, extremidades y primeros terguitos abdominales amarillos que contrastan con los últimos segmentos del abdomen que son castaños oscuros…..2 Cuerpo uniformemente castaño oscuro o bicoloreado de blanco y negro nunca amarillo claro….. 3 2.- Artejo antenal III completamente claro, artejo antenal IV con su región basal clara siendo el resto castaño oscuro. Terguito abdominal X con su región medial clara y sus zonas laterales castañas oscuras………. Aeolothrips tauricus Derbeneva, 1959 -Artejo antenal III bicoloreado, la mitad superior es castaño oscura y la mitad inferior es clara. Artejo antenal IV completamente castaño oscuro. Terguito abdominal X castaño oscuro……………. Aeolothrips gloriosus Bagnall, 1914. 3.-Cuerpo bicoloreado. Los segmentos abdominales II y III (y la parte anterior del IV en los machos) blancos que constrantan con el resto del cuerpo de color castaño oscuro. Terguito abdominal I de la hembra con una densa estriación longitudinal a lo largo de todo el terguito. Hembras normalmente micrópteras……. Aeolothrips albicinctus Haliday, 1836 -Coloración del cuerpo uniforme. Segmentos abdominales II y III castaños, del mismo color que la cabeza y el tórax Terguito I de las hembras sin estriación profusa……. 4 4.- Alas poco desarrolladas, de 200-260 micrómetros de longitud…………….…. ……………….. Aeolothrips cursor Priesner, 1938 -Especies macrópteras…………………………………… 5 5.- Margen posterior de las alas anteriores oscuro, excepto en sus ápices. Alas con 1 0 2 bandas oscuras transversales……………………. Aeolothrips melaleucus Haliday, 1852 El margen posterior de las alas anteriores situado entre las dos bandas transversales es de color claro………….. 6 6.- Anillo venial que rodea el ápice del ala anterior tan oscuro como las venas presentes en las bandas oscuras transversales ………………7 -Anillo venial que rodea el ápice del ala anterior más claro que las venas presentes en las bandas oscuras transversales…………………. 8 7.- Sensorios presentes en los artejos antenales III y IV de 0.3-0.5 veces la longitud del correspondiente artejo. Hembra con las sedas accesorias del esterniro VII alejadas del amrgen posterior. Terguito IX del macho con claspers y un par de fuertes sedas curvadas…………..Aeolothrips tenuicornis Bagnall, 1926 -Sensorios situados en los artejos antenales III y IV muy largos, que sobrepasan las regiones mediales de dichos artejos. Sedas accesorias situadas en el esternito VII de las hembras más próximas al margen posterior. Terguito IX del macho con “claspers” pero sin un par de fuertes sedas curvadas a modo de gancho……………………………….. ……………………..Aeolothrips propinquus Bagnall, 1924 8.- Machos con “claspers” y fuertes sedas curvadas en el terguito IX ………….. 9 -Terguito IX de los machos con “claspers” pero sin fuertes sedas curvadas………… ……………………………………. Aeolothrips intermedius Bagnall, 1934 9.- Artejos antenales I y II amarillos, tan pálidos como la base del III. Abdomen de la hembra castaño claro, segmentos III-IV y X frecuentemente pálidos……………… …………………….. Aeolothrips ericae Bagnall, 1920. - Artejo antenal I castaño oscuro, artejo II con su región basal oscura siendo el resto de color claro. Artejo antenal III claro, excepto su extremo apical que es ocuro, como el resto de los artejos antenales. Abdomen de la hembra castaño oscuro…………………………… ……………………… Aeolothrips collaris Priesner, 1919 GÉNERO RHIPIDOTHRIPS Artejo antenal II claro, del mismo color que el artejo III. Protórax, más pálido que la cabeza y el petrotórax con tres o cuatro partes de sedas situadas en el margen posterior entre las sedas posteroangulares. Región basal y extremo apical de las tibias de las patas anteriores y mediales amarillas……. Rhipidothrips brunneus Williams, 1913 GÉNERO MELANTHRIPS 1.- Vena principal del ala anterior con microsedas situadas entre las macrosedas en la región comprendida entre las bandas transversales. Esternito IV de la hembra con sedas accesorias. Muy abundante en crucíferas……. Melanthrips fuscus Sulzer, 1776 -Vena principal del ala anterior sin microsedas colocadas entre las macrosedas en la región comprendida entre las bandas transversales. Esternito IV de la hembra sin sedas accesorias………….. Melanthrips pallidior Priesner, 1919 GÉNERO OROTHRIPS Cuerpo de color castaño oscuro. Artejo antenal III de color claro en su mitad basal. Ala anterior con dos bandas oscuras, siendo la banda proximal más corta que la banda apical. Sedas de la cabeza y el pronoto de pequeño tamaño. Pronoto sin sedas posteroangulares desarroladas…………… Orothrips priesneri (Titschack, 1958) CLAVE DE GÉNEROS DE LA FAMILIA THRIPIDAE 1.- Cabeza profusamente reticulada; alas bien desarrolladas,(macrópteros); vena principal del ala anterior más o menos fusionada a la vena costa; cuerpo castaño oscuro, tibias amarillas, especies de distribución tropical, en Euskal Herria se localizan en invernaderos. Ala anterior clara, con el ápice redondeado, sedas mayores situadas sobre las venas alares de reducido tamaño; todas las tibias de color amarillo………. Heliothrips Cabeza sin reticulación acusada; algunas especies son ápteras o con la vena principal y la vena costa claramente separadas, o no asociadas con invernaderos…….. 2 2.- Furca del metatórax con forma de lira, que se extiende hacia el mesotórax. Terguitos abdominales con un par de sedas mediales muy próximas entre sí. Primer par de alas con los extremos anteriores curvos. Antena con 8-9 artejos. Conos sensoriales principales del artejo antenal VI situados en la región medial del segmento……. Dendrothrips -Furca del metetórax sin forma de lira, circunscrita a dicha región y sin extenderse al mesotórax………… 3 3.- Superficie de los terguitos abdominales cubierta completamente con numerosos microtricos pequeños o al menos las zonas laterales de los terguitos cubiertas con ocho líneas de microtricos cada una……….. 4 -Terguitos abdominales sin numerosos microtricos…….. 7 4.- Microtricos situados medialmente y lateralmente en los terguitos abdominales; ambos sexos de color castaño oscuro; algunas veces micrópteros. Anatena con ocho artejos…5 -Microtricos situados solamente en el tercio lateral de los terguitos; especies de pequeño tamaño y generalmente pálidas, siempre macrópteras. Antena con 6-8 artejos……. 6 5.- Antena con seis artejos………….. Drepanothrips -Antena con ocho artejos…………… Scirtothrips 6.- Terguitos abdominales II-VII con el par medial de sedas, sedas S1, del mismo tamaño y situadas a la misma distancia en los correspondientes tergos. Terguitos I-VIII completamente cubiertos de microtricos. Peines de microtricos situados a lo largo de los márgenes posteriores de los terguitos I-VIII completos. Metaescutelo y escutelo fusionados. Especies micrópteras…………… Sericothrips -Terguitos abdominales II-VII con el par de sedas S1 de diferente tamaño y no equidistantes en los correspondientes tergos. Terguitos abdominales II-IV con el par de sedas S1 de pequeño tamaño y muy próximas entre ellas, la longitud y la distancia del par S1 se incrementa gradualmente de los tergos anteriores a los posteriores. Peines de microtricos situados en los márgenes posteriores de los terguitos abdominales I-VII interrumpidos medialmente. Metaescutelo y escutelo independientes. Especies macrópteras………. Neohydatothrips 7.- Ambos sexos con el pronoto de forma trapezoidal, más ancho en la parte posterior que en la region anterior………. G. Chirothrips -Ambos sexos con el pronoto rectangular………. 8 8.- Hembras con un par de fuertes sedas a modo de espinas situadas en el terguito abdominal X y machos con un par de sedas engrosadas situadas medialmente sobre tuberculos cuadrados en el terguito abdominal IX…………… Limothrips -Hembras sin sedas fuertes a modo de espinas en el terguito abdominal X………. 9 9.- Conos sensoriales de los artejos antenales III y IV simples, no bifurcados, normalmente ápteros…………… 10 - Conos sensoriales bifurcados sobre los artejos antenales III y IV; normalmente macrópteros, si son ápteros ambos sexos con conos sensoriales bifurcados o con al menos un par de sedas posteroangulares bien desarrolladas…….. 11 10.- Pronoto sin sedas posteroangualres alargadas. Cuerpo amarillo dorado; abdomen alargado, ligeramente mas ancho que el tórax, cabeza más larga que ancha; terguitos y esternitos sin craspedum marginal……… Aptinothrips - Pronoto con sedas posteroangualres desarrolladas. Ángulos posteriores del pronoto con dos pares de sedas alargadas; par de sedas ocelar I ausente, par ocelar III alargado situado fuera del triángulo ocelar y cercano a los ojos compuestos; cuerpo de color amarillo; región final del segmento abdominal X castaña….. Bolacothrips 11.- Pronoto sin sedas posteroangulares desarrolladas. El artejo antenal VI puede estar más o menos dividido por una sutura oblicua cerca del ápice; algunas veces ápteros…… 12 - Pronoto con al menos un par de sedas posteroangulares bien desarrolladas……. 13 12.- Terguito abdominal VIII con un peine de micrtricos situado a lo largo de su margen posterior. Sedas mediales (S1) de los terguitos abdominales II-VIII pequeñas y separadas entre sí. Sedas (s6) de los terguitos situadas en los márgenes posteriores de los mismos. Machos con dos pares de sedas engrosadas en el terguito abdominal IX….. Anaphothrips -Terguito abdominal VIII sin peine de microtricos en su margen posterior. Sedas S1 de los terguitos II-VIII largas y con sus bases muy próximas. Sedas S6 de los terguitos situadas lejos del margen posterior en el área pleurotergal. Machos sin sedas engrosadas en el terguito abdominal IX…….. Rubiothrips 13.- Pronoto con un par de sedas posteroangulares conspicuas…….. 14 -Pronoto con dos pares de sedas posteroangulares desarrolladas……16 14.- Antena con nueve artejos. Artejos antenales VI-IX fusionados. Artejo antenal III con un cono sensorial sencillo o bifurcado, artejo IV con un cono sensorial bifurcado. Ferna del prosterno dividida en dos partes.machos con un par de apéndices en el margen posterior del terguito abdominal IX……. Eremiothrips -Antena con ocho artejos. Artejo antenal III siempre con un tricoma sensorial bifurcado, con forma de tenedor. Ferna del prosterno no dividida. Machos sin apéndices en el margen posterior del terguito abdominal IX………. 15 15.- Longitud de la seda posteroangular menor o igual que 15 micras. Terguito abdominal IX del macho sin sedas engrosadas…….. Tamaricothrips -Longitud de la seda posteroangular mayor que 20 micras. Terguito abdominal IX de los machos con sedas engrosadas……….. Oxythrips 16.- Cono sensorial externo presente en el artejo antenal VI ensanchado en su base; tibias anteriores normalmente con una o dos uñas distales, pero si éstas no están presentes entonces el segmento anterior del tarso presenta un pequeño garfio o tubérculo ventrolateral; tres pares de sedas ocelares presentes; metanoto garfio o tubérculo ventrolateral; Tres pares de sedas ocelares presentes; metanoto con dos pares de sedas situadas en el margen anterior; macrópteros, cuerpo de color castaño; en flores de leguminosas……. Odontothrips. - Cono sensorial externo presente en el artejo antenal VI no ensanchado en la base. Tibias anteriores sin dientes…….. 17 17.- Pronoto con 12 sedas muy largas, al menos cada una de ellas tiene la longitud de la mitad del pronoto. Alas anteriores con dos bandas oscuras. Sedas situadas en las venas del primer par de alas el doble de largas que la anchura del ala. Predadores de Tetranychus…………….. Scolothrips -Pronoto a lo sumo con 10 sedas de menor longitud. Sedas de las venas del ala anterior aproximadamente de la misma longitus que la anchura de esta……. 18 18.-Antena con siete artejos; terguitos abdominales con pares laterales de ctenidios; par de sedas ocelar I ausente………. 19 -Antena con ocho artejos; terguitos abdominales con o sin ctenidios laterales……. 20 19.- Par submedial de sedas posteroculares situadas detrás de la línea principal que describen las sedas posteroculares; esternitos sin sedas accesorias; par medial de sedas presentes en los esternitos abdominales III-VI normalmente situadas por delante del margen posterior…….. Stenothrips -Sedas posteroculares dispuestas en una línea continua, sin pares desplazados; esternitos frecuentemente con sedas accesorias; sedas mediales de los esternitos abdominales II-VI situadas en el margen posterior…….. Thrips 20.- Cabeza con dos pares de sedas ocelares………. 21 -Cabeza con tres pares de sedas ocelares…………. 22 21.- Terguitos abdominales sin ctenidios laterales, a veces en el terguito VIII está presente un grupo de microtricos irregulares situados cerca de ñlos espirñaculos; terguito abdominal VIII con un peine completo de largos microtricos en el margen posterior; esternitos sin sedas accesorias; tercer par de sedas ocelares III más largo que la distancia entre los dos ocelos……. Taeniothrips -Terguitos abdominales V-VIII con pares de ctenidos, que en el terguito VIII pasan cerca del espiráculo; esternitos frecuentemente con sedas accesorias; sedas ocelares y microtricos del terguito abdominal VIII no muy largos……. Thrips 22.- Terguitos con ctenidios. Ambas venas del ala anterior recubiertas de sedas. Sedas anteromarginales y anteroangualres del pronoto bien desarrolladas, al menos la mitad de largas que las sedas posteroangualres……. 23 -Terguitos abdominales sin ctenidios. Venas del ala anterior parcialmente recubiertas de sedas. Sedas anteromarginales y anteroangulares del pronoto cortas, del mismo tamaño que las sedas del disco pronotal……. 24 23.-Terguitos abdominales V-VIII con ctenidios bien desarrollados; tarsos anteriores sin uña terminal; margen posterior del pronoto normalmente con un par de pequeña sedas dispuestas medialmente entre las sedas posteromarginales……… Frankliniella -Terguitos abdominales VII y VIII con ctenidios poco desarrollados, terguitos V y VI sin ctenidios. Tarsos anteriores con una uña apical, que sólo es visible lateralmente. Margen posterior del pronoto sin un par de pequeñas sedas entre las sedas posteromarginales…….. ……………………… Kakothrips 24.- Terguito abdominal VIII con un peine de microtricos situado a lo largo de todo el margen posterior de dicho terguito y presente en ambos sexos. Terguitos abdominales IIIVII con un pequeño peine de microtricos sobre los márgenes laterales posteriores de losmismos. Pronoto con dos pares de sedas posteromarginales. Furca del metatórax frecuentemente con una delgada espínula…….. Mycterothrips -Terguito VIII sin peine de microtricos o este está interrumpido medialmente; terguitos IIIVII sin microtricos en los márgenes laterales; pronoto con más de dos pares de sedas posteromarginales; furca metatorácica sin espínula……. 25 25.- Esternito abdominal VII con las sedas S1 situadas en el margen posterior. Sedas S1 y S2 de los terguitos abdominales VII y VIII muy desarrolladas, al menos tan largas como la mitad de la longitud de los respectivos terguitos. Machos ápteros. Esternitos III-VIII cada uno con un área porosa alargada y dos áreas pequeñas transversales….. Ceratothrips -Esternito abdominal VII con la seda S1 y S2 de los terguitos abdominales VII y VIII de la parte inferior, más pequeñas que la mitad de la longitud de sus respectivos tergos. Machos, en la mayoría de los casos macrópteros. Esternitos III-VII con una única área glandular porosa……. Tenothrips. FAMILIA MEROTHRIPIDAE, GÉNERO MEROTHRIPS Hembra de color castaño claro, artejo antenal II y extremidades claras. Fémures de las patas anteriores muy engrosados…….. Merothrips floridensis Watson, 1927 FAMILIA THRIPIDAE GÉNERO ANAPHOTHRIPS Terguito abdominal VIII con un peine de microtricos ciliados, no dentados, en el margen posterior; seda medial presente en el terguito VII menor que 0,4 veces la distancia entre sus bases; artejos antenales III y IV no bicoloreados, castaños uniformes; cuerpo de color amarillo; base de la cabeza con una banda transversal oscura; terguitos abdominales y tórax con marcas castaño claras……… Anaphothrips obscurus (Müller, 1776) GÉNERO RUBIOTHRIPS 1.- Artejo antenal VI sin una constricción anular basal……………..2 -Artejo antenal VI con una fuerte constricción basal con forma de anillo…………. ……………………………. Rubiothrips validus (Karny, 1910) 2.- Macho con áreas glandulares porosas sobre los esternitos III-VII. Artejo antenal III de la hembra amarillento………. Rubiothrips ferrugineus (Uzel, 1895) -Macho con áreas porosas glandulares sobre los esternitos III-VI………… 3 3.- Cuerpo amarillo claro. Artejo antenal I claro……….. Rubiothrips sordidus (Uzel, 1895) -Cuerpo castaño claro. Artejo antenal I oscuro…… Rubiothrips silvarum (Priesner, 1920) GÉNERO CERATOTHRIPS Par de sedas ocelar SIII de mayor tamaño que la distancia que separa los dos ocelos. Artejos antenales III-VI castaños oscuros. Terguitos VII y VIII con al menos cinco líneas de escultura transversal situadas entre las sedas mediales (S1). Terguito sin un peine de microtricos en le margen posterior. Pronoto trapezoidal sin escultura en su región medial. Macho áptero con un área porosa longitudinal y dos pequeñas transversales en los esternitos III-VIII. En ericáceas…………… Ceratothrips ericae (Haliday, 1836) GÉNERO TENOTHRIPS 1.- Especies macrópteras……………………. 2 -Especies micrópteras……………….. Tenothrips pilosus (Uzel, 1895) 2.- Terguito abdominal VIII con un peine de microtricos interrumpido medialmente. Artejos antenales I y II castaños oscuros; artejos III-V amarillos, VI amarillo en su región basal. Metanoto sin sensilas campaniformes…………….. Tenothrips frici (Uzel, 1895) -Terguito VIII sin peine de microtricos en el margen inferior. Artejos antenales I, III y IV castaños claros; artejos II, VI y VIII castaños oscuros. Metanoto con sensilas campaniformes…………………………..……. Tenothrips discolor (Karny, 1907) GÉNERO DREPANOTHRIPS Cuerpo claro con áreas de color castaño, artejos antenales VI-VIII fusionados, artejos antenales distales oscuros; alas sombreadas; sobre Vitis vinifera y Quercus…… ………………………. Drepanothrips reuteri Uzel, 1895 GÉNERO SCIRTOTHRIPS Cuerpo pálido con una línea oscura en el margen anterior de los terguitos. Esternitos sin microtricos entre las sedas marginales. Sedas ocelares SIII situadas entre los ocelos posteriores. Regiones laterales de los terguitos con cuatro sedas……………….…….Scirtothrips inermis Priesner, 1933 GÉNERO NEOHYDATOTHRIPS Antena con ocho artejos. Cuerpo cubierto con abundantes microtricos. Metanoto sin microtricos; región posteromedial de los terguitos I-III no cubierta completamente por microtricos. Macrópteros. Sobre Legyuminosas….. Neohydatothrips gracilicornis Williams, 1916. GÉNERO SERICOTHRIPS 1.- Metanoto con microtricos formando una banda transversa en el margen posterior, sedas mediales del metanoto separadas del margen anterior aproximadamente la mitad de su longitud. Esternitos abdominales cubiertos con microtricos; artejo antenal III aproximadamente tres veces mas largo que ancho……. Sericothrips bicornis (Karny, 1910) - Metanoto con microtricos dispuestos de forma irregular, con frecuencia presentes medialmente entre las sedas metanotales; sedas mediales del metanoto separadas del margen anterior menos 0,2 veces su longitud. Región medial de los esternitos abdominales no cubiertas por microtricos…………………. Sericothrips staphylinus Haliday, 1836 GÉNERO LIMOTHRIPS 1.- Artejo antenal II asimétrico, prolongado en un proceso lateral……………………... …………………………………..Limothrips angulicornis Jablonowski, 1894. -Artejo antenal simétrico…………………… 2 2.- Artejo antenal III fuertemente asimétrico, prolongado externamente; macho sin áreas porosas glandulares; sedas laterales del esternito IX delgadas, no espinosas, dispuestas sobre tubérculos no engrosados……………. Limothrips denticornis Haliday, 1836. -Artejo antenal III simétrico, no prolongado hacia el exterior; macho con pequeñas áreas porosas glandulares redondeadas en los esternitos III-VII; sedas laterales de los terguitos IX espinosas y situadas en tubérculos con el ápice oblicuo………………………………..... …………………………………… Limothrips cerealium Haliday, 1836 GÉNERO APTINOTHRIPS 1.- Terguito abdominal IX de la hembra con las sedas posteromediales muy reducidas, menores que 0,2 veces la longitud de la seda lateral; terguitos II-VIII en ambos sexos con numerosas sedas discales (10-20) además de las sedas submarginales posteriores; antena con seis artejos, en raras ocasiones con siete u ocho artejos……… 2 -Terguito abdominal IX de la hembra con las sedas posteromediales desarrolladas, más de la mitad del tamaño de las sedas laterales; terguitos II-VIII, en ambos sexos sin sedas discales; antena con 8 artejos, raramente con siete…………. 3 2.- Par lateral de sedas posteromarginales presentes en los esternitos abdominales III-VI en ambos sexos y situadas delante del margen; terguitos II-VIII con 0-4 sedas discales; base del artejo antenal II rechoncho, ensanchado…….. Aptinothrips elegans Priesner, 1924 -Par lateral de sedas posteromarginales presentes en los esternitos III-VI, en ambos sexos, y situadas en el margen; terguitos II-VIII de ambos sexos con 2-20 sedas sedas discales; parte basal del artejo antenal II no ensanchada ………….. Aptinothrips rufus (Haliday, 1836) 3.- Tarsos con dos segmentos; mitad posterior de los terguitos abdominales II-VIII con dos pares de sedas mediales además del par lateral; artejo antenal II similar a A. rufus, artejo antenal VII con la base estrechada …………Aptinothrips stylifer Trybom, 1894 -Tarsos con un segmento; mitad posterior de los terguitos II-VIII con tres pares de sedas mediales además del par lateral; artejo antenal II asimétrico, muy ensanchado en la región superior………… Aptinothrips karnyi John, 1927 GÉNERO CHIROTHRIPS 1.- Vértex con más de 20 sedas gruesas. Pronoto y mesonoto cubiertas con gruesas sedas. Artejo antenal II sin seda terminal en su extremo apical y artejo antenal IV con un cono sensorial bifurcado……. Chirothrips spinulosus Andre, 1941 -Vértex con dos o tres pares de sedas como máximo…………. 2 2.- En ambos sexos el craspedum tergal presenta lóbulos grandes con forma de dientes. Escultura torácica transversal, no muy marcada. Hembra macróptera con el artejo antenal II asimétrico, prolongado externamente, sin seda en el ápice; cono sensorial del artejo antenal IV bifurcado. Macho áptero con el artejo antenal II asimétrico; cono sensorial del artejo IV no bifurcado. Esternitos III-VII con áreas porosas esternales grandes y circulares….. ……………………….. Chirothrips aculeatus Bagnall, 1927 -Lóbulos que conforman el craspedum unidos. Escultura de los terguitos torácicos más o menos reticulada. Ambos sexos con el artejo antenal II asimétrico, prolongado externamente y con seda terminal. Conos sensoriales presentes en el artejo antenal IV no bifurcados. Artejo antenal II asimétrico con la seda medial normalmente cerca del centro del artejo. Vértex con dos a tres pares de sedas anterocelares; sedas discales del pronoto no robustas; hembra macróptera, macho micróptero con pequeñas áreas porosas……….. ……………………… Chirothrips manicatus Haliday, 1836 GÉNERO OXYTHRIPS 1.- Esternitos con sedas accesorias. Sedas ocelares SIII largas sobrepasando en longitud sus correspondientes ocelos…………. 2 Esternitos sin sedas accesorias; Sedas ocelares SIII cortas, no superando las bases de sus ocelos…………………… 4 2.- Segmento abdominal X de la hembra corto, aproximadamente de la misma longitud que el IX. Esternitos abdominales III-VI con sedas accesorias pero sin áreas porosas………….. ……………………………… Oxythrips ajugae Uzel, 1895 -Segmento abdominal X de la hembra dos veces mayor que el segmento IX. Esternitos III y IV de ambos sexos con áreas porosas………………. 3 3.- Tibias anteriores sin dientes……………………. Oxythrips bicolor Reuter, 1879. -Tibias anteriores con un pequeño diente situado en su extremo lateral………… ……………………………… Oxythrips nobilis Bagnall, 1927 4.- Coloración de la hembra castaño oscura………………. 5 -Coloración dla hembra amarilla. Artejos antenales I-III claros, aunque el artejo II es más oscuro que el I y el III. Ambos sexos son macrópteros …..……………………………… …………………………………… Oxythrips quercicola Bagnall, 1926 5.- Sedas mediales (S1) del esternito abdominal VII situadas pro detrás del margen posterior. Antena castaño oscura siendo el artejo antenal II ligeramente más oscuro que el I y que el III………………….. Oxythrips ulmifoliorum Haliday, 1836 -Sedas S1 del esternito abdominal VII situadas en el margen posterior. Artejo antenal II pardo oscuro, claramente más oscuro que el I y el III que son castaños muy claros……… ……………………………. Oxythrips tristis Bagnall, 1927 GÉNERO EREMIOTHRIPS 1.- Artejo antenal III con un cono sensorial sencillo. Cuerpo de color castaño claro…….. …………………………….. Eremiothrips dubius (Priesner, 1933) -Artejo antenal III con un cono sensorial bifurcado, con forma de tenedor. Cuerpo del animal vivo amarillo claro…………. Eremiothrips manolachei (Knechtel, 1955) GÉNERO TAENIOTHRIPS Tarsos anteriores sin uña terminal; esternito VII con la seda submedial situada delante del margen; par de sedas ocelar III más largas que la mitad de la distancia que hay entre los ojos compuestos en la cabeza; pronoto con tres pares de pequeñas sedas en el margen posterior entre las sedas posteroangulares; artejo antenal III amarillo, más pálido que el IV; macho con grandes áreas porosas glandulares en los esternitos III-VII………………. ………………………………………………. Taeniothrips picipes Zetterstedt, 1828 GÉNERO ODONTOTHRIPS 1.- Tibia anterior con dos uñas formando una estructura a modo de garfio……… 2 -Tibia anterior sin uñas desarrolladas. Genitalia del macho con 4-5 pares de espinas endotecales aproximadamente equidistantes que decrecen en tamaño progresivamente desde la región endotecal superior a la inferior. Sobre las flores de Papillonáceas…….. ………………………………. Odontothrips ignibilis Bagnall, 1919 2.- Machos con un par de sedas engrosadas en los extremos laterales del terguito abdominal IX. Genitalia con tres o cuatro pares de espinas endotecales sindo el par basal de parecido tamaño que el par apical……………….. Odontothrips cytisi Morison, 1928 -Machos sin sedas engrosadas en los márgenes laterales del terguito abdominal IX. Genitalia del macho con tres o cuatro pares de espinas endotecales, el par basal es más largo que los pares distales. Sobre flores de Ulex europaeus…………………….. ………………………………. Odontothrips ulicis Haliday, 1836 GÉNERO FRANKLINIELLA 1.- Cabeza con una prolongación muy acusada delante de los ojos. Mejillas de la cabeza rectas…………….. Frankliniella tenuicornis (Uzel, 1895) -Cabeza sin una prolongación acusada delante de los ojos. Mejillas frecuentemente estrechadas posteriormente ………………….. 2 2.- Metanoto con sensilas campaniformes. Sedas posteroculares principales muy largas, siendo dos o tres veces más largas que el par de sedas SIII…………….. 3 -Metanoto sin sensilas campaniformes. Sedas posteroculares principales no tan desarrolladas, más pequeñas que el par de sedas ocelares SIII ………………………. …………………………………………. Frankliniella intonsa (Trybom, 1895) 3.-Sedas posteroculares principales muy largas, al menos tan largas como las sedas ocelares SIII. Artejos antenales VI-VIII castaños oscuros, que no contrastan con el color del resto de la antena……………… Frankliniella occidentalis (Pergande, 1895) -Sedas posteroculares principales más pequeñas, a lo sumo la mitad de la rgas que las sedas ocelares SIII. Artejos antenales VI-VIII castaños oscuros que contrastan con el resto de la antena de color amarillo……………. Frankliniella pallida (Uzel, 1895) GÉNERO MYCTEROTHRIPS 1.- Sedas posteroculares pequeñas. Artejos antenales I-III amarillos, IV oscuro menos su región basal que es clara, el resto de la antena es castaño oscura. Espínula metatorácica conspicua………………. Mycterothrips albidicornis (Knechtel, 1923) -Sedas posteroculares muy desarrolladas. Artejo antenal III amarillo, el resto de los artejos antenales son castaños oscuros. Espínula metatorácica frecuentemente no desarrollada…. ………………….. Mycterothrips latus (Bagnall, 1912) GÉNERO DENDROTHRIPS 1.- Alas anteriores sin bandas oscuras transversales. Pronoto con una pequeña seda en cada ángulo posterior del pronoto. Artejo antenal VI sin un surco en forma de anillo en su tercio apical. Artejos antenales I, III y IV amarillos; artejos II, V-VIII castaños oscuros. Terguitos abdominales III-VII con escultura poligonal estriada internamente…………….… ………………………………………. Dendrothrips saltator Uzel, 1845 -Alas anteriores con bandas oscuras. Artejos antenales III-V amarillos que contrastan con los artejos II y VI. Terguitos abdominales III-VII con escultura poligonal no estriada internamente……………….. Dendrothrips ornatus (Jablonowsky, 1894) GÉNERO SCOLOTHRIPS Cuerpo de color castaño claro. Terguitos abdominales con manchas pardas. Alas anteriores con dos bandas transversales oscuras bien definidas. Anchura del ala anterior a nivel de la banda transversal proximal comprendida entre 60-70 micras. La mayoría de las sedas del cuerpo son claras…………. Scolothrips latipennis Priesner, 1950 GÉNERO BOLACOTHRIPS Color amarillo; antena con siete artejos, conos sensoriales sencillos; artejos antenales VIVII y segmentos abdominales IX y X sombreados; esternitos con sedas accesorias; hembra macróptera con un par de ctenidios en los terguitos abdominales….. Bolacothrips jordani Uzel, 1895. GÉNERO HELIOTHRIPS Cuerpo castaño oscuro cuando alcanzan la madurez; abdomen normalmente más pálido en ejemplares juveniles; huevos amarillos. Sobre Viburnum y en invernaderos…………….. ……………………………… Heliothrips haemorrhoidalis (Bouché, 1833) GÉNERO THRIPS 1.- Esternitos abdominales III-IV con sedas accesorias situadas medialmente, además de las seis sedas marginales ……………………….. 2 -Todos los esternitos abdominales sin sedas accesorias……………… 12 2.- Pleuroterguitos III-IV con sedas accesorias……………….3 -Pleuroterguitos III-IV únicamente con sedas posteromarginales…………….. 7 3.- Antena con 8 artejos………………. 4 -Antena con siete artejos …………… 6 4.- Sedas anteroangulares del pronoto muy desarrolladas, cuya longitud es más del doble que la de las sedas de disco…………………………. Thrips verbasci (Priesner,1920) -Sedas anteroangulares más pequeñas…………………… 5 5.- Vena principal del primer par de alas con al menos cinco sedas en su mitad distal Ala anterior sombreada oscura……………. Thrips atratus Haliday, 1836 -Vena principal del primer par de alas con tres sedas situadas en su mitad distal. Ala anterior clara. Artejo antenal III claro…………… Thrips vulgattisimus Haliday, 1836 6.- Primer par de alas con 7-11 sedas dispuestas sobre la mitad distal de la vena principal (vena superior). Terguito abdominal II con cuatro sedas latero-marginales. Esternitos con sedas accesorias colocadas en línea. Cuerpo de color castaño. Artejos antenales I-III más claros que los artejos IV-VII……. Thrips minuttisimus Linnaeus, 1758. -Ala anterior con tres sedas en la mitad distal de la vena principal. Terguito abdominal II con tres sedas lateromarginales. Sedas accesorias dispuestas en dos líneas, al menos en los esternitos posteriores. Color del cuerpo castaño claro, abdomen y metanoto algunas veces naranja. Artejo antenal III y la base del IV y del V amarillo, el resto de la antena castaño.. ………………. Thrips pillichi Priesner, 1924 7.- Sedas accesorias de los esternitos poco numerosas (4-7 sedas)………. 8 -Sedas accesorias de los esternitos más numerosas………………………..9 8.- Artejos antenales III y IV amarillos. Terguito abdominal II con cuatro sedas laterales… ……………………… Thrips vuilleti (Bagnall, 1933) -Artejos antenales III y IV castaños claros. Terguito abdominal II con tres sedas laterales.. ……………………………. Thrips mediterraneus Priesner, 1934 9.- Sedas accesorias dispuestas en más de una línea transversal en todos los esternitos.. 10 -Sedas accesorias colocadas en una línea excepto en los esternitos VI-VII…….. 11 10.- Ala anterior con 7-11 sedas en la mitad distal de la vena principal……………… …………………………. Thrips angusticeps Uzel, 1895 -Ala anterior con tres sedas en la mitad distal de la vena principal……………. ……………………… Thrips paucisetosus Priesner, 1927 11.- Macho castaño oscuro; hembra con X1 + 2 X2+ X3 con más de 450 micras (X1 es la longitud de la seda posteroangular del pronoto; X2 es la longitud de la seda S3 presente en el terguito abdominal IX y X3 es la longitud del terguito abdominal X). En flores de compuestas …………….. Thrips trehernei Priesner, 1927 - Macho amarillo, hembra con X1 + 2X2 + X3 más corto que 430 micras. En flores de compuestas………. Thrips physapus Linnaeus, 1758 12.- Pleuroterguitos III y IV con sedas accesorias……… Thrips brevicornis Priesner, 1909 -Pleuroterguitos III y IV sin sedas accesorias………………….. 13 13.- Terguito abdominal VIII con un peine de microtricos completo situado en el margen posterior…………….. 14 -Terguito abdominal VIII sin peine marginal posterior, o peine no desarrollado medialmente, sin microtricos en dicha zona……………….. 20 14.- Pleuroterguitos del abdomen con numerosos microtricos ciliados en las líneas de escultura. Terguito abdominal IX de la hembra con un par de poros, el par anterior no está desarrollado. Machos con áreas porosas en esternitos III-V…………………………... …………………………………………….. Thrips tabaci Lindeman, 1888 - Pleuroterguitos abdominales sin líneas de microtricos ciliados; terguito abdominal IX de la hembra con dos pares de poros; machos con áreas porosas en los esternitos abdominales II-VII …………………. 15 15.- Cabeza y tórax amarillo claro en ambos sexos……………………… 16 - Cabeza y tórax castaño oscuro en ambos sexos…………………………19 16.- Sedas interocelares colocadas posteriormente al primer ocelo, dentro del triángulo ocelar…………………….. Thrips flavus Schrank, 1776 - Sedas interocelares colocadas lateralmente al primer ocelo, anterolateralmente al triángulo ocelar…………………. 17 17.- Artejo antenal III con forma de botella, con una constricción apical muy acusada… ……………………… Thrips incognitus Priesner, 1914 - Artejo antenal III sin constricción…………………………….. 18 18.- Normalmente micrópteros. Terguitos abdominales IV-V con dos pares de sedas mediales más largas que la mitad de la longitud del terguito, terguitos abdominales IV-V con numerosas líneas de escultura mediales…….. Thrips nigropilosus Uzel, 1895 -Macrópteros; sedas mediales presentes en los terguitos abdominales IV-V más pequeñas, menores que 1/3 de la longitud del terguito. Terguitos abdominales IV-V sin líneas de escultura……………. Thrips urticae Fabricius, 1781 19.- Metanoto con escultura lineal longitudianl, estriado, con estrías muy próximas unas de otras…………………. Thrips validus Uzel, 1895 -Metanoto con escultura reticular…………….. Thrips dilatatus Uzel, 1895 20.- Líneas de escultura de los pleuroterguitos abdominales con micrtricos muy finos, a modo de cilios………………………. 21 -Líneas de escultura de los pleuroterguitos abdominales con microtricos con sus bases anchas a modo de dientes……………….. Thrips fuscipennis Haliday, 1836 21.- Esternito abdominal I sin microsedas. Escultura del metanoto con retículos poligonales irregulares alargados, muy desarrollados. Sedas posteroangulares del rponoto aproximadamente tan largas como la mitad del pronoto. Artejo antenal III amarillento….. ……………. Thrips major Uzel, 1895 -Esternito abdominal I con dos o tres microsedas (4-5 micras) situadas entre las coxas posteriores. Escultura metanotal con retículos poligonales de grandes dimensiones. Sedas posteroangulares del pronoto más pequeñas que la mitad de la longitud del pronoto. Artejo antenal III claro…………… Thrips juniperinus Linnaeus, 1758. GÉNERO STENOTHRIPS Cabeza ligeramente más larga que ancha; pronoto cubierto con numerosas líneas transversales de escultura; sobre gramíneas……… Stenothrips graminum Uzel, 1895 GÉNERO KAKOTHRIPS Cuerpo castaño oscuro. Antena oscura siendo el artejo antenal III más claro. Uña del arolio de 20-22 micras. En Genista scorpius……………….. Kakothrips firmoides Priesner, 1932 FAMILIA PHLAEOTHRIPIDAE 1.- Sedas situadas al final del tubo (sedas anales), a lo sumo, dos veces más largas que éste. Distancia entre las coxas posteriores, menor que entre las coxas medias............... 2 - Sedas anales, muy desarrolladas, mucho más largas que el tubo (segmento abdominal X). Distancia entre las coxas posteriores, mayor que la existente entre las coxas medias (Urothripinae)...................... 19 2.- Estiletes maxilares anchos, a modo de banda. Machos carentes de áreas porosas glandulares en los esternitos abdominales (Idolothripinae)................. 3 -Estiletes maxilares delgados. Machos con o sin áreas porosas glandulares en los esternitos abdominales (Phlaeothripinae).................................. 11 3.- Artejos antenales IV, V y VI biselados ventralmente, en su extremo distal. Terguitos abdominales con manchas blancas.................... Compsothrips -Artejos antenales IV, V y VI no biselados. Abdomen sin manchas blancas....... 4 4.- Tubo con sedas laterales muy desarrolladas. Pelta dividida en tres partes: una región central de gran tamaño y dos pequeñas áreas laterales. La mayor parte de los machos presentan tubérculos laterales muy desarrollados en el terguito abdominal VI (drepanae).... .......................................................................... 5 -Tubo sin sedas laterales desarrolladas. Pelta con forma diferente. Machos sin tubérculos en el terguito abdominal VI ....................................... 7 5.- Estiletes maxilares muy retraídos hacia la región anterior de la cabeza que discurren próximos en la zona media dela cabeza..................................... 6 - Estiletes maxilares muy retraídos hacia la región anterior dela cabeza, pero éstos no discurren próximos en la zona media dela cabeza................. Megathrips 6.- Pelta con dos lóbulos laterales alargados. Pronoto corto...... Megalothrips -Pelta con dos lóbulos laterales muy anchos e independientes dela región central. Pronoto más largo, aproximadamente 1,5 veces más ancho que largo...... Bacillothrips 7.- Antena con siete artejos............................................ 8 -Antena con ocho artejos ................................................9 8.- Artejos antenales VI y VII ampliamente unidos por sus regiones basales........ ........................................ Priesneriella -Artejos antenales VI y VII independientes. Artejo antenal VII con una fuerte constricción basal....................................... Allothrips 9.- Ojos con menos de 10 facetas. Ápteros, carentes de ocelos. Tarsos anteriores sin uñas en ambos sexos............................. Pseudocryptothrips -Ojos con abundantes facetas, más de 10. Macrópteros o micrópteros, con ocelos. Machos con uñas en los tarsos anteriores, hembras con los tarsos desarmados.............. 10 10.- Sedas posteroculares separadas del borde posterior de los ojos, al menos la mitad de la longitud de los mismos. Cabeza mucho más larga que ancha con los lados casi paralelos..... ............................................... Cryptothrips -Sedas posteroculares sepradas del borde posterior de los ojos, menos de un tercio de la longitud de los mismos. Cabeza un poco más larga que ancha y estrechada posteriormente.. .................................................... Bolothrips 11.- Alas anteriores en sus tercios centrales estrechadas y se ensanchan hacia el extremo distal o braquíptero o áptero............................. 12 -Alas anteriores con los bordes paralelos; si están ligeramente estrechadas en el centro, entonces tienen los lados paralelos hacia el extremo distal; si faltan o están acortadas, el protórax es más ancho que la cabeza...................... 14 12.- Artejo antenal IV siempre con cuatro conos sensoriales.......... Haplothrips -Artejo antenal IV con tres conos sensoriales como máximo......... 13 13.- Artejo antenal VII ampliamente unido al VI. Base de dicho artejo más del doble de ancha que la base del sexto artejo antenal................... Apterygothrips -Artejo antenal VII estrechado en su base, siendo esta de similar anchura a la del artejo VI.. ............................ Xylaplothrips 14.- Artejo antenal III con un cono sensorial...................... 15 -Artejo antenal III con dos o tres conos sensoriales.............16 15.- Artejo antenal IV con tres conos sensoriales. Cono bucal puntiagudo. Tarsos de la hembra sin uñas. Pestaña alar presente ....................................... Liothrips -Artejo antenal IV con dos conos sensoriales. Cono bucal redondeado. Tarsos de la hembra con o sin uñas. Sedas posteroculares separadas del borde posterior delos ojos, menos de un tercio de la longitud de los mismos. Formas macrópteras o ápteras....... Cephalothrips 16.- Artejo antenal III con dos conos sensoriales............ 17 - Artejo antenal III con tres conos sensoriales...................18 17.- Cabeza más larga que el protórax. Artejo antenal IV con tres conos sensoriales. Formas macrópteras o ápteras; las primeras carecen de pestaña alar. Par de escleritos centrales del prosterno (praepectus) presentes..................... Hindsiothrips - Cabeza más corta que el protórax o dela misma longitud. Artejo antenal IV con dos conos sensoriales. Formas macrópteras, micrópteras o ápteras; las primeras siempre tienen pestaña alar. Praepectus ausente......................... Hoplothrips 18.- Artejo antenal IV con dos conos sensoriales. Sedas posteroculares pequeñas, no alcanzando el extremo anterior de los hojos...................... Hoplothrips -Cuarto artejo antenal con cuatro conos sensoriales. Sedas posteroculares muy largas, alcanzando el extremo anterior de los ojos, con sus ápices expandidos.......... Tylothrips 19.- Vértex de la cabeza con una clara prolongación en forma de cuña o promontorio redondeado. Antena con cuatro o cinco artejos............ Amphibolothrips -Vértex de la cabeza sin prolongación prominente. Antena con cinco artejos...... .................................................................................... Bebelothrips GÉNERO BACILLOTHRIPS Fémures y tibias oscuros, del mismo color del cuerpo. Color del cuerpo castaño oscuro. Extremo final de los tarsos castaño claros, pedicelos de los artejos antenales III-V amarillos; alas anteriores claras. Los estiletes maxilares se aproximan al centro de la cabeza; Suturas epimerales del pronoto no desarrolladas. Seda dorsal situada en el terguito abdominal IX con el ápice final agudo.......... Bacillothrips nobilis (Bagnall, 1909) GÉNERO MEGATHRIPS Región basal y apical de los fémures amarillos. Cuerpo de color castaño oscuro aunque las tibias, tarsos y al menos los pedicelos de los artejos antenales III-V son amarillos. Machos sin tubérculos laterales situados en los segmentos abdominales VI y VIII........................ ......................................... Megathrips inermis Priesner, 1937 GÉNERO MEGALOTHRIPS Artejo antennal III de 10-12 veces más largo que ancho. Sedas situadas en los márgenes laterales del tubo cortas. Artejos antenales III y IV amarillos con sus regiones apicales castañas oscuras, artejo V con su mitad basal amarilla y su mitad apical castaña oscura, artejo VI amarillo en su región basal siendo el resto pardo oscuro, como los artejos restantes. Cuerpo oscuro, tercios finales de las tibias y tarsos claros. Sobre ramas muertas y corteza de Quercus................... Megalothrips bonannii Uzel, 1895 GÉNERO COMPSOTHRIPS 1.- Artejo antennal III y IV y mitad basal del V de color amarillo claro. Metanoto, segmento abdominal I y pleuroterguitos del V segmento del abdomen blancos............. ................................................ Compsothrips albosignatus (Reuter, 1884) -Artejo antennal III Amarillo claro que contrasta con el resto de la antenna que es oscura. Metatórax y segmento abdominal I blancos......... Compsothrips maroccanus Priesner, 1964 GÉNERO BOLOTHRIPS 1.- Ojos prolongados ventralmente superando en longitud a su región dorsal......... 2 -Ojos no prolongados ventralmente, región ventral de los ojos de la misma longitud que la dorsal, no más larga................................ 3 2.- Protórax del mismo color que el resto del cuerpo, animal oscuro. Cabeza prolongada delante de los ojos........................... Bolothrips dentipes (reuter, 1880) -Todo el tórax y los primeros terguitos abdominales tan claros como la cabeza, que contrastan con el resto del cuerpo que es oscuro. Cabeza no prolonagada delante de los ojos........................ Bolothrips cingulatus (Karny, 1916) 3.- Artejo antennal IV completamente oscuro. Artejo antenal III amarillo en su mitad basal, oscuro en su mitad apical. Sedas B2 situadas en el terguito abdominal IX más largas que el tubo........................ Bolothrips insularis (Bagnall, 1914) - Artejos antenales III y IV claros. Sedas B2 del terguito abdominal IX a lo sumo de la misma longitud que el tubo........................ Bolothrips icarus (Uzel, 1895) GÉNERO PSEUDOCRYPTOTHRIPS Cuerpo castaño claro. Cabeza y patas castañas claras con reflejos amarillentos. Artejos antenales de color castaño oscuro. Sedas posteroculares, pronotales y tergales con sus extremos apicales ensanchados. Sedas esternales con sus extremos agudos. Artejo antenal III con dos conos sensoriales, rtejo IV con cuatro........................... ........................... ..............................................................Pseudocryptothrips meridionalis Priesner, 1919 GÉNERO ALLOTHRIPS Color del cuerpo castaño claro. Cabeza, patas y segmento abdominal X castaño calroamarillentos. Artejos antenales I-II-III castaño claro amarillentos, el resto de los artejos de color castaño oscuro. Sedas posteroculares, pronotales y tergales con sus extremos apicales ampliamente ensanchados. Pelta grande, sin prolongaciones laterales............................ .......................................... Allothrips pillichellus (Priesner, 1925) GÉNERO PRIESNERIELLA Sedas ocelares desarrolladas. Artejo antenal III con un cono sensorial. Artejo antenal VI ligeramente más largo que la longitud de los artejos VII y VIII. Mesonoto y metanoto no fusionados completamente. Esternito IV con dos sedas discales................................ .............................................. Priesneriella clavicornis (Knechtel, 1936) GÉNERO CRYPTOTHRIPS Color del cuerpo muy oscuro, artejo antenal III amarillo intenso, el resto de la antena castaño oscura; estiletes maxilares muy anchos; alas pálidas,ligeramente sombreadas, con 15-18 cilios duplicados. Pelta sin prolongaciones laterales. Sedas posteroculares con sus extremos apicales ligeramente redondeados............ Cryptothrips nigripes (Reuter, 1880) GÉNERO APTERYGOTHRIPS 1.- Alas bien desarrolladas. Sedas anteromarginales del pronoto muy pequeñas. Terguitos abdominales II-VII con dos pares de sedas sigmoidales............................................ ............. ............................................. Apterygothrips priesneri Zur Strassen, 1966 -Micrópteros. Sedas anteromarginales del pronoto muy desarrolladas. Terguitos abdominales sin sedas sigmoidales........... Apterygothrips piceatus Zur Strassen, 1966 GÉNERO HOPLOTHRIPS 1.- Seda B1 situada en el terguito abdominal IX ligeramente más larga que el tubo (1,1 más larga que la longitud del segmento abdominal X). Artejos antenales III y IV normalmente con dos conos sensoriales.......... Hoplothrips longisetis (Bagnall, 1910) -Seda B1 situada en el terguito IX a lo sumo del mismo tamaño que el tubo. Artejos antenales III y IV normalmente con tres y cuatro conos sensoriales respectivamente........ ........................................ Hoplothrips pedicularius (Haliday, 1836) GÉNERO CEPHALOTHRIPS 1.- Ojos con una prolongación ventral acusada. Sedas posteroculares con extremos suavemenete redondeados. Cuerpo de color castaño oscuro, tarsos, región anterior de las tibias y bases de los artejos antenales III-VI castañas-amarillentas. Uñas situadas en los tarsos anteriores pequeñas. Pelta oval………. Cephalothrips monilicornis (Reuter, 1880) -Ojos no prolongados ventralmente. Sedas posteroculares con extremos expandidos. Cuerpo castaño claro, tarsos y región anteromedial de las tibias amarillas. Artejos antenales III-VI amarillos. Pelta triangular…….. Cephalothrips coxalis Bagnall, 1926 GÉNERO HINDSIOTHRIPS 1.- Artejo antenal VIII lanceolado, con una acusada constricción en su región basal. Artejos antenales I y II más claros que el artejo III. Cabeza y región basal del tubo claros……. ……………………….. Hindsiothrips navarrensis Goldarazena y Mound, 1998 -Artejo antenal VIII lanceolado, con un suave estrechamiento en su región basal. Artejos antenales I y II más oscuros que el artejo III. Cabeza y tubo castaños oscuros………. …………………………..Hindsiothrips bonessi (Titschack, 1955) GÉNERO XYLAPLOTHRIPS Color del cuerpo castaño claro. Patas anteriores castañas con las tibias amarillas, el resto de las patas tienen los tarsos y los extremos terminales de las tibias amarillos. Sedas posteroculares desarrolladas con sus extremos apicales romos. Sedas pronotales romas. Artejos antenales III y IV cada uno con dos conos sensoriales……………………………. ……………………………………………… Xylaplothrips fuliginosus (Schille, 1910) GÉNERO HAPLOTHRIPS 1.- Artejo antenal III con un cono sensorial……………………… 2 -Artejo antenal III con dos conos sensoriales……………………. 5 2.- Antena bicoloreada, artejos III-VI amarillos claros, artejos I-II, VII y VIII castaños… 3 -Antena de color castaño oscuro………… 4 3.- Tarsos de las extremidades anteriores de la hembra con dientes en sus extremos laterales muy conspicuos. Tibias de las patas mediales y posteriores bicoloreadas, siendo sus mitades basales castañas oscuras y las apicales amarillas. Hembras y machos normalmente ápteros……………………………. Haplothrips crassicornis (John, 1924) -Tarsos de las hembras desarmados, sin dientes en sus extremos laterales. Tercio final de las tibias mediales y posteriores amarillo que contrasta con el resto del apéndice de color castaño oscuro. Ambos sexos macrópteros………….. Haplothrips andresi Priesner, 1930 4.- Sedas anteromarginales del pronoto no desarroladas…………………………... . …………………………………. Haplothrips aculeatus (Fabricius, 1803) -Sedas anteromarginales del pronoto desarrolladas, al menos la mitad de largas que las sedas epimerales………………………… Haplothrips phyllophilus Priesner, 1938 5.- Sedas anteromarginales del pronoto bien desarrolladas, al menos la mitad de largas que las sedas epimerales………………………………. 6 - Sedas anteromarginales del pronoto más pequeñas…………….. 11 6.- Sedas posteroculares con sus extremos apicales redondeados o romos………. 7 -Sedas posteroculares con sus extremos apicales puntiagudos……………… 9 7.- Artejos antenales III-VI más claros que el resto de la antena. Artejo antenal III amarillo claro. Sedas posteroculares espatuladas………. Haplothrips acanthoscelis (Karny, 1909) -Antena castaño oscura………………….. 8 8.- Estiletes maxilares fuertemente estrechados, estando unidos en su región anterior por un puente maxilar muy pequeño. Artejo antenal III amarillo………………………..……. …………………………………….. Haplothrips frustrator (Zur Strassen, 1968). Estiletes maxilares no tan estrechados. Puente maxilar desarrollado. Artejo antenal III castaño con áreas amarillentas en su región basal y medial…………………………..…. …………………………. Haplothrips tritici Kurdjumov, 1912 9.- Cilios distales de las alas anteriores claramente barbulados………………….… ……………………… Haplothrips reuteri (Karny, 1907) -Cilios distales de las alas anteriores no barbulados………………… 10 10.- Sedas posteroangulares del pronoto a lo sumo de la misma longitud que las sedas epimerales. Artejo antenal III castaño amarillento, artejos IV, V y VI amarillos en la base y pardos en el ápice………………… Haplothrips distinguendus (Uzel, 1895) -Sedas psoteroangualres del pronoto claramente más largas que las sedas epimerales. Artejo antenal III castaño amarillento, artejos IV, V y VI de color pardo claro………. ……………………….. Haplothrips marrubicola (Bagnall, 1932) 11.-Ártejos antenales III, IV y VI amarillos…………………………….…………. ……………………. Haplothrips hispanicus Priesner, 1924 -Antena castaño oscura, no bicoloreada. Artejos antenales III castaño oscuros con su base amarillenta, artejos IV-VI oscuros……………………….. 12 12.- Ala anterior con los cilios distales barbulados. Sedas posteroculares muy desarrolladas……………. Haplothrips setiger Priesner, 1921. - Ala anterior con los cilios distales no barbulados. Sedas posteroculares cortas…….. 13 13.- Tibias de las patas anteriores amarillas. Mitad basal del artejo antenal III y ápices basales de los artejos IV y V amarillos. Patas anteriores de las hembras con un diente bien desarrollado……………… Haplothrips niger (Osborn, 1833) -Tibias de las patas anteriores castañas oscuras, a lo sumo con algunas áreas más claras en su región medial. Mitad inferior del artejo antenal III amarilla siendo el resto de la natena castaña oscura. Tarsos de la hembra con un pequeño diente………………………………. ………………………………… Haplothrips anthemidinus Priesner, 1950 GÉNERO TYLOTHRIPS Cuerpo castaño oscuro. Patas anteriores castañas claras, con áreas amarillas. Sedas posteroculares muy desarrolladas y fuertemente expandidas en sus extremos apicales. Artejo antenal III con tres conos sensoriales, IV con cuatro conos sensoriales. Pelta triangular sin prolongaciones laterales……….. Tylothrips osborni (Hinds, 1902) GÉNERO LIOTHRIPS 1.- Patas de color castaño oscuro, tarsos y tibias oscuros…. Liothrips reuteri Bagnall, 1913 -Tibias de las extremidades medias y posteriores con sus regiones apicales amarillas….. ……………………. Liothrips setinodis (O.M. Reuter, 1880) GÉNERO BEBELOTHRIPS Cuerpo de color castaño oscuro. Cabeza y protñorax con escultura. Sedas dispuestas en pequeños tubérculos a lo largo de toda la cabeza y de los terguitos abdominales. Esternitos con sedas accesorias. Ojos con menos de 10 facetas. En suelos con pinaza………….. …………………………… Bebelothrips latus Buffa, 1909 GÉNERO AMPHIBOLOTHRIPS Cuerpo claro con manchas de color rojizo de intensidad variable. Cabeza con numerosos tubérculos pequeños. Pterotórax y abdomen claros sin líneas o manchas oscuras. En hojarasca de Quercus………… Amphibolothrips marginatus Bournier, 1960 DISTRIBUCIÓN PROVISIONAL DE LAS ESPECIES Merothrips floridensis Navarra: Oieregui; Alava: Zalduondo. Dos hembras capturadas en hojarasca cercana a material arbóreo en descomposición. Aeolothrips albicinctus Navarra: Caparroso, Funes, Marcilla, Cortes. Álava: Laguardia, Oyón, El Ciego. Se han estudiado50 ejemplares. Especie depredadora asociada con gramíneas Aeolothrips collaris Navarra: Caparroso, Cadreita, Pitillas. Álava:La Guardia, Samaniego, Navaridas. Se han estudiado 70 ejemplares. Especie asociada a compuestas y fabáceas de hábitos depredadores. Aeolothrips cursor Navarra: Oteiza de la Solana, Alava: La Guardia; Vizcaya: Durango. Iparralde: Sara. Se han estudiado 10 ejemplares.Especie ligada a gramíneas cespitosas con hábitos probablemente depredadores. Aeolothrips ericae Navarra: Bardena Negra, Sansoain; Alava: La Guardia. Se han estudiado un total de 5 ejemplares. Especie asociada a Calluna y Melampyrum. Aeolothrips gloriosus Navarra: Tafalla, Álava: El Ciego, Laguardia; Vizcaya: Urdaibai. Se han estudiado 10 ejemplares. Especie mediterránea asociada a la encina Quercus rotundifolia. Aeolothrips intermedius Navarra: Ucar, Oteiza, Arraioz, Iturmendi, Cadreita, Miranda de Arga, Tajonar, Ribaforada, Sartaguda, Mendavia, Bardenas, San martin de Unx, Sansoian, Eslava, Larraga, Ujué, Artajona, Caparroso, Tudela, Fustiñana, Rada, Villafranca, Ventas de Yantzi,. Guipuzcoa: Hondarribia; Vizcaya: Inama, Durango, Bilbao, Baracaldo, Urdaibai; Iparralde: San Juan de Luz, Sara, Hendaia, Espelette, Sokoa, Urruñe. Se han estudiado 222 ejemplares. Esta especie está asociada a muchas especies vegetales en donde depreda otros microartrópodos (ácaros, trips etc). Aeolothrips melaleucus Navarra: Tafalla, Bardenas Reales; Álava: La Guardia, Oyón, El Ciego. Se han estudiado 81 ejemplares. Especie asociada a flores de carrasca, aunque también ha sido citada en Populus, Corylus, Carpinus y Betula. Aeolothrips propinquus Navarra: Tafalla y Caparroso; Álava: Oyón.. Se han estudiado 12 ejemplares. Especie asociada con Sinapis arvensis, aunque también has sido citada en Verbascum, Onobrychis y Echium. Probablemente depredadora. Aeolothrips tauricus Navarra: Tafalla. Se ha estudiado un unico ejemplar. Especie colectada en Eryngium campestre. Especie originalmente citada en la península de Crimea. Aeolothrips tenuicornis Navarra: Castejón, Olite, Corella, Peralta, Bardenas Reales; Álava: La Guardia, Oyón, Samaniego, El Ciego, Meano; Vizcaya: Urdaibai. Se han estudiado 180 ejemplares. Especie asociada a Tamarix africana y Santolina chamaecyparissus. También ha sico citada en Verbascum y en otras especies de crucíferas fabáceas y compuestas. Rhipidothrips brunneus Navarra: Arlegui, Miranda de Arga, Tafalla, Álava: La Guardia, El Ciego; Iparralde; Sara. San Juan de Luz, Hendaya; Vizcaya: Durango; Guipuzcoa: Hernani, Hondarribia. Se han estudiado un total de 41 ejemplares. Especie asociada a la región basal de gramíneas cespitosas. Se han citado como plantas hospedadoras a Triticum repens y Bromus sterilis. Probablemente Hordeum murinum sea también su hospedadora. Melanthrips fuscus Navarra: Oteiza, Iturmendi, Tajonar, Olite, Tafalla, Artajona; Álava: la Guardia, Oyón, El Ciego, Samaniego, Villabuena de Álava; Vizcaya: Urdaibai; Durango; Artea; Muxika; Iparralde: Sara; San Juan de Luz; Hendaya; Espelette; Sokoa; Guipuzcoa: Hondarribia; Pasajes; Irún; Hernani; Mondragón. Se han estudiado un total de 291 ejemplares. Especie asociada a varias crucíferas (Sinapis arvensis, Diplotaxis erucoides, Brassica sp., Sinapis spp.). Ocasionalmente se la puede encontrar en plantas cercanas a las crucíferas, como Bellis perennis. Melanthrips pallidior Navarra: Pueyo. Se han capturado dos ejemplares en Genista scorpius. Algunos autores la asocian con crucíferas. Orothrips priesneri Navarra: Olleta. Se han estudiado dos ejemplares. Especie asociada a Sambucus nigra, Viburnum sp. y Fraxinus ornus. Heliothrips haemorrhoidalis Navarra: Aibar; Guipuzcoa: Hondarribia. Se han estudiado 142 ejemplares. Especie asociada a invernaderos en donde es plaga importante de las azaleas. También ha sido citada en plantas del género Viburnum. Dendrothrips ornatus Navarra: Larrasoiana; Álava: Arkaute; Guipuzcoa: Hondarribia, Donostia; Vizcaya: Laioa; Iparralde: Sara, Sokoa. Se han estudiado un total de 198 ejemplares. Especie asocada a Ligustrum y Syringa y árboles de los géneros Tilia y Alnus. Dendrothrips saltator Navarra: Quinto Real; Álava: Arkaute. Se han capturado 12 ejemplares. Especie asociada a Fraxinus, Alnus y Corylus. Sericothrips bicornis Navarra: Puerto de Velate, Bigüezal; Álava: Araia; Guipúzcoa: Hondarribia. Se han estudiado 60 ejemplares. Especie asociada a fabáceas de los géneros Trifolium, Melilotus y Lotus. Sericothrips staphylinus Navarra: Quinto Real, Mintxate. Se han estudiado 5 ejemplares. Especie asociada a Ulex gallii, aunque también ha sido citada en Ulex europaeus. Neohydatothrips gracilicornis Navarra: Cadreita, Anchoriz, Larrasoaina; Guipuzcoa: Régil. Se han estudiado un total de 7 ejemplares. Especie asociada a fabáceas como Vicia cracca. Drepanothrips reuteri Navarra: San Martín de Unx, Bardena Negra, Tafalla, eslava, Artajona, Olite, Ujué; Álava: Laguardia, Oyón, Samaniego; Guipúzcoa: Hondarribia; Iparralde: Sara. Se han estudiado 413 ejemplares. Especie asociada a Quercus spp. y a Vitis vinifera en donde puede causar problemas si las poblaciones son numerosas. Scirtothrips inermis Navarra: Pamplona; Guipúzcoa: Irún. Se han capturado un total de 34 ejemplares. Especie polífaga que causa daños en Citrus, Begonia, Prunus y Ricinus. Frecuente plaga en plantas ornamentales. Chirothrips aculeatus Navarra: Los Arcos, Carcastillo, Fustiñana, Valtierra, Buñuel, Valtierra, Viana, Artajona, Corella, Tajonar, Caparroso, Ucar, Cabanillas, Cortes, Funes. Arlegui, Mintxate, Villafranca, Pitillas, Legasa, Tafalla, Akerreta, Larrasoiana; Guipúzcoa: Hondarribia, Irún, Régil, Mondragón,Pasaia, Hernani, Donostia, Zarautz; Álava: Araia, Zalduondo, San Román, La Guardia, Oyón, Salvatierra, Samaniego; Vizcaya: Durango, Inama, Muxika, Leioa, Bilbao, Urdaibai, Inama; Iparralde: Sara, Sokoa, San Juan de Luz, Espelette, Hendaya, Ciburu. Se han estudiado 1234 ejemplares. Especie asociada a gramíneas y ciperáceas. Chirothrips manicatus Navarra: Castejón, Miranda de Arga, Berrizaun, Los Arcos, Carcastillo, Fustiñana, Valtierra, Buñuel, Valtierra, Viana, Artajona, Corella, Tajonar, Caparroso, Ucar, Cabanillas, Cortes, Funes. Arlegui, Mintxate, Villafranca, Pitillas, Legasa, Tafalla, Akerreta, Larrasoiana; Guipúzcoa: Orio, Hondarribia, Irún, Régil, Mondragón,Pasaia, Hernani, Donostia, Zarautz; Álava: Murgía, Galarreta, Araia, Zalduondo, San Román, La Guardia, Oyón, Salvatierra, Samaniego; Vizcaya: Areeta, Artea, Durango, Inama, Muxika, Leioa, Bilbao, Urdaibai, Inama; Iparralde: Baiona, Sokoa, San Juan de Luz, Espelette, Hendaya, Ciburu. Se han estudiado 620 ejemplares. Especie asociada a gramíneas y ciperáceas. Chirothrips spinulosus Navarra: Ucar, Artajona, Cortes y Caparroso. Se han estudiado 33 ejemplares. Especie asociada a Phragmites australis. Limothrips angulicornis Navarra: Oteiza, Cortes, Ribaforada, Viana y Caparroso. Álava: La Guardia. Se han estudiado 32 ejemplares. Especie asociada a gramíneas y cereales. Limothrips cerealium Navarra: Oteiza, Ucar, Los Arcos, carcastillo, Corella, Viana, Miranda de Arga, Buñuel, Fustiñana,Valtierra, Arraioz, Iturmendi, Caparroso, Cadreita, Ribaforada, Marcilla, Cabanillas, Tajonar, Larraga, Velate, Vedado de Eguaras, Bardenas, Unzue, Sansoian, Bigüezal, El Perdón, Pitillas, Pamplona, Tafalla, Sierra de Codés, Larrasoaina, Errea; Álava: Araia, Zalduondo, San Román, La Guardia, Oyón, Salvatierra, Samaniego; Vizcaya: Durango, Inama, Muxika, Leioa, Bilbao, Urdaibai, Inama; Iparralde: Sara, Sokoa, San Juan de Luz, Espelette, Hendaya, Ciburu. Se han estudiado 60.318 ejemplares. Especie asociada a gramíneas y cereales. Limothrips denticornis Navarra: Ucar, Carcastillo, Oteiza, Corella, Arroniz, Fustiñana, Viana, Valtierra, caparroso, Iturmendi, Ribaforada, Cortes, Castejón, Larraga, Cadreita, Buñuel, Funes, Marcilla, Vedado de Egüaras, Ujué, Arlegui, Cabanillas, Sansoain, Barasoian, Irati, El Perdón, Sartaguda, Pitillas, tafalla, Carrascal, Sierra de Codés. Álava: Santa Cruz de Campezo, Antoñana, Sierra de Izki, Maestu, Zalduondo, Araia, La Guardia, Oyón; Guipúzcoa: Hondarribia, Zarautz, Régil; Vizcaya: Durango, Muxika, Inama, Gernika, Leioa; Iparralde: San Juan de Luz, Baiona, Hendaya, Sokoa; Sara. Se han estudiado10023 ejemplares. Especie asociada a gramíneas y cereales. Anaphothrips obscurus Navarra: Fustiñana, Miranda de Arga, Iturmendi, Tajonar, Marcilla, Rada, Villafranca, Artajona, Caparroso, Cortes, Funes, Mintxate, Echauri, Bardenas, Milagro, Fontellas, Santesteban. Guipúzcoa: Hondarribia; Irún; Zarautz. Vizcaya: Artea, Muxika. Iparralde: Sara. Se han estudiado 68 ejemplares. Especie asociada a distintas especies de gramíneas y cereales. Rubiothrips ferrugineus Navarra: Tajonar. Álava: La Guardia. Se han estudiado tres ejemplares. Especie asociada a Galium sp. Rubiothrips silvarum Navarra: Funes, Caparroso, Arlegui y Sansoain. Guipuzcoa: Régil; Álava: Maestu; Samaniego; Vizcaya: Muxika. Se han estudiado 22 ejemplares. Especie asociada a Galium verum. Rubiothrips sordidus Navarra: Tafalla. Álava: Meano Se han estudiado 12 ejemplares. Especie asociada a Galium mollugo y Galium lutescens. Rubiothrips validus Navarra: Olleta; Álava: La Guardia. Se han estudiado 4 ejemplares. Asociada con Galium verum y Asperula odorata. Aptinothrips rufus Navarra: Oteiza, Ucar, Carcastillo, Los Arcos, Corella, Viana, Miranda de Arga, Fustiñana, Buñuel, Valtierra, Iturmendi, Galar, Arraioz, Ribaforada, Funes, Castejón, Larraga, Cadreita, Artajona, Mendavia, Cabanillas, Arlegui, Villafranca, Velate, Mintxate, Vedado de Eguaras, Echauri, Preseta, Erreguerena, Urbasa, Preseta, Bigüezal, El Perdón, Puerto de Lizarraga, Ventas de Yanci, Pitillas, Sansoain, Tafalla, Sierra de Codés. Álava: Maestu, Antoñana, Sierra de Izki, Urturi, Zalduondo, Araia, Galarreta, Oyón, La Guardia, Meano, Arkaute, Samaniego, Amurrio; Vizcaya: Artea, Bilbao, Loiu, Leioa, Durango, Muxika. Iparralde: Hendaya, Baiona, Sara, Espelette, San Juan de Luz, Sokoa. Se han estudiado 2541 ejemplares. Especie asociada a distintas gramíneas. Aptinothrips elegans Navarra: Ucar, Los Arcos, Miranda, Galar, Fustiñana, Buñuel, Valtierra, Caparroso, Cortes, Cabanillas, Artajona, Marcilla, Funes, Arlegui, Cadreita, Corella, Sierra de Codés. Álava: la Guardia. Se han estudiado 1833 ejemplares. Especie asociada a gramíneas. Aptinothrips karnyi Navarra: Echauri. Se ha estudiado un ejemplar. Especie asociada probablemente a gramíneas. Aptinothrips stylifer Navarra: Puerto de Velate; Mintxate. Álava: Calzada de San Adrián. Se han estudiado 8 ejemplares. Especie asociada a gramíneas de montaña. Tamaricothrips tamaricis Navarra: Bardena Negra. Se han estudiado 8 ejemplares. Asociada con Tamarix sp. Oxythrips ajugae Navarra: Mintxate, Bardenas, Bigüezal, Sansoain, Barasoian, Caparroso, Bardena Negra. Vizcaya: Urkiola, Muxika, Inama, Durango; Guipuzcoa: Errezil. Álava: Amurrio. Se han estudiado 78 ejemplares. Especie asociada a Pinus spp. Oxythrips bicolor Navarra: Vedado de Eguaras, Bigüezal, Bardenas, Caparroso, Errea. Vizcaya: Artea; Durango. Álava: Amurrio.Especie asociada a Pinus y Picea. Se han estudiado 45 ejemplares. Oxythrips nobilis Navarra: Erreguerena, Bardenas. Álava: Amurrio. Hemos estudiado 6 ejemplares. Especie asociada a Pinus y Picea. Oxythrips quercicola Navarra: Tafalla. Álava: Zalduondo. Se han estudiado 19 ejemplares. Especie asociada a Quercus faginea y a Quercus robur Oxythrips tristis Navarra: Tafalla, Pitillas. Se han estudiado 9 ejemplares. Especie asociada a Eryngium, aunque nosotros la hemos encontrado en la gramínea Lygeum spartium. Oxythrips ulmifoliorum Navarra: Tajonar, Tafalla, Bardena Negra. Álava: Zalduondo, La Guardia. Vizcaya: Laida. Guipúzcoa: Hondarribia. Iparralde: Sara. Hemos estudiado 420 ejemplares. Especie asociada a Quercus rotundifolia y a Quercus coccifera. Frankliniella intonsa Navarra: Arraioz, Iturmendi, Ribaforada, Castejón, Viana, Fustiñana, Cabanillas, Caparroso, Bera, Funes, Tafalla, Oronoz-Mugaire, Oieregui, Ventas de Yanci, Lesaka, Sunbilla, Cadreita, Larrasoiana, Akerreta. Guipúzcoa: Hondarribia, Irún, Orio, Zarautz, Régil. Vizcaya: Durango, Muxika, Artea, Laida, Elantxobe; Álava: Zalduondo, Galarreta, Samaniego; Iparralde: Sara, Baiona, San Juan de Luz, Sokoa, Urruña. Se han estudiado 421 ejemplares. Especie asociada a distintas dicotiledóneas (Sonchus, Carduus, Lythrum, Ajuga, Trifolium, Ononis, Ranunculus, Gentiana, Allium, Narthecium). Frankliniella occidentalis Navarra: Aibar, Huarte, pamplona, Milagro, Caparroso, Tudela, Corella, Pamplona, Pueyo, cadreita, Cárcar, Larraga, Lodosa, Valtierra, Sartaguda, Marcilla, Peralta, Andosilla, Berbinzana, Buñuel, Cortes, falces, Murchante, San Adrián, Sanguesa, Viana. Guipuzcoa: Hondarribia. Iparralde: Hendaya. Álava: Arkaute, La Guardia, Oyón, Salvatierra. Vizcaya: Muxika, Corredor del Txorierri; Derio; Durango. Se han estudiado 591 ejemplares. Especie plaga polífaga muy abundante en invernaderos. En la región mediterránea se la encuentra durante primavera-verano en numerosas especies de plantas en el medio natural. Frankliniella pallida Navarra: Larrasoaina, Akerreta. Se han estudiado 3 ejemplares. Especie asociada a fabáceas (Medicago falcata y Trifolium) y a la cariofilácea Viscaria viscosa. También se citan como hospeadoras Sedum y Helianthemun. Frankliniella tenuicornis Navarra: Fustiñana, Miranda de Arga, Corella, Cadreita, Caparroso, Viana, Sartaguda, Los Arcos, Funes, Artajona, Marcilla, Villafranca, Tudela, Ribaforada, Rada. Álava: La Guardia, Samaniego, Oyón, Sierra de Izki, Antoñana, Santa Cruz de Campezo, El Burgo, Salvatierra, Galarreta. Vizcaya: Durango, Leioa; Muxika; Iparralde: Baiona, San Juan de Luz. Se han estudiado 247 ejemplares. Especie asociada a gramíneas. Kakothrips firmoides Navarra: Tafalla. Álava: Santa Cruz de Campezo. Se han estudiado 76 ejemplares. Especie asociada a Genista scorpius. Taeniothrips picipes Navarra: Vera de Bidasoa, Sunbilla, Narvarte. Guipúzcoa: Hondarribia, Zarautz, Orio. Álava: San Román, Mezquía, Zalduondo. Iparralde: Sara, Urruña. Vizcaya: Muxika. Se han estudiado 13 ejemplares. Especie asociada a la dipsacacea Knautia arvensis y a Lychnis flos coculi. Ceratothrips ericae Navarra: Vera de Bidasoa, Lesaka, Mintxate, Quinto Real. Guipúzcoa: Hondarribia, Irún, peñas de Aia. Se han estudiado 45 ejemplares. Especie asociada a Erica pp. y Calluna vulgaris. Tenothrips frici Navarra: Oteiza, Carcastillo, Corella, Viana, Arraioz, cadreita, Tajonar, Marcilla, Artajona, Arlegui, Velate, Oieregui,Vera. Lesaka, Tafalla, Tirapu, Erice, Olite, Oronoz, Mugaire, Sansoain, Pitillas, Larrasoaina, Quinto Real. Guipúzcoa: Hondarribia, Orio, Irún, Peñas de Aia. Álava: Galarreta, calzada de San Adrián, San Román. Vizcaya: Durango, Laida , Inama, Areeta, Mallabia. Iparralde: Baiona, Ustaritz, San Juan de Luz, Hendaya. Se han estudiado 311 ejemplares. Especie asociada con Taraxacum officinalis, Sonchus sp., Senecio sp., Saponaria offcinalis y Cucurbita maxima. Tenothrips discolor Navarra: Cadreita, Tudela, Bardena Negra, Tafalla. Se han estudiado 178 ejemplares. Especie asociada a la dipsacácea Knautia arvensis. Tenothrips pilosus Navarra: Mintxate. Se ha estudiado un único ejemplar. Especie probablemente asociada a gramíneas cespitosas. Mycterothrips albidicornis Navarra: Sartaguda. Álava: La Guardia. Se han estudiado 8 ejemplares. Especie asociada a Acer, Pinus, Fagus, Quercus y Pirus Mycterothrips latus Navarra: Pitillas. Álava: Vitoria. Se han estudiado 6 ejemplares. Especie asociada a Betula. Eremiothrips dubius Navarra: Funes. Se desconocen las plantas hospedadoras. Se ha estudiado un ejemplar. Eremiothrips manolachei Navarra: Bardena Negra, Pitillas. Álava: La Guardia. Se han estudiado 30 ejemplares. Especie asociada a la quenopodiácea Salsola vermiculata. Stenothrips graminum Navarra: Ucar, Arroniz, Los Arcos, Tajonar, Viana, Larraga, Artajona, Tafalla, Sartaguda, Miranda de Arga, Caparroso, Villafranca, Rada. Álava: Arkaute, Zalduondo, El Burgo, Matauko, Galarreta, Argomaniz. Se han estudiado 298 ejemplares. Especie asociada a gramíneas y cereales. Odontothrips cytisi Navarra: Larrasoiana. Álava: Arkaute, Amurrio; Guipúzcoa: Hondarribia. Se han estudiado 43 ejemplares. Especie asociada a Cytisus scoparius. Se han encontrado ejemplares en Medicago sativa. Odontothrips ignobilis Navarra: Cadreita, Tafalla. Álava: Oyón, Samaniego. Guipúzcoa: Irún, Peñas de Aia. Vizcaya: Durango, Urkiola. Se han estudiado un total de 212 ejemplares. Especie asociada a Ulex spp. y Genista spp. Odontothrips ulicis Navarra: Velate, Almandoz, Betelu, Santesteban, Sunbilla; Guipúzcoa: peñas de Aia, Hondarribia, Irún, Orio, Hernani, Régil, Donostia.Vizcaya: Areeta, Muxika, Gernika, Loiu. Se han estudiado un total de 884 ejemplares. Especie asociada a Ulex europaeus. Scolothrips latipennis Navarra: Artajona, Pitillas, Beire, Rada, Caparroso, Urroz, Azqueta, Marcilla, Cadreita, Castejón, Arguedas, Tudela, Ichaso, Navascués, Domeño, Excaroz, Burgui, Allo, Muniain, Carcastillo, Armañanzas, Arteta, Andosilla, Lazagurría, San Martín de Unx. Álava: Arkaute, El Burgo, Argómaniz, San Román. Vizcaya: Derio, Corredor del Txorierri. Iparralde: Hendaya. Se han estudiado un total de 94 ejemplares. Especie asociada a la araña roja Tetranychus spp. de la cual se alimenta. Bolacothrips jordani Navarra: Arraioz. Se ha estudiado un único ejemplar. Especie asociada a gramíneas. Thrips angusticeps Navarra: Ucar, Carcastillo, Corella, Arroniz, Galar, Fustiñana, Buñuel, Miranda de Arga, Arraioz, Iturmendi, Ribaforada, Castejón, Cadreita, Caparroso, Olite, Los Arcos, Tajonar, Larraga, Artajona, Peralta, Larraga, Mendavia, Mugaire, Arlegui, Funes, Erice, Beunza, Ibero, Tafalla, Bardena Negra, Sartaguda, Viana, Aibar, Carcar, Huarte, Ardanaz, Milagro. Álava: Zalduondo, Galarreta, La Guardia, La bastida, Villanueva, Oyón, Santa Cruz de Campezo; Vizcaya: Iurreta, Durango, Mallabia, Laida, Laga, Muxika. Iparralde: Urruña, Sara, Hendaya. Se han estudiado 1522 ejemplares. Especie asociada a crucíferas y lináceas. También se la ha encontrado en Holcus lanatus, Sinapis arvensis, Diplotaxis erucoides, Taraxacum officinalis y Quercus rotundifolia. Thrips atratus Navarra: Arraioz, Vera de Bidasoa, Larrasoaina. Guipúzcoa: Hondarribia, Zarautz. Orio. Álava: Galarreta, Hermua, Guevara. Vizcaya; Muxika. Iparralde: Ustaritz. Se han estudiado un total de 18 ejemplares. Especie asociada a cariofiláceas y labiadas (Lychnis y Silene). Thrips brevicornis Navarra: Santesteban. Se ha estudiado un ejemplar sobre Lythrum salicaria. Algunos autores citan como hospedador a la labiada Lonicera. Thrips dilatatus Navarra: Mintxate. Se ha estudiado un único ejemplar. Esta especie está probablemente asociada a Euphrasia (escrofulariácea). Thrips flavus Navarra: Iturmendi, Castejón, Mugaire, Velate, Mintxate, Oieregui, Lesaka, Santesteban, Vera, Ventas de Yanci, Narvarte, Elizondo, Tafalla, Erice, Etxalar, Almandoz, Venta de San Blás, Eugui, Quinto Real, Larrasoaina. Guipúzcoa: Hondarribia; Irún, Orio, Peñas de Aia. Álava. Mezquía, Galarreta, Antoñana, Santa Cruz de Campezo, Zalduondo, San Román, El Burgo. Vizcaya: Muxica, Iurreta. Iparralde: Hendaya, bayona, san Juan de Luz, Urruña, Sokoa. Se han estudiado un total de 843 ejemplares. Especie polífaga, asociada con compuestas (Taraxacum spp., Leucanthemun spp.), leguminosas ( Cicer spp., Ulex spp., Trifolium spp.), rosáceas ( Rubus spp., Sorbus spp., Malus spp.), hipericáceas (Hypericum perforatum), dipsacáceas ( Knautia arvensis), convolvuláceas (Convolvulus arvensis), budleáceas (Buddleja davidii), ciperáceas (Carex sp.) Thrips fuscipennis Navarra: Caparroso, Tafalla, Lesaka, Sunbilla, Elizaondo, Vera, Sartaguda, larrasoaina, Akerreta, Eugui, Irure, Navascués, Errea. Guipúzcoa: Hondarribia, Peñas de Aia, Zarautz. Álava: Zalduondo, Araia, Galarreta, San Román, Hermua. Vizcaya: Muxika, Iurreta, Durango. Iparralde: Hendaya, Sara, Sokoa. Se han estudiado un total de 256 ejemplares. Especie asociada a Chenopodium album, Rumex crispus, Leucanthemum vulgare, Teucrium scordium, Prunella hyssopifolia y Prunella vulgaris. Thrips incognitus Navarra: Bardenas. Se ha estudiado un ejemplar . Esta especie está probablemente asociada a Galium cruciata, aunque otros autores citan a Melampyrum arvense como hospedadora. Thrips juniperinus Navarra: Olleta. Álava: Calzada de San Adrián. Se han estudiado dos ejemplares. Esta especie está asociada a Juniperus oxycantha. Thrips major Navarra. Santesteban, Elizondo, Lesaka, Tafalla, Mugaire, Vera, Sansoain, Quinto Real, Aquerreta, Eugui, Anchoriz, Errea, Larrasoaina. Guipúzcoa: Hondarribia, Irún, Peñas de Aia. Álava: Galarreta, Calzada de San Adrián. Vizcaya: Leioa, Muxica, Durango. Se han estudiado 234 ejemplares. Especie asociada a Leucanthemun vulgare, Eupatorium cannabinum, Senecio sp., Convolvulus arvensis, Silene dioica, Menta suaveolens, Rubus fruticosus. Thrips mediterraneus Navarra: Tafalla. Álava: Labastida. Se han estudiado 96 ejemplares. Especie asociada a Rosmarinus officinalis. Thrips minutissimus Navarra: Arraioz, Iturmendi, Tafalla, Vera, Sartaguda, Sansoain, Bardena Negra. Álava: Zalduondo, Argomaniz, San Roman, Galarreta, Hermua. Vizcaya: Muxika, Iurreta, Durango, Loiu. Iparralde: Ustariz, Hendaya, Sara. Se han estudiado 223 ejemplares. Especie asociada a Quercus robur y Q. rotundifolia. Thrips nigropilosus Navarra: Artajona, Velate, Puerto de Lizarraga, Sunbilla, Villafranca, Sartaguda. Álava: Zalduondo. Vizcaya: Artea. Se han estudiado 25 ejemplares. Especie asociada a diversas compuestas (Achillea, Pyrethrum) y gramíneas. También se cita como hispedadora Plantago lanceolata y Plantago maritima. Thrips paucisetosus Navarra: Tafalla, en flores de Reseda. Se ha estudiado un ejemplar. Probablemente esta especie es un sinónimo de Thrips angusticeps. Thrips physapus Navarra: Irure, Quinto Real. Álava: Galarreta, Hermua, Ozaeta, Ordoñana, Larrea, Barria, Salvatierra. Vizcaya: Muxika, Iurreta, Loiu, Gernika. Iparralde: Hendaya, Baiona, San Juan de Luz. Guipúzcoa: Orio, Hondarribia, Irún. Se han estudiado un total 18 ejemplares. Esta especie está asociada con compuestas (Taraxacum spp.) Thrips pillichi Navarra: Tafalla, Oieregui, Eugui, Cizur Mayor. Álava: Barria, Ozaeta. Vizcaya: Muxika, Durango, Urkiola. Iparralde: Ustaritz. Se han estudiado un total de 45 ejemplares. Especie asociada a varias compuestas (Tanacetum, Anthemis, Achillea, Senecio). También ha sido citada en Bellis perennis y Matricaria camomilla. Thrips tabaci Navarra: Carcastillo, Corella, Arroniz, Viana, Arraioz, Iturmendi, Ribaforada, Castejón, Cadreita, Caparroso, Embalse del Ferial, Ucar, Rada, Larraga, Mendavia, Cabanillas, Sartaguda, Peralta, Villafranca, Olite, Velate, Mintxate, Lesaca, Elizondo, Maya de Baztán, Oieregui, Ventas de Yanci, Tirapu, Sunbilla, Legasa, Oronoz, Artajona, Sansoain, Arlegui, Navascués, Larrasoaina, Quinto Real, Akerreta, Cizur Mayor, Anchoriz, Bardena Negra, Eugui, San Martín de Unx, Eslava, Ujué, Allo, Andosilla, Arguedas, Armañanzas, Arteta, Azqueta, Beire, Burgui, Domeño, Ezkaroz, Ichaso, Lazagurria, Marcilla, Muniain de la Solana, Tudela, Urroz, Aibar, Cárcar, Huarte, Pueyo, Ardanaz, Milagro, Ituren. Guipuzkoa: Hondarribia, Peñas de Aia, Orio, Zarautz, Regil, Donostia, Pasaia, Monte San Marcial, Monte Jaizquibel, Azkoitia, Azpeitia, Zumarraga, Legazpi; Álava: Zalduondo, Barria, Ozaeta, Hermua, Galarreta, Calzada de San Adrián, la Guardia, Labastida, Oyón, El Ciego, Leza, Navaridas, Samaniego; Vizcaya: Bilbao, Durango, Iurreta. Muxika, Laida, Laga, Loiu, Areeta, Artea, Gernika, Derio, Leioa, Corredor del Txorierri. Iparralde: Hendaya, Sara, Ustariz, Sokoa, Urruña, Baiona, San Juan de Luz, Mauleon. Se han estudiado un total de 3567 ejemplares. Especie polífaga que puede resultar una plaga peligrosa de plantas hortícolas. Thrips trehernei Navarra: Arraioz, Cadreita, Oronoz Mugaire, Arlegui, Oieregui, Sunbilla, Vera, Lesaca, ventas de Yanci, Maya de Naztán, Olite. Guipuzkoa: Hondarribia, Azpeitia, Régil, Peñas de Aia, Azkoitia, Zarauzt, Aia, Orio, Mondragón. Vizcaya: Mallabia, Muxika, Iurreta, Pedernales, Bilbao. Álava: Zalduondo, Barria, Hermua, Salvatierra. Iparralde: Hendaya, Sokoa, Ustaritze. Se han estudiado 890 ejemplares. Especie asociada con compuestas (Tragopogon spp, Taraxacum officinalis, Centaurea pullata, Senecio doronicum). Thrips urticae Navarra: Sartaguda. Álava: La Guardia. Se han estudiado 2 ejemplares. Especie asociada con Urtica dioica, aunque nosotros la hemos encontrado sobre Diplotaxis erucoides. Otros autores la citan sobre Ranunculus y Anthriscus. Thrips validus Navarra: Ribaforada, Mugaire, Oieregui, Sunbilla, Vera, Ventas de Yanci, Lesaka. Guipuzkoa: Hondarribia. Vizcaya: Muxika, Iurreta. Álava: Ozaeta. Iparralde: Sokoa. Se han estudiado 299 ejemplares. Especie asociada a varias compuestas (Taraxacum, Tussilago y Leontodon). Nosotros la hemos encontrado en Sonchus arvensis. Thrips verbasci Navarra: Quinto Real. Se han estudiado dos ejemplares. Especie asociada a Verbascum spp. Thrips vuilleti Navarra: Tafalla. Álava: Oyón, La Guardia. Se han estudiado 19 ejemplares. Especie asociada a compuestas (Scabiosa leucantha, Scabiosa stellata, Senecio jacobea). Thrips vulgatissimus Navarra: Iturmendi, Castejón, Cadreita, Olite, Viana, Corella, Peralta, Arlegui, Funes, Pamplona, Tafalla, Caparroso, Sansoain, Bardena Negra, Larrasoaina, Vera, Quinto Real, Aibar. Guipuzkoa, Peñas de Aia, Aia, Hondarribia, Azpeitia, Orio, Zarautz, Azkoitia, Régil. Álava: Ozaeta. Barria, Hermua, Salvatierra, Araia. Vizcaya: Loiu, Muxika, Iurreta, Durango. Iparralde: Hendaya, Sara, Ustariz. Se han estudiado un total de 1120 ejemplares. Especie polífaga asociada a varios hospedadores (Tamarix, Diplotaxis, Sinapis, Genista, Lotus, Lonicera, Quercus y Juniperus). Bolothrips cingulatus Navarra: Larraga, Pitillas. Álava: La Guardia, Labastida. Se han estudiado 103 ejemplares, Especie esporófaga asociada a gramíneas tipo esparto (Lygeum spartium). Base de Juncus sp. Bolothrips dentipes Navarra: Fustiñana, Caparroso, Ribaforada, Marcilla, Arlegui, Cortes, Cabanillas. Álava: La Guardia, Labastida, Oyón. Se han estudiado 1713 ejemplares. Especie esporófaga asociada a Carex, Spartina y Juncus. Bolothrips icarus Navarra: Castejón, Pitillas. Álava: La Guardia. Se han estudiado 39 ejemplares. Especie esporófaga asociada a Lygeum spartium, Carex sp y Juncus sp. Bolothrips insularis Navarra: Pitillas, Larraga, Ribaforada. Álava: Lagunas de La Guardia, Navaridas, El Villar. Se han estudiado un total de 32 ejemplares. Especie esporófaga asociada a Juncus, Carex, Lygeum. Compsothrips albosignatus Navarra: Tafalla, Bardena Negra. Se han estudiado 22 ejemplares. Especie liquenófaga aasociada a Quercus rotunduifolia. Compsothrips maroccanus Navarra: Oteiza, Pitillas, Sierra de Codés. Tafalla. Álava: Santa Cruz de Campezo. Se han estudiado un total de 45 ejemplares. Especie esporófaga asciada a gramíneas cespitosas y arbustivas. Allothrips pillichelus Navarra: Carcastillo, Bardena Negra. Se han estudiado 12 ejemplares. Especie esporófaga asociada a suelos de encina y Pinus halepensis. Priesneriella clavicornis Navarra: Tafalla, Olleta. Se han estudiado 23 ejemplares asociados a ramas muertas de Quercus rotundifolia. Pseudocryptothrips meridionalis Navarra: Carcastillo, Viana, Miranda de Arga, Caparroso, Fustiñana, Larraga, Cadreita, Arlegui, Pitillas. Álava: Laguardia, Oyón, Labastida. Se han estudiado 124 ejemplares. Especie esporófaga asociada con gramíneas cespitosas. Cryptothrips nigripes Navarra: Tafalla, Tajonar. Se ha estudiado 3 ejemplares. Especie esporófaga asociada a ramas muertas de Quercus rotundifolia. Bacillothrips nobilis Navarra: Pitillas, Caparroso, Sansoain. Álava: Lagunas de Laguardia. Se han estudiado 34 ejemplares. Especie esporófaga asociada a gramíneas cespitosas. Megalothrips bonanii Navarra: Sansoain, Tafalla. Se han estudiado 23 ejemplares asociados a ramas muertas de Quercus rotundifolia. Megathrips inermis Navarra: Vedado de Eguaras. Se han estudiado dos ejemplares Especie esporófagas asociadas a gramíneas cespitosas. Hoplothrips longisetis Navarra: Bigüezal. Vizcaya: Iurreta, Muxika. Especie esporófaga asociada a ramas muertas de Pinus spp. Hoplothrips pedicularius Navarra: Pamplona. Vizcaya: Iurreta. Álava: Amurrio. Se han estudiado 5 ejemplares asociados a ramas muertas de Pinus spp. Especie esporófaga. Liothrips reuteri Navarra: Viana. Álava: Laguna de Laguardia. Se han estudiado 3 ejemplares asociados a Tamarix gallica. Esta especie es fitófaga y puedeo provocar agallas. Liothrips setinodis Navarra: Tirapu. Se ha estudiado un ejemplar. Especie asociada a Acer, Cornus, Ulmus, Quercus. Cephalothrips coxalis Navarra: Pitillas, Tafalla. Álava: Villabuena, La Guardia. Se han estudiado 5 ejemplares. Especie miceliófaga asociada a gramíneas cespitosas (Carlina, Spartium). Cephalothrips monilicornis Navarra: Viana, Caparroso, Marcilla, Cortes, Arlegui, Vedado de Eguaras, Velate, Pitillas, Quinto Real, Tafalla. Álava: Oyón. Se han estudiado un total de 680 ejemplares. Especie miceliófaga asociada a gramíneas cespitosas. Hindsiothrips bonessi Navarra: Corella, Caparroso, Bigüezal. Se han estudiado un total de 4 ejemplares. Especie probablemente depredadora asociada a gramíneas cespitosas. Hindsiothrips navarrensis Navarra: Pitillas, bardena Blanca, Carcastillo, Larraga. Se han estudiado 15 ejemplares. Especie probablemente depredadora asociada a gramíneas cespitosas. Apterygothrips piceatus Navarra: Ribaforada, Cortes, Villafranca. Álava: Santa Cruz de Campezo, Antoñana. Se han estudiado 12 ejemplares . Especie probablemente depredadora asociada a la región basal de gramíneas cespitosas. Apterygothrips priesneri Navarra: Sansoain, Añorbe. Álava: Labastida. Asociada a pinaza de Pinus halepensis. Se han estudiado tres ejemplares. Haplothrips acanthoscelis Navarra: Pitillas. Álava: laguna de La Guardia. Se han estudiado tres ejemplares. Especie asociada a Dorycnium, Potentilla, Euphorbia, Carex, Thymus, Scleranthus, Verónica, Statice, Ononis, Jasione y Crucianella. Haplothrips aculeatus Navarra: Ribaforada, Corella, Caparroso, Los Arcos, Caderita, Cabanillas, Marcilla, Cortes, Legasa, Pitillas. Guipúzcoa: Hondarribia, Aia. Álava: Laguna de Laguardia, Oyón. Se han estudiado 268 ejemplares. Especie asociada a Phragmites y otros cereales. También ha sido citada en Plantago, Rumex. Haplothrips anthemidinus Navarra: Sansoain. Álava: laguna de La Guardia, Antoñana, Santa Cruz de Campezo, Maestu. Se han estudiado 9 ejemplares. Asociada a Achillea millefolium. Haplothrips andresi Navarra: Tafalla, Sansoain. Se han estudiado 114 ejemplares. Especie asociada a flores de Quercus rotundifolia. Haplothrips crassicornis Navarra: Valtierra, Ribaforada, Castejón, Caparroso, Caderita, Funes, Cabanillas, Marcilla, Tafalla, Fustiñana. Álava: Labastida, Oyón. Se han estudiado 213 ejemplares. Asociada a gramíneas. Haplothrips distinguendus Navarra: Tafalla. Álava: Sierra de Izki, Santacruz de Campezo. Se han estudiado 12 ejemplares. Asociada a Cirsium, Scrophularia, Carduus y Knautia. Haplothrips frustrator Navarra: Pitillas, Bardena Negra. Álava: Labastida. Se han estudiado 42 ejemplares. Especie asociada a Salsola vermiculata. Haplothrips hispanicus Navarra: Tafalla. Se han estudiado 2 ejemplares. Especie asociada a compuestas (Senecio, Carlina). Haplothrips marrubiicola Navarra: Carcastillo, Tafalla, Iturmendi. Álava: Maestu, Villabuena. Vizcaya: Ermua. Se han estudiado 67 ejemplares. Especie asociada a Marrubium vulgare. Haplothrips niger Navarra: Larrasoaina. Guipúzcoa: Hondarribia, Alto de Guadalupe. Álava: Barria, Ozaeta. Vizcaya: Artea, Durango, Urkiola. Iparralde: Sokoa, Ustaritz, Hendaya. Se han estudiado 12 ejemplares. Especie asociada a Trifolium sp. Haplothrips phyllophilus Navarra: Mintxate, Quinto Real. Álava: Zalduondo, Vitoria (parque de la Florida). Se han estudiado 7 ejemplares. Especie asociada a Fagus sylvatica y a Fraxinus excelsior. Haplothrips reuteri Navarra: Tafalla, Quinto Real, Bardena Negra, Larrasoiana. Guipúzcoa: Hondarribia, Zarautz. Iparralde: Hendaya, Urruña. Se ha estudiado un total del 94 ejemplares. Asociada a compuestas (Senecio, Centaurea, Anthemis, Bellis, Anacyclus, Arctium, Eryngium). Haplothrips setiger Navarra: Tafalla, Artajona, Cadreita, Bardena Negra, Olite, Pitillas. Álava: Labastida, Laguna de Laguardia, Oyón, Santa Cruz de Campezo.Vizcaya: Bilbao. Se han estudiado 421 ejemplares. Especie asociada a compuestas (Senecio jacobea, Pyrethrum, Inula, Leontodon, Crepis, Matricaria, y Achillea). Haplothrips tritici Navarra: Tajonar. Álava: Matauko, Argomaniz, El Burgo, Galarreta. Se han estudiado 578 ejemplares. Especie asociada a cereales y gramíneas. Xylaplothrips fuliginosus Navarra: Mintxate. Álava: Amurrio. Vizcaya: Muxika, Iurreta, Inama. Se han estudiado 10 ejemplares. Especie asociada a Pinus spp. Bebelothrips latus Navarra: Vedado de Eguaras, Bardena Blanca, Unzué. Álava: Santa Cruz de Campezo. Se han estudiado 12 ejemplares. Especie asociada a hojarasca de Quercus rotundifolia. Amphibolothrips marginatus Navarra: Tafalla. Se han estudiado dos ejemplares. Especie asociada a hojarasca de Quercus ilex. Tylothrips osborni Navarra: Caparroso, Miranda de Arga. Se han estudiado ocho ejemplares. Especie asociada a materia orgánica en descomposición.