PROBLEMAS TEMA 8 8.1 Un líquido insoluble en agua se destila
Anuncio

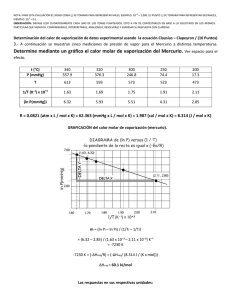
PROBLEMAS TEMA 8 8.1 Un líquido insoluble en agua se destila en corriente de vapor a dos presiones externas diferentes: a 759 mmHg la destilación ocurre a 95 ºC (la presión de vapor del agua a esta temperatura vale 634 mmHg); a 650 mmHg la destilación tiene lugar a 92 ºC (para la cual la presión de vapor del agua es 580 mmHg). Calcular el calor de vaporización (supuesto cte) y el punto de ebullición normal del líquido insoluble en agua (punto ebullición normal es la temp. de ebullición a P = 1 atm). o = 377.6 K. Solución. ∆hv = 51583 cal. Teb 8.2. La presión de vapor del mercurio puede representarse satisfactoriamente por la − 3333 ecuación empírica: Log P(mmHg) = + 10.52 − 0.84 log T . Calcular el calor T molar de vaporización a 100 ºC. Ayuda. Utiliza la ecuación de Clausius-Clapeyron para obtener ∆hv = 15232.14 – 3.83 T Solución. ∆hv = 13800.23 cal/mol. 8.3. Las presiones de vapor del cianuro de hidrógeno sólido y líquido vienen dadas, respectivamente, por 1864.8 1453 LogPs (mmHg) = 9.34 − LogPv (mmHg) = 7.74 − , . (Ps = presión de T T sublimación y Pv = presión de vaporización). Calcular: a) Los calores de sublimación, fusión y vaporización. b) P y T del punto triple. c) Punto de ebullición normal. Ayuda. Los calores de sublimación y de ebullición se pueden obtener utilizando la ecuación de Clausius-Clapeyron y las funciones dadas pasadas a logaritmos neperianos lnPs y lnPv. El calor de fusión puede obtenerse haciendo uso de la ley de Hess: sol → líq → vapor ⇒ ∆hs = ∆hf + ∆hv. Solución. a) ∆hs = 8522.32 cal/mol, ∆hv = 6640.63 cal/mol, ∆hf = 1881.68 cal/mol. b) o Tp,t=258.2 K, Pp,t= 131.15 mmHg. c) Teb = 298.74 K 8.4. El punto triple del hidrógeno corresponde a T3 = 14 K. La densidad del H2 sólido en este punto es 0.081 g/ml y la del H2 líquido 0.07 g/ml. La presión de vapor del líquido viene dada por Ln P (atm) = 6.8 –122/T – 0.3 ln T y la dependencia de la temperatura de fusión con la presión podemos tomarla como T=14 + P(atm)/33 a) Calcula los calores latentes (vaporización, sublimación y fusión) en el punto triple. b) Halla la pendiente de la curva de sublimación en el punto triple. Solución. a) ∆hs = 276.54 cal/mol, ∆hv = 234.03 cal/mol, ∆hf = 42.52 cal/mol. b) dPs / dT p, t = 0.0474 atm/K 8.5. Para temperaturas comprendidas entre 0 y 150 ºC, el calor latente de vaporización puede calcularse mediante la expresión: ∆h v = −0.6T + 763.9 cal / g . Suponiendo comportamiento ideal para el vapor de agua, calcular: a) presión a la que hervirá el agua a 67 ºC, b) expresión de la presión de vapor del agua líquida en función de T para el intervalo de temperatura (0 ºC, 150 ºC). Solución. a) 0.27 atms, b) lnP=50.73 - 5.43 lnT- 6920.1/T, c) Pp,t = 0.006 atm. 8.6. Se tiene hielo inicialmente a –3 ºC y 1 atm de presión y se aumenta reversible y adiabáticamente la presión hasta alcanzar el punto de fusión. Suponiendo que la pendiente de la curva de fusión es prácticamente constante y que para el proceso en cuestión ∂P = 428 atms = cte , representar el proceso en un diagrama P-T y ∂T S calcular la temperatura y la presión del punto de fusión. Datos.- ∆hf =3.34 105 J/Kg (a 0 ºC), vl - vs = -9.05 10-5 m3/Kg (a 0 ºC). ( ) Ayuda. Puedes obtener la ecuación de la “recta” de fusión calculando su pendiente con la ecuación de Clapeyron y tomando como un punto el de fusión normal del hielo (273K, 1atm). Obtendrás la siguiente ecuación: P = 36432.8 – 133.45 T (P en atms y T en K) Por otra parte, puedes obtener la ec. del proceso adiabático reversible (como la pendiente (∂P / ∂T) S se supone cte, se trata de una recta). Utilizando el punto de partida (270K, 1 atm) se obtiene, para este proceso, la ecuación P = 428 T-115559. La intersección de las dos rectas obtenidas es la solución del problema. Solución. T = 270.71K, P = 306.15 atms 8.7 Un recipiente, cuyas paredes son adiabáticas, contiene inicialmente una masa m0 = 20 g de agua líquida (calor específico c = 4185 J/Kg K) a la temperatura T0 = 345 K. El vapor formado en la evaporación es eliminado por medio de una bomba que lo aspira lentamente. El calor de vaporización del agua en el intervalo de temperatura considerado tiene la forma ∆hv = a-bT y decrece a un ritmo de 2900 J/Kg por grado Kelvin aumentado. La evaporación de la masa dm de agua produce una variación dT de la temperatura en el interior del recipiente (es decir, el calor necesario para la evaporación del agua lo toma de la propia masa del agua, enfriándose por consiguiente el agua que permanece líquida). Se pide: a) Establecer la ecuación diferencial que relaciona dm con dT. b) Cuando la fracción de agua vaporizada es 0.1, la temperatura en el interior del recipiente es 284 K. Determinar las constantes a y b de la ecuación ∆hv = a-bT . c) ¿Cuál es la fracción de agua vaporizada cuando en el recipiente queda la fase líquida a 0 ºC?. ¿Cuál es la masa m’ de hielo obtenida cuando desaparece todo el líquido? DATO.- Para el apartado c) tomar el calor de fusión del hielo como ∆hf = 335 J/g y despreciar la sublimación del hielo. Ayuda.- Llamar x a la cantidad de agua evaporada en un instante determinado; m0-x será el agua sin evaporar cuyo enfriamiento origina el calor necesario para la evaporación. Tener en cuenta que el proceso global ha de ser adiabático. De esta forma es inmediato llegar a la ecuación diferencial dx/(x-m0) = 4185 dT/(a-bT) La cte b nos la dan como dato y la constante a es inmediato obtenerla sin más que integrar la expresión diferencial obtenida en el apartado a) teniendo en cuenta la condición inicial (x = 0, T = 345) y el dato (x = 0.1m0, T = 284). En el apartado c) la fracción de agua vaporizada, x/m0, cuando en el recipiente queda la fase líquida a T=273 K, se calcula a partir de la misma ecuación diferencial. La segunda parte del apartado c) se resuelve teniendo en cuenta que la solidificación de una parte del agua que queda desprende un calor que es el necesario para evaporar, a 273 K, el agua restante. Solución.- a) dx/(x-m0) = 4185 dT/(a-bT). b) b=2900 J/Kg, a = 3336090 J/Kg. c) x/m0 = 0.1169 y 0.01765 Kg de hielo se formará. 8.8. Una larga columna vertical de cierto líquido se mantiene en condiciones isotérmicas a la temperatura de –5 ºC. El material situado por debajo de un determinado punto de la columna se halla en estado sólido; el situado por encima de este punto se mantiene líquido. Se reduce ahora la temperatura a –5.2 ºC, y se observa que la interfase sólidolíquido se desplaza hacia arriba 40 cm. El calor latente es 2 cal/g y la densidad de la fase líquida es 1 g/cm3. Hállese la densidad de la fase sólida. Ayuda. La presión en la posición original de la interfase permanece constante. Solución. ρs = 1.00159 g/cm3. 8.9. La transición Sn (s, gris) ⇔ Sn (s, blanco) está en equilibrio a 18 ºC y 1 atmósfera de presión. Si ∆S = 8.8 J/mol K para la transición a 18 ºC y si las densidades son 5.75 g/cm3 para el estaño gris y 7.28 g/cm3 para el blanco, calcula la temperatura de transición a una presión de 100 atmósferas. Nota.- suponer que la “curva” de equilibrio entre la fase Sn (s, gris) y Sn(s, blanco) es una recta. Solución. 286.05 K. 8.10. La variación de la presión atmosférica Pat con la altura h viene dada por la llamada fórmula de nivelación barométrica: log Pat = 5.26 log(1 – 0.0226 h) donde Pat se expresa en atmósferas y h en kilómetros. Calcular la temperatura de ebullición del agua en la cumbre del Mont-Blanc (4807 m) suponiendo que la presión de vapor del agua viene dada por la fórmula de Ranquine B log p v = A − (pv en mmHg y T en K) T Datos.- Para el agua se tienen las siguientes presiones de vapor a las temperaturas indicadas pv = 760 mmHg a T = 373 K pv = 100 mmHg a T = 324.9 K Solución. 357.25 K.