Método de descapsulación de nauplios de Artemia sp. para la
Anuncio

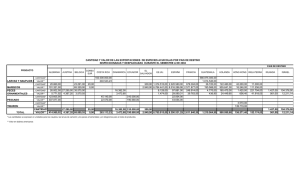
Método de descapsulación de nauplios 391 Método de descapsulación de nauplios de Artemia sp. para la alimentación de camarones peneidos Cecilia Vanegas Pérez y Cecilia Robles Mendoza Campo de aplicación Este procedimiento complementario se recomienda para la obtención de nauplios de Artemia sp. que pueden emplearse como alimento para el cultivo y mantenimiento de camarones peneidos y otras especies marinas. Material Probeta de 500 mL, vasos de precipitados de 500 mL, agitador de vidrio, pipeta serológica de 1 mL (recomendable con graduación de 1/100), bombilla para pipeta, contenedor plástico con ventana de malla planctónica (100 µL), contenedor transparente de incubación de 2 L, manguera para acuario, llave de paso pequeña para acuario y plástico negro grueso. 391 392 Ensayos toxicológicos Equipo Lámpara de luz blanca o foco de 40 watts y bomba de aireación. Reactivos Hipoclorito de sodio comercial (6% de cloro libre) y agua de mar natural, artificial o reconstituída. Organismos Quistes de Artemia sp. Procedimiento Se describe el procedimiento para la descapsulación de 1 g de quistes de Artemia sp. Se recomienda utilizar cepas de Artemia que garanticen un porcentaje de descapsulación del 90%. Descapsulación de quistes Diluir el hipoclorito de sodio comercial con agua de la llave, en una proporción de 1:2. Colocar 1 g de quistes de Artemia sp. por cada 100 mL de la solución diluida de hipoclorito de sodio y agitar constantemente hasta que la tonalidad de los quistes cambie de café a anaranjado intenso. Dependiendo de la cepa de Artemia el cambio de tonalidad ocurre entre 5 y 10 minutos. Transferir inmediatamente los quistes en un contenedor con una ventana de malla planctónica (para retener los quistes) y enjuagar con agua de la llave durante mínimo 1 hora para eliminar el cloro (figura F.1A). Incubación Colocar los quistes perfectamente enjuagados en el contenedor de incubación con 500 mL de agua de mar a 34 ups o agua de mar previamente filtrada. Mantener los organismos durante 24 a 48 horas a una temperatura de 28 °C, luz y aireación constante (figura F.1B). La aglutinación de los quistes altera la eclosión por lo cual es importante mantenerlos en constante movimiento con aireación desde la base del contenedor de incubación. Método de descapsulación de nauplios 393 Recolección de nauplios Para la separación de nauplios y quistes se recomienda bloquear la aireación cerrando la llave de paso y cubrir completamente el contenedor de incubación con plástico negro, dejando únicamente una pequeña apertura en la parte superior. Colocar junto a la apertura un foco o lámpara de 40 watts durante al menos 1 hora. Debido al fototactismo positivo de los organismos, los nauplios se concentrarán en la parte superior y los quistes precipitados estarán en el fondo del contenedor. Colectar el precipitado con los quistes sin eclosionar. En otro recipiente colectar los nauplios eclosionados. Debido a la alta densidad de los nauplios es probable el incremento de los compuestos de excreción (principalmente amonio), tanto en el agua como en los nauplios. Estos compuestos pueden a su vez ejercer un efecto tóxico en las postlarvas de los camarones peneidos. Por lo tanto, se recomienda enjuagar a los nauplios con agua de mar, concentrarlos en una densidad máxima de 1500 a 1800 nauplios/mL y mantenerlos en refrigeración hasta su uso. Se recomienda alimentar a las postlarvas de los camarones peneidos con quistes de Artemia eclosionados el mismo día. Conteo de nauplios Colocar a los organismos colectados en un vaso de precipitado de volumen conocido con agua de mar. Agitar suavemente para que la distribución de los Figura F.1. Dispositivos para la obtención de nauplios de Artemia sp. A) Para el lavado de quistes y B) Para la incubación de nauplios. a) ventana de malla planctónica, b) contenedor de incubación, c) llave de paso y d) soporte A B 394 Ensayos toxicológicos organismos sea homogénea y con una pipeta serológica tomar 1 mL del medio con nauplios. Debido a que la distribución de los organismos en la pipeta es irregular, se recomienda contar los nauplios que se encuentren en 0.1 mL de la parte inicial, media y final de la pipeta. Realizar al menos 10 conteos, obtener el promedio de organismos en 0.1 mL y extrapolar la densidad a 1 mL.