Guian°3_Quimica_LCCP_1°Medio
Anuncio

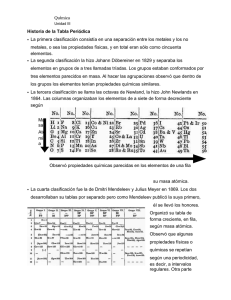
LICEO CARMELA CARVAJAL DE PRAT PROVIDENCIA DPTO DE QUÍMICA GUÍA DE APRENDIZAJE N°_3__ FECHA DE EDICIÓN: 19-10-2011 SECTOR: Química NIVEL/CURSO:NM1/1°Medios PROFESOR(ES): María Eugenia De la fuente B. MAIL DE PROFESORES: [email protected] UNIDAD TEMÁTICA o DE APRENDIZAJE: Propiedades Periódicas CONTENIDO: Tabla Periódica. Clasificación de los elementos químicos (metales, No Metales, Gases Nobles, Metales de transición, metaloides).Propiedades periódicas de los elementos (Volumen atómico, Radio atómico, Radio covalente, Radio iónico, Energía de ionización, Electronegatividad, Electroafinidad). APRENDIZAJE ESPERADO:- Reconocer que muchas de las propiedades de los elementos se repiten periódicamente, y valorar el ordenamiento de los elementos en la tabla periódica como el resultado de un proceso histórico en la búsqueda de sistematizar y ordenar una gran cantidad de información. -Relacionar el número atómico con los números cuánticos y la propiedades periódicas para ubicar los elementos en la tabla periódica. -Distinguir las propiedades de radio atómico, energía de ionización, Electroafinidad , y electronegatividad y reconocerlas como propiedades periódicas. TIEMPO PARA DESARROLLO: 2 horas PLAZO DE ENTREGA: NO TIENE. (SE DEBE DESARROLLAR EN EL CUADERNO) TABLA PERIÓDICA DE LOS ELEMENTOS QUÍMICOS. La organización mas satisfactoria de los elementos químicos fue obra de Dimitri Mendeleiev (1834-1907), quién señalo que las propiedades tanto físicas como químicas, de los elementos varían periódicamente al aumentar la masa atómica. Mendeleiev público una tabla periódica de los elementos químicos que es parecida a la actual. En su tabla los elementos estaban ordenados por masa atómica creciente, y en periodos; de modo que los elementos con propiedades químicas similares estuviesen en un grupo o en la misma columna vertical. Desde la época de Mendeleiev, la tabla periódica ha experimentado numerosos cambios para incluir elementos nuevos, valores más exactos y diferentes formas de rotular los grupos de los elementos de la tabla. En la tabla periódica actual los elementos están organizados en orden creciente del número atómico es decir en el número de protones presentes en el núcleo de cada elemento y no de la masa atómica creciente. Las propiedades periódicas de los elementos son funciones periódicas de sus números atómicos, dando origen a filas horizontales llamadas periodos y a columnas verticales conocidas como grupos o familias. PERIODOS. Los periodos de los elementos corresponden a filas horizontales de la tabla periódica y varían las propiedades físicas y químicas, en total son siete y nos indica el nivel de energía de los elementos. Cada periodo termina con un gas inerte. 2 Si observas la tabla periódica, en el primer periodo encuentras los elementos H y He, en ambos elementos los electrones se encuentran en el orbital 1s, para H 1s1 y para He 1s2, es decir ocupan el primer nivel de energía. En el segundo periodo (2) incluye desde Li hasta Ne ,en ellos los últimos electrones se localizan en orbitales 2s y 2p es decir ocupan el segundo nivel de energía o dos capas electrónicas. GRUPOS. Las columnas verticales conocidas como grupo o familias tienden a tener propiedades químicas similares. Se ordenan los grupos del 1 al 18 que antiguamente se clasificaban en los grupos A y en los grupos B. Cada grupo de elementos tienen igual número de electrones de valencia .Así: El grupo 1 (grupo I A) denominados Metales Alcalinos tienen 1 electrón de valencia ns1. Ejemplo: 2 2 6 1 11Na 1s 2s 2p 3s El grupo 2 (grupo II A) denominados Metales Alcalinos térreos tienen 2 electrones de valencia ns2. Ejemplo: 2 2 4Be 1s 2s El grupo 13(grupo III A) denominados Familia del Boro tienen 3 electrones de valencia ns2np1 .Ejemplo 2 2 6 2 1 13Al 1s 2s 2p 3s 3p El grupo 14(grupo IV A) denominados Familia de Carbono o Carbonoides tienen 4 electrones de valencia ns2np2.Ejemplo: 2 2 6 2 2 14Si 1s 2s 2p 3s 3p El grupo 15(grupo V A)) denominados Familia del Nitrógeno tienen 5 electrones de valencia ns2np3. Ejemplo: 2 2 3 7N 1s 2s 2p El grupo 16(grupo VI A) denominados Familia del Oxígeno o Calcógenos tienen 6 electrones de valencia ns2np4. Ejemplo: 2 2 6 2 4 16S1s 2s 2p 3s 3p -1El grupo 17(grupo VII A) denominados Halógenos tienen 7 electrones de valencia ns2np5.Ejemplo: 2 2 6 2 5 17Cl 1s 2s 2p 3s 3p Los grupos 1, 2, 13, 14, 15, 16 y 17 (antiguos grupos A) corresponden a los Elementos Representativos que se caracterizan por terminar su configuración electrónica en los subniveles s o sp El grupo 18(grupo 0) denominados Gases Nobles o elementos inertes se caracterizan por tener todos sus niveles energéticos completos su configuración externa se representa por ns2np6 es decir con 8 electrones en su último nivel a excepción del Helio que tiene una configuración electrónica 1s2. ELEMENTOS DE TRANSICIÓN. Los grupos desde el 3 hasta el 12 inclusive (antiguos grupos B) corresponden a los elementos de Transición, en cuya configuración electrónica los últimos electrones ocupan los “orbitales d”. Estos elementos se ubican en la parte central de la tabla. 3 Existen cuatro series de elementos de transición, según el subnivel (n-1) d sea 3d ,4d, 5d o 6d. Por ejemplo: Primera serie de transición desde 21 Sc hasta 30 Zn Segunda serie de transición desde 39 Y hasta 48 Cd Tercera serie de transición desde 57 La hasta 80 Hg La configuración electrónica externa de estos elementos, se puede representar como: (n-1) d1-----> 9ns 0 ---->2. Ejemplos: Sc z=21 (Ar) 3d1 4s2 (n=4) Y z=39 (Kr) 4d1 5s2 (n=5) La z=57 (Xe) 5d1 6s2 (n=6) Ac z=89 (Rn) 6d1 7s2 (n=7 ELEMENTOS DE TRANSICIÓN INTERNA. Corresponden a los elementos que tienen subniveles “f” parcialmente ocupados. Las dos filas de la parte inferior de la tabla periódica corresponden a los Elementos de transición interna. Se clasifican en la serie de los Lantánidos y de los Actínidos. La serie de los lantánidos corresponden a los elementos con número atómico del 58 al 71. La serie de los actínidos corresponden a los elementos con número atómico del 90 al 103.Los elementos transuránicos corresponden a todos los elementos que siguen al uranio (número atómico 92) y estos elementos son sintéticos y radiactivos. METALES, NO METALES Y METALOIDES. Los metales se caracterizan por tener brillo, ser dúctiles, ser buenos conductores del calor y de la electricidad, casi todos son sólidos , a excepción del mercurio que es líquido, son maleables (pueden laminarse).Ejemplo el hierro Los no metales carecen de brillo, no son dúctiles ni maleables, son malos conductores del calor y de la electricidad, se pueden presentar en cualquier estado de la materia. Ejemplo el no metal yodo que tiene propiedades bactericidas que se utiliza en tratamiento de heridas Los metaloides o semimetales tienen propiedades intermedias entre los metales y los no metales. Ejemplo de metaloide el silicio y germanio que son semiconductores utilizados en la industria electrónica. PROPIEDADES PERIÓDICAS. Relaciones de tamaño: a.- Volumen atómico b.- Radio atómico c.- Radio covalente d.- Radio iónico Relaciones de energía: a.- Potencial de ionización b.- Electroafinidad c.- Electronegatividad 4 RELACIONES DE TAMAÑO. VOLUMEN ATÓMICO (V). Si se considera al átomo como una esfera rígida, el volumen atómico molar se define como el número de centímetros cúbicos que corresponde a un mol de sus átomos. Se calcula dividiendo la masa atómica expresada en g/mol por la densidad expresada en g/cm3. Por lo tanto la fórmula es V = M / D Para calcular el volumen de un solo átomo de cualquier elemento se utiliza la siguiente fórmula: v= V / N° de Avogadro Donde v= volumen del átomo N° de Avogadro= 6,02 x 1023 Ejemplo: Si la densidad del átomo de Litio es 0,507 g/cm3. Calcular V y v La masa atómica de litio es 6,94 g/mol Respuesta: V= M = 6,94 g/mol = 13,6 cm3/ mol v= V = 13,6 cm3 /mol = 2,25x 10-23cm3 D 0,507 g/cm3 N° A 6,02x1023 mol RADIO ATÓMICO. El radio atómico se define como la distancia media que existe entre los núcleos atómicos de dos átomos que se encuentran unidos mediante un enlace. Se considera al átomo como una esfera. El radio atómico aumenta a medida que se desciende en un grupo y disminuye de izquierda a derecha en un periodo. El radio atómico está expresado en Angstrom(A°). Representación del Radio Atómico. Radio atómico= ½ del diámetro RADIO COVALENTE. Se define como la mitad de la distancia entre los núcleos de dos átomos iguales unidos por enlace covalente. 5 RADIO IÓNICO. Al igual que el radio atómico, se define como la distancia entre el centro del núcleo y el electrón más alejado de éste. El radio iónico es el radio que tiene un átomo cuando ha perdido o ganado electrones, adquiriendo la estructura electrónica del gas noble más cercano, para lograr estabilizarse y esto lo consiguen compartiendo o transfiriendo electrones de un átomo a otro cuando ellos se unen. Ejemplo: Cuando se unen Na y Cl para formar NaCl estos lo hacen formando iones Na + y Cl-, veamos como sucede: 2 2 6 1 y 2 2 6 2 2 2 1 11Na 1s 2s 2p 3s 17Cl 1s 2s 2p 3s 3px 3py 3pz Al átomo de Na entrega el electrón que se encuentra en 3s1 y el cloro lo recibe en 3pz1 formándose iones que se unen por diferencias de carga formando una sal denominada cloruro de sodio. + 2 2 6 11Na 1s 2s 2p 2 2 6 2 2 2 2 17Cl 1s 2s 2p 3s 3px 3py 3pz En general, el radio iónico de los iones isoelectrónicos (especies químicas que coinciden con su configuración electrónica) disminuyen en un periodo, mientras aumentan a medida que descienden en un grupo. GRUPO 1 (GRUPO IA) METALES ALCALINOS RADIO ATÓMICO (A°) Li Na K Rb Cs 1,55 1,90 2,35 2,48 2,67 RADIO IÓNICO (A°) CATIÓN + Li 0,68 + Na 0,95 + K 1,33 + Rb 1,47 + Cs 1,69 Si observas los valores tanto del radio atómico y de radio iónico para el grupo 1, a medida que se desciende en el grupo los valores aumentan en los radios. Pero si comparamos el radio atómico y el radio iónico para un mismo elemento de este grupo observamos que disminuye el radio iónico. En los cationes el radio iónico es menor que el radio atómico GRUPO 17(GRUPO VIIA) HALÓGENOS, RADIO ATÓMICO (A°) F Cl Br I 0,72 0,99 1,14 1,33 RADIO IÓNICO (A°) ANIONES F-1 1,34 Cl-1 1,81 Br-1 1,95 I-1 2,16 En los aniones el radio iónico es mayor que el radio atómico. 6 RELACIONES DE ENERGÍA. POTENCIAL DE IONIZACIÓN (PI) O ENERGÍA DE IONIZACIÓN (EI). Es la energía necesaria para expulsar al electrón más débilmente retenido de un átomo gaseoso desde su estado fundamental para formar un ión gaseoso. Átomo neutro (gaseoso) + energía ------> catión (g) + electrón Siendo esta energía la correspondiente a la primera energía de ionización (EI1).El segundo potencial de ionización (EI2) representa la energía precisa para sustraer el segundo electrón; este segundo potencial de ionización es siempre mayor que el primero, pues el volumen de un ión positivo es menor que el del átomo. El potencial o energía de ionización se expresa en electrón-voltio, en kJ/mol o en Kcal/mol. Ejemplo: Aplicamos los potenciales de ionización para expulsar los tres electrones débilmente retenidos para el átomo de aluminio, 13Al cuya configuración electrónica es: (Ne) 3s2 3p1 Al°(g) + energía -----> Al+ (g) + e EI1 = 138 Kcal/mol Se remueve el electrón 3p: (Ne)3s2 Al+(g) + energía -----> Al+2 (g) + e EI2 = 432 Kcal/mol Se remueve el electrón 3s: (Ne)3s1 Al+2(g) Al°(g) + + energía -----> Al+3 (g) + e EI3 = 653 Kcal/mol Se remueve el segundo electrón 3s: (Ne) energía -----> Al+3 (g) + 3 e Energía total= 1223 Kcal/mol Luego la configuración de Al ha cambiado de (Ne) 3s2 3p1 a (Ne) y se ha formado el ión Al+3 isoelectrónico del Ne. La energía de ionización más elevada corresponde a los gases nobles, ya que su configuración electrónica es la más estable, y por tanto habrá que proporcionar más energía para arrancar un electrón y es muy difícil remover un electrón de un átomo de estos elementos. En la tabla periódica la energía de ionización aumenta en un periodo a medida que crece el número atómico es decir de izquierda a derecha y disminuye en un grupo. En los metales alcalinos, por ejemplo, el elemento de mayor potencial de ionización es el litio y el de menor el francio. AFINIDAD ELECTRÓNICA O ELECTROAFINIDAD (EA). Es la energía liberada cuando un átomo de una muestra gaseosa capta un electrón para formar un anión. La siguiente ecuación representa el proceso: Átomo neutro (gaseoso) + electrón-------> ión negativo (gaseoso) + energía Ejemplo: Para un átomo de oxígeno tenemos lo siguiente: O°(gas) + 2 e -------> O-2(gas) + 168 kcal/mol 7 Mientras mayor es el valor de la afinidad electrónica de un elemento mayor es la tendencia a la captación de un electrón para formar el anión y mayor es la energía Liberada en el proceso. En la tabla periódica la afinidad electrónica (EA) aumenta en un periodo y disminuye en un grupo. ELECTRONEGATIVIDAD (EN). La electronegatividad es una medida de la tendencia de un átomo en un enlace covalente a atraer hacia sí los electrones compartidos. Cuando un átomo forma parte de una molécula sus electrones, especialmente los más externos, están sometidos no sólo a la atracción de su propio núcleo, sino que también experimentan atracción por parte de la carga nuclear de los átomos vecinos. Vamos a suponer la situación de 2 electrones comunes a dos átomos A y B vecinos en una molécula. Este par de electrones es objeto de una competencia de atracciones por parte de ambos átomos, competencia que puede originar a lo menos tres resultados importantes: 1° empate (A : B) ENA = ENB 2° gana A (A: B) ENA > ENB 3° gana B (A :B) ENA < ENB Analicemos el significado de cada una de las tres situaciones. 1°) Si el par electrónico queda sometido a igual atracción por parte de A y B, es decir, es compartido equitativamente; significa que ambos elementos tienen la misma EN. 2°) En este caso la compartición no es equitativa y el par electrónico común es atraído con más fuerza por el átomo A, encontrándose más cerca de éste. Esto significa que la ENA es mayor que la ENB. 3°)En cambio si B atrae el par electrónico con más fuerza que A, significa que la ENB es mayor que la ENA. Los elementos más electronegativos de la tabla periódica son los Halógenos. Lo anterior debido a que para estabilizarse energéticamente, necesitan sólo un electrón. La escala de electronegatividad fue desarrollada por Linus Pauling, que estableció que el Flúor (F) es el elemento más EN. EN DE ALGUNOS ELEMENTOS NO METALES F O Cl N Br C H 4,0 3,5 3,0 3,0 2,8 2,5 2,1 METALES Li Al Mg Ca Cs K Na 1,0 1,5 1,2 1,0 0,7 0,8 0,9 En un periodo de elementos, la electronegatividad aumenta con el número atómico. Dentro de un grupo la electronegatividad disminuye a medida que el número atómico aumenta. 8 DESARROLLAR LAS SIGUIENTES ACTIVIDADES PARA COMPROBAR TUS CONOCIMIENTOS. Responde brevemente en tu cuaderno las siguientes preguntas: 1.- ¿En qué se basa el ordenamiento moderno de la tabla periódica? 2.- Explica mediante un diagrama el comportamiento a lo largo de un grupo y de un periodo en las siguientes propiedades: radio atómico, electronegatividad y la energía de ionización. 3.- ¿Cuál es la variación que tiene la configuración electrónica de los elementos químicos a lo largo de un periodo y también en un grupo? 4.- Dada las siguientes configuraciones electrónicas básicas. Identificar ¿A qué grupo de elementos químicos pertenece cada uno de éstos de acuerdo a la clasificación de los elementos en la tabla periódica? ns2np6 = ns2np5 = (n-1)d1ns2 = ns2= (n-1)d6ns2 = ns1 = 5.- Nombrar 2 propiedades de los No Metales y 2 propiedades de los Metales. 6.- ¿Por qué los elementos químicos ubicados en el mismo grupo tienen propiedades químicas muy similares? 7.- ¿Cuál es el elemento de la tabla periódica que presenta la mayor electronegatividad? 8.- Con base a la distribución electrónica de los elementos Ne, Ar y Kr. Identifica el grupo, periodo y ubicación en la tabla periódica. ¿Qué comportamiento se puede esperar de ellos? Explica. 9.- Al realizar la distribución energéticas de los siguientes elementos Be, Mg y Ca ¿Cómo justifica que pertenecen al mismo grupo? 10.- Nombre 2 elementos transuránicos. 11.- Escribe la configuración electrónica de los siguientes pares de electrones a.- Li y Na b.- Be y Mg c.- N y P d.- F y Cl a) De cada uno de estos pares una vez realizado la configuración electrónica ¿Qué puedes decir respecto a su capa de valencia? b) Identifica ¿A qué grupos de la tabla periódica representan los pares propuestos? c) Reconoce el período al que pertenece cada uno de los elementos. ¿Qué puede concluir? 12.-Si a un átomo neutro gaseoso se le extraen 3 electrones para formar catión(g) a) Indicar ¿Cuántos potenciales de ionización hay en esta situación? b) ¿En qué caso se debe aplicar un valor más alto de EI ? 9 13.- ¿Cuál es el aporte de Mendeleiev en relación a la tabla periódica? 14.-Explica con tus palabras qué es: a.- radio atómico b.- electronegatividad c.- metaloides d.- serie isoelectrónica e.- elementos representativos f.- lantánidos