Cultivo in vitro: propagación de plantas
Anuncio

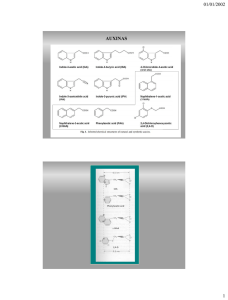
Cultivo in vitro: propagación de plantas Hojas de enraizando crisantemo Plántula de crisantemo en envase Magenta Un cultivo in vitro es aquel realizado sobre un medio nutritivo en condiciones estériles. Puede ser de: plantas, semillas, embriones, órganos, explantos, células y protoplástos. Características del cultivo in vitro: Es empleado a microescala Hay optimización ambientales de las condiciones No se produce el patrón normal de desarrollo de una planta Hace factible la manipulación de las célula individuales o tejidos. Fundamental para transformación genética. Pioneros del Cultivo in vitro Tipos de Cultivo in vitro. Propagación y regeneración de plantas Plantas regeneradas ORGANOGÉNESIS Callos EMBRIOGÉNESIS Suspensión de células Protoplastos Explantos: trozos hojas, tallos, meristemos, etc. Microesporas/gametos Planta donante Suspensión de células Callos Protoplastos Explantos: trozos hojas, tallos, meristemos, etc. Microesporas/gametos Condiciones de los cultivos in vitro ¡¡ESTERILIDAD!! Esterilización del material vegetal Se emplean medios nutritivos muy ricos, por lo que la esterilización de todo el material es esencial TOTIPOTENCIA Capacidad de las células vegetales de regenerar un organismo completo. REPROGRAMACIÓN DESARROLLO Se altera el patrón de células que estaban completamente diferenciadas. COMPETENTES No todas las células que responden al cambio de programa de desarrollo. Diferenciación Morfogénesis Cambios de forma y función de orgánulos, células y tejidos Organización de la estructura de tejidos y órganos. Arquitectura y simetría de la planta DESARROLLO Crecimiento Incremento biomasa por división y elongación celular Microescala Auxinas Se transporta polarmente desde el ápice de parte aérea o raíz. El transporte de larga distancia se produce por el floema. Junto con las citoquininas son esenciales para la viabilidad de las plantas: no hay mutantes deficientes. La estructura química de las auxinas es diversa. Pueden acumularse en formas inactivas conjugadas a oligosacáridos y aminoácidos. Auxinas naturales encontradas en plantas Auxinas sintetizadas químicamente Proliferación de raíces secundarias Control [Auxina] > 10-8 M causa el inicio de divisiones celulares en el periciclo. Regeneración de plantas favoreciendo el enraizamiento Alta [auxina] Interacción con citoquinina y ácido abscísico en la dominancia apical de tallo Escisión del ápice causa proliferación de tallos axilares La auxina está implicada en la redistribución de las citoquininas sintetizadas en la raíz hacia el ápice. Escisión del ápice: mayor nivel de citoquinina en las yemas laterales. El ácido abscísico se acumula en las yemas laterales latentes. La escisión del ápice disminuye su contenido. Citoquininas: descubiertas en cultivos in vitro Las se descubrieron al buscar factores que indujeran divisiones celulares y promoviesen el crecimiento de material vegetal. Se probaron multitud de substancias: extractos de levadura, jugo de tomate, etc. La leche de coco (rica en zeatina) fue muy efectiva, más en conjunción con auxina Skoog descubrió que DNA desnaturalizado de esperma de arenque era muy efectivo en promover división celular La kinetina fue la primera citoquinina identificada producida de síntesis por la degradación térmica de DNA Diferentes tipos de citoquininas Sintética Natural Sintética Bencilamino purina (BAP) Producción de callos por acumulación de citoquininas: Agrobacterium CALLO tejido desdiferenciado en continua división. AGALLA tumor producido por la infección de Agrobacterium tumefaciens por acumulación de citoquininas y auxinas En la infección, se produce la inserción de genes bacterianos en el genoma de la célula vegetal, portados en el T-DNA. Éstos codifican enzimas para la síntesis de dichas fitohormonas. Proliferación de parte aérea Control + Citoquinina Distintas moléculas tienen diferente actividad Auxinas y citoquininas tienen diferente nivel de actividad biológica según la molécula empleada: establecer la dosis. Regeneración por organogénesis Concentración de IAA (mg/L) 0,18 1,18 3,0 RAÍZ 0,03 CALLO 0,005 HOJA 0 0,2 1,0 Concentración de kinetina (mg/L) 0 Regeneración de plantas por organogénesis El callo se somete a una relación auxina/citoquinina baja, para inducir la formación de parte aérea. En condiciones de esterilidad, se secciona la parte aérea formada. Se transplanta a un medio de cultivo con una relación auxina/citoquinina alta, para inducir la formación de raíces. Una vez generadas raíces, se transfieren a un sustrato con alta capacidad de retención de agua (p. ej. turba). Las plántulas se cultivan en condiciones de humedad óptima para evitar su desecación, hasta que la raíz se afianza. Protoplastos Obtención enzimática Diversos materiales se pueden incorporar a un protoplasto: orgánulos, DNA plasmídico, bacterias, etc. Variación somaclonal Beneficiosa Perjudicial: indeseable en la generación de plantas transgénicas Transformación de plantas: Agrobacterium Inserción del T-DNA con oncogenes y genes de metabolismo de opinas Pioneros del desarrollo de vectores de transformación basados en Agrobacterium Jeff Schell Mark Van Montagu Plásmido Ti de Agrobacterium tumefaciens Estructura general del T-DNA LB RB Genes vir NO se transfieren SELECCIÓN DE PLANTAS TRANSGÉNICAS Selección de trasngénicos con kanamicina Sólo unas pocas células son transgénicas: varios pasos de selección Vectores binarios desarmados derivados del plásmido Ti de A. tumefaciens LB Nos T MnSOD 35S 35S nptII 35S T Cebadores específicos utilizados Fragmento Cebador positivo Cebador negativo Rubisco tccctgtttcaaggaagc gtcgcataaaattgaaggag (349 pb) Rbcs01F Rbcs02R nptII gaagagcatcaggggctc gaagaactcgtcaagaaggc (317 pb) nptII01F nptII02R 35S tgccatcattgcgataaagg cctctccaaatgaaatgaac (234 pb) 35S01F 35S02R Nos term gaatcctgttgccggtcttgcg gcgggactctaatcataaaaac (127 pb) nos01F nos02R RB