001-LA TABLA PERIÓDICA
Anuncio
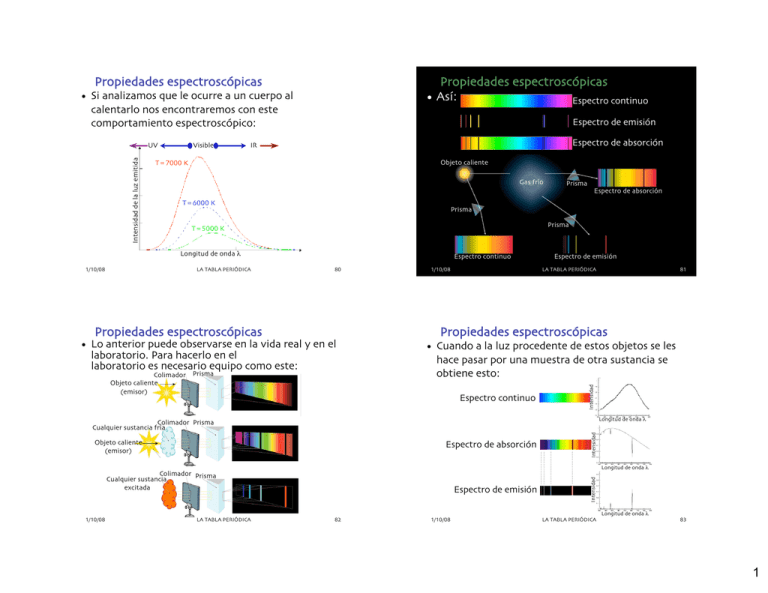
Propiedades espectroscópicas Propiedades espectroscópicas • Así: Espectro continuo • Si analizamos que le ocurre a un cuerpo al calentarlo nos encontraremos con este comportamiento espectroscópico: Visible Espectro de absorción IR Objeto caliente T=7000 K Gas frío Espectro de absorción T=6000 K Prisma Prisma T=5000 K Longitud de onda λ 1/10/08 Prisma LA TABLA PERIÓDICA Espectro continuo 80 Propiedades espectroscópicas 1/10/08 Espectro de emisión LA TABLA PERIÓDICA 81 Propiedades espectroscópicas • Lo anterior puede observarse en la vida real y en el laboratorio. Para hacerlo en el laboratorio es necesario equipo como este: Colimador Prisma Objeto caliente (emisor) • Cuando a la luz procedente de estos objetos se les hace pasar por una muestra de otra sustancia se obtiene esto: Espectro continuo Intensidad Intensidad de la luz emitida UV Espectro de emisión Longitud de onda λ Objeto caliente (emisor) Espectro de absorción Intensidad Colimador Prisma Cualquier sustancia fría Espectro de emisión Intensidad Longitud de onda λ Colimador Prisma Cualquier sustancia excitada Longitud de onda λ 1/10/08 LA TABLA PERIÓDICA 82 1/10/08 LA TABLA PERIÓDICA 83 1 Propiedades espectroscópicas • Así en principio cada elemento tiene un espectro de absorción y de emisión característico, como se puede ver en esta liga: • espectros Hidrógeno Propiedades espectroscópicas • En particular los espectros de emisión son parte de nuestra vida cotidiana, aquí mostramos varios ejemplos: Sodio Helio Neón Mercurio 1/10/08 LA TABLA PERIÓDICA 84 85 • Los resultados obtenidos del estudio de los espectros de líneas de los elementos no podían explicarse empleando la física clásica. • Pues si consideramos el modelo del átomo propuesto por Rutherford, que era muy popular al principio del siglo XX, al electrón se le consideraba como si estuviera dando vueltas alrededor del núcleo. • De tal manera que la fuerza centrífuga estuviera balanceada respecto a la atracción coulómbica. • Entonces, un átomo así debería de ser capaz de absorber o emitir cualquier cantidad de energía. • ¿Pero a qué se debe este fenómeno? • Lo podemos atribuir a que los átomos que componen al gas, absorben la luz. • ¿Y por qué absorben la luz? • Sabemos que la radiación es causada por la vibración de las cargas y la rapidez de la vibración determina la longitud de onda. • Esto significa que, si solamente ciertas longitudes de onda pueden ser absorbidas o emitidas por el átomo, sus electrones vibran solamente a ciertas frecuencias. LA TABLA PERIÓDICA LA TABLA PERIÓDICA Modelo del átomo y espectroscopía Propiedades espectroscópicas 1/10/08 1/10/08 86 1/10/08 LA TABLA PERIÓDICA 87 2 Modelo del átomo y espectroscopía Modelo del átomo y espectroscopía • De manera que el cambio en su energía meramente alteraría el radio de la órbita. • Pero, se sabía que los gases absorbían o emitían energía en paquetes, es decir estaba cuantizada. • En tanto que la luz que se producía por medio de un objeto caliente (foco), era continua. • En el año de 1900, Max Planck demuestra que los átomos de un sólido caliente, tienen energías que son un múltiplo de una cantidad fija. • A esta cantidad de energía le llamó quantum o paquete de energía. • Así, los físicos de la época se vieron forzados a considerar desechar por completo este modelo (a pesar de estar tan bien sostenido por la evidencia experimental). • O hacerle algunas modificaciones difíciles de digerir. • Es claro que, sería estúpido proponer que el átomo pudiera contener cualquier energía (tal como lo dicta el modelo planetario) • Y a pesar de ello absorber o emitir energía en cantidades especiales y medidas. 1/10/08 LA TABLA PERIÓDICA 88 El modelo de Bohr • ¿Pero entonces como es un átomo? • Pues la alternativa era postular que los electrones en el átomo podían tener solamente ciertos valores de energía. • Esto implicaba automáticamente, que el átomo podría absorber o emitir únicamente ciertas energías. • Lo que es claro, es que al principio del siglo XX, este era un verdadero rompecabezas para los científicos. • Una teoría o un modelo raramente se abandona por completo, a menos que no haya alternativa. • De hecho el modelo planetario no se abandonará sino hasta que finalmente se desarrolla el modelo cuántico. 1/10/08 LA TABLA PERIÓDICA 90 1/10/08 LA TABLA PERIÓDICA 89 El modelo de Bohr • Afortunadamente, (Niels Bohr) un físico danés, sugiere un cambio al modelo muy radical. • Este es el más simple y sensato de los modelos basado en el de Rutherford. • Lo radical del modelo, reside en que Bohr propone que para explicar las líneas espectrales, los electrones deben seguir una regla medio mafufa. • Esta regla es que sólo pueden estar en ciertas órbitas especiales y todas las otras órbitas están prohibidas. • Por lo tanto, los electrones pueden saltar de una órbita a otra y al hacerlo vibran. • Consecuentemente producen radiación. 1/10/08 LA TABLA PERIÓDICA 91 3 El modelo de Bohr • Entonces, Bohr descubrió que se podía explicar cuantitativamente el espectro del hidrógeno si se consideraba que en el átomo los electrones se movían únicamente en aquellas órbitas especiales donde el momento angular del electrón era un múltiplo de h / 2π. • Es decir que la energía del electrón estaba cuantizada. • Esta propuesta tan arbitraria y mafufa para su tiempo, es aceptable en parte, por que consigue salvar el modelo planetario al menos por un tiempo. • Y la evidencia experimental de la estructura en capas de los electrones puede verse en los espectros de líneas. 1/10/08 LA TABLA PERIÓDICA 92 El modelo de Bohr 1/10/08 LA TABLA PERIÓDICA • Así, en el caso del átomo de hidrógeno, la energía de cada uno de los niveles cuánticos se puede obtener usando la siguiente ecuación: E=! k Z2 n2 • Y la diferencia de energía entre dos niveles cualquiera del átomo en cuestión usando esta: #1 1& E2 ! E1 = h " = h Z %% 2 ! 2 (( $ n1 n2 ' 2 1/10/08 LA TABLA PERIÓDICA 93 El modelo de Bohr • De esta manera, este modelo puede racionalizar el comportamiento químico de los elementos, al arreglar a los electrones en capas. • Es decir, al cuantizar las energías de los electrones en capas discretas (llamadas K, L, M, N, O, etc.), se pueden explicar las propiedades químicas de los elementos. • Esta teoría además predice el número de electrones en cada una de las capas así: # de electrones = 2n El modelo de Bohr 2 94 • En esta tabla se muestran las ocupaciones de cada capa: Capa K L M N O n 1 2 3 4 5 2n2 2 8 18 32 50 1/10/08 LA TABLA PERIÓDICA 95 4 El modelo de Bohr El modelo de Bohr • Y los niveles energéticos permitidos o estados energéticos de un átomo (usando terminología moderna) serán: • De esta manera tenemos que cuando un átomo se encuentra en su estado basal y lo excitamos usando un haz de luz o calor, solamente ciertas de las longitudes de onda tendrán la energía suficiente para hacer que el electrón pueda pasar a otra órbita y serán esas longitudes (o frecuencias o energías) las que se absorberán . • Y de la misma manera, cuando dejamos de excitarlo, los electrones que se pasaron a una órbita de mayor energía al regresar a su órbita original emitirán energía. Momento angular de los estados espectroscópicos del átomo de hidrógeno 96 El modelo de Bohr 97 • Transiciones del hidrógeno (absorción): En n ∞ 0 1 1230 98 1/10/08 Ultravioleta LA TABLA PERIÓDICA Visible Energía (kJ/mol (kJ/mol)) −1312.0 0 184 6 5 4 3 2 1167 Capa M, n=3, n=3, r=4.761 r=4.761 Å Capa N, n=4, n=4, r=8.464 r=8.464 Å Capa O, n=5, n=5, r=13.225 r=13.225 Å −36.4 −52.3 −82.0 −145.6 −328.0 246 Núcleo Capa K, n=1, n=1, r=0.529 r=0.529 Å Capa L, n=2, n=2, r=2.116 r=2.116 Å LA TABLA PERIÓDICA LA TABLA PERIÓDICA El modelo de Bohr • Órbitas de Bohr del hidrógeno 1/10/08 1/10/08 276 LA TABLA PERIÓDICA 293 1/10/08 p= n ( h / 2π), n es un entero 1 (h / 2π) 2 (h / 2π) 2 (h / 2π) 3 (h / 2π) 3 (h / 2π) 3 (h / 2π) 984 Estado 1s 2s 2p 3s 3p 3d −1312 99 5 El modelo de Bohr El modelo de Bohr • Aquí vale la pena indicar que el átomo de hidrógeno (y por cierto todos los demás también), absorben y emiten radiación a otras longitudes de onda además de las del visible. • Transiciones del hidrógeno (emisión): En n ∞ 0 1/10/08 1 Ultravioleta El Hidrógeno se ioniza con energías superiores a 13.6 eV Lyman Balmer Paschen Energía (eV (eV) Visible Energía (kJ/mol (kJ/mol)) 184 293 276 984 1230 −1312.0 246 0 6 5 4 3 2 1167 −36.4 −52.3 −82.0 −145.6 −328.0 −1312 LA TABLA PERIÓDICA 100 Bracket 13.6 eV/ molécula 1313 kJ/mol Series 1/10/08 LA TABLA PERIÓDICA El modelo de Bohr El modelo de Bohr • Es interesante comentar que la propuesta de Bohr le abre el camino a la mecánica cuántica, independientemente del hecho de que es incorrecta casi en todos sus detalles. • Particularmente, porque el modelo no nos da ninguna pista del origen de el enlace químico. • Además no da ninguna base para entender por que ocurre la cuantización de la energía del electrón. • Ni tampoco explica la razón por la cual un electrón no irradia energía al estar en movimiento. • A pesar de este funesto historial, el coraje de reconocer la necesidad de una desviación de la física clásica, le ganó a Bohr un lugar en la historia. • Todavía hoy, a los estados permitidos, se conocen como estados estacionarios, tal como los bautizó Bohr. • A estos estados estacionarios, se les caracteriza por medio del uso de los números cuánticos. • Los cuales explican el patrón característico del átomo de hidrógeno. 1/10/08 LA TABLA PERIÓDICA 102 1/10/08 LA TABLA PERIÓDICA 101 103 6 ¿Partículas u ondas? ¿Partículas u ondas? • Hasta este momento hemos hablado de los electrones y de las otras partículas subatómicas como si fueran pedacitos de materia duros como bolas de billar (¡tienen masa!). • Son diferentes a las bolas de billar en que tienen niveles energéticos claramente cuantizados. • Estos niveles, pueden medirse de manera muy precisa, usando los espectros de emisión y absorción de los elementos. • Sin embargo estas las partículas subatómicas, a menudo tienen un comportamiento que no se puede explicar con este modelo. LA TABLA PERIÓDICA 104 106 E le c tro ne s E d e le c sp tro ed n id e s os • Por otro lado al mismo tiempo se ha demostrado experimentalmente con un fototubo: – Que la energía de los electrones emitidos es independiente de la intensidad del haz incidente ia l ter e M a n s ib l o se fo t á to d o c LA TABLA PERIÓDICA 105 ¿Partículas u ondas? • Así, cuando la luz incide en algunas superficies metálicas, se produce una corriente de electrones. • A este fenómeno se le conoce con el nombre de efecto fotoeléctrico. Analizador de • Así, algunos metales Luz energía energía electrónica m on (los alcalinos) pueden oc ro emitir electrones si la m át ic luz incidente es visible, a en cambio otros solo emiten electrones con luz ultravioleta. Metal • Es decir, para cada metal hay una frecuencia umbral de la luz, por debajo de la cual no se produce la corriente de electrones. 1/10/08 LA TABLA PERIÓDICA Electrodo colector ánodo Corriente (A) ¿Partículas u ondas? 1/10/08 Radi aci ó n 1/10/08 • De forma similar, la radiación electromagnética, tradicionalmente la hemos percibido simplemente como un fenómeno ondulatorio. • Sin embargo al estudiarla más, tiene asociadas ciertas propiedades que el modelo ondulatorio no puede explicar. • De hecho estas propiedades se pueden asociar al comportamiento de las partículas. • Así, decimos que la radiación electromagnética tiene momento efectivo y que además también está cuantizada en paquetes llamados fotones. Incremento de la intensidad de la radiación radiación Voltaje umbral Voltaje opuesto (V) 1/10/08 Corriente eléctrica eléctrica LA TABLA PERIÓDICA 107 7 ¿Partículas u ondas? ¿Partículas u ondas? – Que el número de electrones emitidos por unidad de tiempo es proporcional a la intensidad de la radiación incidente. – Y que la frecuencia umbral ν0 depende del material Energía eV) Energía cinética máxima (eV) Corriente (A) Frecuencia de la luz incidente Voltaje umbral h = ∆E ∆ν = 4.1 ×10−15eV ⋅ s ∆E = 1.25eV ∆ν = 3 ×1014 Energía Energía cinética máxima – Que la energía de los electrones emitidos es proporcional a la frecuencia de la radiación incidente. La pendiente de los dos metales es la misma y vale h ν0 de A Frecuencia de la radiación radiación (Hz (Hz x 1014) Voltaje opuesto (V) 1/10/08 LA TABLA PERIÓDICA 108 ¿Partículas u ondas? LA TABLA PERIÓDICA Frecuencia de la radiación radiación LA TABLA PERIÓDICA 109 ¿Partículas u ondas? • Este fenómeno, no puede explicarse empleando la teoría electromagnética clásica pues según esta, la energía de los electrones debe variar con la intensidad y además ser independiente de la frecuencia. • En 1905, Albert Einstein, demuestra que se podían resolver estas dificultades si se aplicaban los postulados de Plank a este fenómeno. • Para ello, sugiere que en vez de pensar en la luz incidente como un fenómeno ondulatorio, debe considerarsele como una corriente de corpúsculos a los que llamó fotones. • Cada uno de estos fotones tiene una energía determinada que depende de su frecuencia. 1/10/08 1/10/08 ν0 de B 110 • La cantidad de energía de cada fotón está dada según Einstein por esta expresión: E fotón = h! • Cuando los fotones golpean la superficie metálica estos, pueden ceder su energía a un electrón del metal. El potasio necesita al menos 2.0 eV para que se produzca una corriente • Parte de esta energía la emplea para arrancarlo de la superficie del metal dándole energía cinética. Si la frecuencia es inferior a la umbral, el efecto no se produce. 1/10/08 LA TABLA PERIÓDICA 111 8 ¿Partículas u ondas? ¿Partículas u ondas? • Ahora bien, matemáticamente, ya sea que consideremos que los electrones (o la luz) como partículas o como ondas, depende esencialmente de la observación que pretendemos describir. • Así, algunas veces una representación será más útil que la otra, en tanto que en otras ocurrirá lo opuesto. • Conviene recordar entonces, que cualquiera que sea el modelo matemático empleado, el resultado es una descripción de las propiedades y no de la naturaleza de los electrones o la luz. 1/10/08 LA TABLA PERIÓDICA 112 ¿Partículas u ondas? • Considerando que es posible pesar a los electrones, lo cual es tradicionalmente una propiedad de las partículas. • Resulta muy desconcertante saber que los electrones también pueden hacer cosas (como por ejemplo difractarse) de manera muy similar a la radiación visible o a los Rayos X. • Esta es una propiedad que típicamente se percibe asociada con el comportamiento de las ondas. • Esto desde el punto de vista de la mecánica clásica, es claramente una contradicción. 1/10/08 LA TABLA PERIÓDICA 113 ¿Partículas u ondas? • Esta dualidad partícula-onda de las propiedades de los electrones fue expresada por Louis de Broglie. • De Broglie, postula que la materia posee características de onda y de partícula al mismo tiempo. • Y expresa esta dualidad en una ecuación que ya es muy famosa y se considera que tiene gran profundidad. • En esta la longitud de onda se expresa como una h función de la masa y de != la velocidad de la partícula. • Esto nos sugiere, que las observaciones de comportamiento ondulatorio o de partícula, simplemente se relacionan a diferentes atributos de la materia o de la luz. • Evidentemente, esto es una idea que genera mucha confusión. • Para los humanos, todos los días, la experiencia nos sugiere que las cosas son ya sea partículas o bien ondas, nunca ambas. • ¡Una pelota es una partícula y el sonido es una onda¡ • En la práctica por tanto, la dualidad partículaonda es significativa únicamente para entidades muy, muy pequeñas. 1/10/08 1/10/08 mv LA TABLA PERIÓDICA 114 LA TABLA PERIÓDICA 115 9 ¿Partículas u ondas? ¿Partículas u ondas? • El obstáculo que se nos presenta para entender su naturaleza se debe a que es difícil relacionar nuestra experiencia cotidiana con la luz y la materia, con la aparente naturaleza conflictiva de las partículas que son tan pequeñas. • Así, parece ridículo sugerir que la materia que manipulamos cotidianamente puede tener propiedades ondulatorias, pero no lo es. • El problema descansa en la magnitud de la longitud de onda. • Para cualquier objeto visible, el tamaño de la longitud de onda es tan pequeño que no puede percibirse. 1/10/08 LA TABLA PERIÓDICA 116 ¿Partículas u ondas? • Esto ¡es muy pequeño! 1/10/08 LA TABLA PERIÓDICA 117 • Si en el modelo de Bohr, los electrones dan vueltas alrededor del núcleo en órbitas cuantizadas, el modelo cuántico ya no lo considera así. Orbital electrones núcleo electrones h 6.63 " 10 !34 #= = $ 1.6 " 10 !6 !30 mv 9.10939 " 10 % 45 núcleo Órbita estacionaria Rutherford Bohr Schrödinger • Antes de discutir este modelo, debemos considerar que, las dos de las piezas de información más importantes que debemos conocer acerca de un objeto cualquiera son: – la posición por una parte y – la velocidad (o mas bien el momento) por otra. • Pues resulta que, no es posible determinar con precisión la posición y el momento de un electrón al mismo tiempo. • La cual es una longitud de onda mucho más observable experimentalmente. LA TABLA PERIÓDICA h 6.63 " 10 !34 #= = $ 9.81 " 10 !35 mv 0.15 % 45 De órbitas de Bohr a orbitales de Schrödinger • Por otro lado, un electrón que se moviera a la misma velocidad, pero cuya masa en estado estacionario es de 9.10939 x 10-30 kg tendría una longitud de onda asociada de: 1/10/08 • De esta manera, es posible concluir que longitud de onda efectiva de una partícula es importante únicamente cuando la partícula es muy pero muy pequeña. • Consideremos una pelota de baseball, cuya masa es de 150 g y que se mueve a 160 km/h (45 m/s). • Al sustituir esto en la ecuación de de Broglie: 118 1/10/08 LA TABLA PERIÓDICA 119 10






