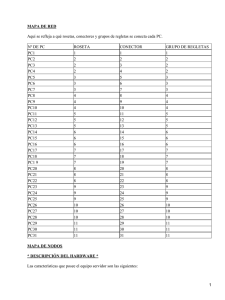
polipeptidos de la malaria.
Anuncio

OFICINA ESPAÑOLA DE PATENTES Y MARCAS 19 C07K 14/445 (2006.01) A61K 38/17 (2006.01) ESPAÑA 12 11 Número de publicación: 2 257 818 51 Int. Cl.: TRADUCCIÓN DE PATENTE EUROPEA T3 86 Número de solicitud europea: 98945703 .1 86 Fecha de presentación : 18.09.1998 87 Número de publicación de la solicitud: 1015483 87 Fecha de publicación de la solicitud: 05.07.2000 54 Título: Polipéptidos de la malaria. 30 Prioridad: 19.09.1997 SE 9703386 73 Titular/es: Mats Wahlgren Ljungvägen 7 182 79 Stocksund, SE Chen Qijun 45 Fecha de publicación de la mención BOPI: 01.08.2006 72 Inventor/es: Wahlgren, Mats; Barragan, Antonio; Carlson, Johan; Qijun, Chen y Fernandez, Victor 45 Fecha de la publicación del folleto de la patente: 74 Agente: Elzaburu Márquez, Alberto ES 2 257 818 T3 01.08.2006 Aviso: En el plazo de nueve meses a contar desde la fecha de publicación en el Boletín europeo de patentes, de la mención de concesión de la patente europea, cualquier persona podrá oponerse ante la Oficina Europea de Patentes a la patente concedida. La oposición deberá formularse por escrito y estar motivada; sólo se considerará como formulada una vez que se haya realizado el pago de la tasa de oposición (art. 99.1 del Convenio sobre concesión de Patentes Europeas). Venta de fascículos: Oficina Española de Patentes y Marcas. Pº de la Castellana, 75 – 28071 Madrid ES 2 257 818 T3 DESCRIPCIÓN Polipéptidos de la malaria. 5 10 Campo técnico La presente invención se refiere a nuevos polipéptidos de la malaria capaces de actuar como ligandos en relación con receptores para antígenos de la malaria presentes en la superficie de eritrocitos infectados por malaria. La invención también abarca el uso de estos polipéptidos como medicamentos y vacunas, y composiciones farmacéuticas que los contienen. Antecedentes y técnica anterior 15 20 25 30 35 40 45 50 55 60 65 A escala mundial, la malaria es una de las enfermedades infecciosas más comunes. Aunque ha sido eliminada en gran medida en América del Norte y Europa, sigue siendo la enfermedad infecciosa más importante en las regiones tropicales y subtropicales del mundo. Según la Organización Mundial de la Salud, OMS, existen aproximadamente 100 millones de casos nuevos cada año, y aproximadamente 300 millones de personas de los países en vías de desarrollo exhiben infecciones crónicas de malaria. La malaria está causada por cuatro especies de Plasmodium, de las cuales Plasmodium vivax y Plasmodium falciparum son las más frecuentemente implicadas en las infecciones humanas. El vector responsable de transmitir la malaria a seres humanos es el mosquito Anopheles y sólo las infecciones de malaria causadas por Plasmodium falciparum pueden ser mortales para seres humanos. Después de la inoculación en el organismo, los esporozoitos de Plasmodium comienzan a reproducirse en el interior de las células del hígado. La multiplicación de los esporozoitos de Plasmodium tiene lugar por esquizogonia, en la que un solo esporozoito es capaz de producir no menos de 40.000 merozoitos. La invasión de los eritrocitos producida por los merozoitos hepáticos inicia la fase eritrocitaria de la malaria, que produce fiebre y otras manifestaciones graves. Los eritrocitos infectados por el parásito de la malaria P. falciparum desaparecen de la circulación periférica a medida que maduran desde la fase de anillo hasta trofozoitos. Este fenómeno se conoce como secuestro y es el resultado de la adherencia de los eritrocitos parasitados a las células del endotelio microvascular y a eritrocitos presentes en diversos órganos. La malaria grave asociada a Plasmodium falciparum se caracteriza por el secuestro excesivo de eritrocitos infectados y no infectados en la microvasculatura del órgano afectado. Por lo tanto, Plasmodium falciparum es un protozoo intracelular, que durante su ciclo de vida en vertebrados invade y se multiplica en hígado y glóbulos rojos. La virulencia del parásito está asociada con la capacidad del eritrocito infectado para adherirse a las células endoteliales y a los eritrocitos, en la denominada formación de rosetas. Esto puede producir un suministro local de oxígeno disminuido y en consecuencia la muerte del hospedador humano (Miller, L.H., F. Good y G. Milon. 1994. Malaria pathogenesis. Science 264, 1878-1883. Pasloske, B.L. y R.J. Howard. 1994. Malaria, the red cell, and the endothelium. Ann. Rev. Med. 45, 283-295, Marsh, K., M. English, J. Crawley y N. Peshu, 1996. The pathogenesis of severe malaria in African children. Ann. Trop. Med. & Parasitol. 90, 395-402). La forma más maligna de la infección es la malaria cerebral, debido a un secuestro masivo de eritrocitos infectados y no infectados en la microvasculatura cerebral. Después de ser transportados desde el interior del parásito, se piensa que los antígenos implicados en la unión de las células se concentran y posteriormente son expuestos en el exterior del eritrocito en excrecencias diminutas (≈ 100 nm de diámetro), densas a los electrones, denominadas protuberancias (Atkinson, C.T. y M. Aikawa, 1990. Ultrastructure of malaria-infected erythrocytes. Blood Cells 16, 351-368). Uno de esos antígenos es la proteína 1 de membrana de eritrocitos procedente de Plasmodium falciparum (PfEMP1), polipéptido de 200 kDa-350 kDa codificado por la familia var de genes de P. falciparum (Howard, R.J., J.W. Barnwell, y V. Kao, 1983. Antigenic variation in Plasmodium knowlesi malaria: identification of the variant antigen of infected erythrocytes. Proc. Nat. Acad. Sci. USA., 80, 41294133, Su, X.-Z, V.M. Heatwole, S.P. Wertheimmer, F. Guinet, J.A. Herrfeldt, D.S. Peterson, J.A. Ravetch y T.E. Wellems. 1995. The large diverse gene family var encodes proteins involved in cytoadherence and antigenic variation of Plasmodium falciparum-infected erytrocytes. Cell 82, 89-100, Baruch, D.I., B.L. Pasloske, H.B. Singh, X. Bi, X.C. Ma, M. Feldman, T.F. Taraschi, y R.J. Howard. 1995. Cloning of P. falciparum gene encoding PfEMP1, a malaria variant antigen and adherence receptor on the surface of parasitized human erythrocytes. Cell 82, 77-87). La característica de variación y alternancia antigénica de la superficie del pRBC ha sido atribuida a los genes var. Incluso aunque hasta 150 de estos genes están albergados en el genoma, se piensa que solamente una PfEMP1 se expresa en un momento dado. PfEMP1 posee características de una molécula de adhesión y se la ha asociado con las propiedades citoadherentes del glóbulo rojo infectado (Smith, J.D., C.E. Chitnis, A.G. Craig, D.J. Roberts D.E. Hudson-Taylor, D.S. Peterson, R. Pinches, C.I. Newbold y L.H. Miller. 1995. Switches in expression of Plasmodium falciparum var genes correlate with changes in antigenic and cytoadherent phenotypes of infected erythrocytes. Cell 82, 101-110, Baruch, D.I., J.A. Gormley, C. Ma, R.J. Howard y B.L. Pasloske. 1996. Plasmodium falciparum erythrocyte membrane protein 1 is a parasitised erythrocyte receptor for adherence to CD36, thrombospondin, and intercellular adhesion molecule 1. Proc. Natl. Acad. Sci. U.S.A. 93, 3497-3502). Por ejemplo, se ha demostrado que la expresión de genes var que codifican PfEMP1 se correlaciona con la capacidad de los pRBC para unirse a receptores del hospedador, que incluyen CD36 e ICAM-1 (Baruch, D.I., J.A. Gormley, C. Ma, R.J. Howard, y B.L. Pasloske. 1996. Plasmodium falciparum erythrocyte membrane protein 1 is a parasitised erythrocyte receptor for adherence to CD36, thrombospondin, 2 ES 2 257 818 T3 5 10 15 and intercellular adhesion molecule 1. Proc. Natl. Acad. Sci. U.S.A. 93, 3497-3502, Gardner, J.P., R.A. Pinches, D.J. Roberts y C.I. Newbold (1996). Variant antigens and endothelial receptor adhesion in Plasmodium falciparum. Proc. Natl. Acad. Sci. U.S.A., 93, 3503-3508). Recientemente Rowe y col. (Rowe, J.A., J.M. Moulds, C.I. Newbold, y L.H. Miller. 1997. P. falciparum rosetting mediated by a parasite-variant erythrocyte membrane protein and complementreceptor 1. Nature 388:292-295) han sugerido un papel para la PfEMP1 en la formación de rosetas. Se ha encontrado que el receptor 1 para el complemento es el receptor del hospedador. Sin embargo, se piensa que no puede ser el único usando en por los parásitos formadores de rosetas. En el documento WO 96/33736, se describe una variante de PfEMP1 por medio de su secuencia. Sin embargo, ésta es solamente una de las diversas variantes posiblemente existentes, todas las cuales son diferentes tanto por sus secuencias funcionales como por sus propiedades de adhesión. Por consiguiente, debido a la compleja naturaleza y/o mecanismo de la variación antigénica de la malaria y a su virulencia, existe todavía una gran demanda de métodos y composiciones que puedan ser útiles en el tratamiento, diagnóstico y prevención de infecciones de malaria. Objetivo de la invención 20 La presente invención satisface la demanda anteriormente descrita proporcionando una nueva proteína de la malaria que actúa como ligando en relación con los receptores de la proteína de membrana de eritrocitos infectados por malaria. Breve descripción de los dibujos Figura 1 describe la identificación de la PfEMP1 formadora de rosetas. 25 Figura 2A-C describe, respectivamente, los mapas de la estructura del cDNA, los clones de secuenciación, la secuencia de aminoácidos deducida y la situación de los motivos de unión a GAG en la PfEMP1 formadora de rosetas procedente de FCR3S1.2. 30 Figura 3 describe la unión de la PfEMP1 formadora de rosetas procedente de FCR3S1.2, a la heparina, según se observa mediante análisis en gel de SDS-PAGE al 10% teñido con Coomassie. Figura 4 describe la disgregación de rosetas naturales preformadas con una cualquiera de las dos proteínas de fusión DBL-1-GST o ATS-GST. 35 Figura 5 describe el efecto de glucosaminoglucanos sobre la formación de rosetas inducida por Plasmodium falciparum. Definiciones 40 La expresión “semejante a glucosaminoglucanos”, según se utiliza en la siguiente divulgación, se refiere a toda molécula o sustancia, que exhibe las mismas propiedades ventajosas o propiedades similares que los glucosaminoglucanos que comprenden unidades repetidas de disacáridos sulfatados o acetilados y que se comentan con más detalle más adelante. 45 Según aquí se utiliza, la expresión “unión esencialmente específica” en el contexto de los carbohidratos según la invención, se interpreta como esa unión específica que es necesaria para influir sobre la formación de rosetas de la proteína de membrana de los eritrocitos infectados por malaria, sin que tenga otro impacto notable en el entorno. 50 55 Los términos “polipéptido”, “péptido” y “proteína” se usan aquí indistintamente para hacer referencia a un polímero de residuos de aminoácidos. Estos términos se refieren a polímeros de aminoácidos, en los que uno o más de los residuos de aminoácido es una análogo químico artificial del correspondiente aminoácido presente en la naturaleza, así como a polímeros de aminoácidos presentes en la naturaleza. Los términos “aislado”, “purificado” o la expresión “biológicamente puro” se refieren a un material que se encuentra sustancialmente o esencialmente libre de componentes que normalmente le acompañan cuando se encuentra en su estado natural. La expresión “fragmento biológicamente activo”, según aquí se utiliza, se refiere a porciones de las proteínas o polipéptidos que poseen una actividad biológica particular, p. ej., una o más actividades encontradas en la nueva variante PfEMP1 de longitud completa según la invención. 60 La expresión “proteína de fusión”, según aquí se utiliza, se refiere de manera general a una proteína compuesta, constituida por dos o más proteínas heterólogas individuales. 65 La expresión “identidad sustancial” o “similitud sustancial” en el contexto de un polipéptido, indica que un polipéptido comprende una secuencia con una identidad de la secuencia de al menos el 70% con respecto a una secuencia de referencia, o preferiblemente con una identidad de la secuencia del 80% o más preferiblemente del 85% con respecto a la secuencia de referencia, o muy preferiblemente con una identidad del 90% a lo largo de una ventana de comparación de aproximadamente 10-20 residuos de aminoácidos. Una indicación de que dos secuencias polipeptídicas son 3 ES 2 257 818 T3 sustancialmente idénticas es que uno de los péptidos es inmunológicamente reactivo con anticuerpos inducidos contra el segundo péptido. Por lo tanto, un polipéptido es sustancialmente idéntico a un segundo polipéptido, por ejemplo, cuando los dos péptidos difieren únicamente en una sustitución conservadora. 5 10 Una “sustitución conservadora”, cuando se está describiendo una proteína, se refiere a un cambio en la composición de aminoácidos de la proteína, que no altera sustancialmente la actividad de la proteína. Por lo tanto, “variaciones modificadas de madera conservadora” de una secuencia de aminoácidos particular, se refiere a sustituciones de aminoácidos de los aminoácidos que no son críticos para la actividad de la proteína, o a sustituciones de aminoácidos por otros aminoácidos que tienen propiedades similares (p. ej., ácidos, básicos, con carga positiva o con carga negativa, polares o no polares, etc.) de manera que las sustituciones de incluso aminoácidos críticos, no alteran sustancialmente la actividad. Tablas de sustituciones conservadoras que proporcionan aminoácidos funcionalmente similares, son muy conocidas en la técnica. (Véase, p. ej., Creighton (1984) Protein, W.H. Freeman and Company). Además, las sustituciones, deleciones o adiciones individuales que alteran, adicionan o delecionan un único aminoácido o un porcentaje pequeño de aminoácidos en una secuencia codificada, son también “variaciones modificadas de manera conservativa”). 15 Una indicación de que dos secuencias de ácido nucleico son sustancialmente idénticas es que el polipéptido que el primer ácido nucleico codifica presenta reacciones inmunológicas cruzadas con el polipéptido codificado por el segundo ácido nucleico. 20 25 30 35 40 45 50 55 60 Otra indicación de que dos secuencias de ácido nucleico son sustancialmente idénticas es que las dos moléculas se hibridan entre sí en condiciones rigurosas, como se comenta con más detalle más adelante. La expresión “ácido nucleico” se refiere a un polímero de desoxirribonucleótidos o de ribonucleótidos en forma monocatenaria o bicatenaria, y salvo que esté de alguna otra manera limitada, abarca análogos conocidos de nucleótidos naturales que son capaces de actuar de una manera similar a la de los nucleótidos presentes en la naturaleza. La expresión “que se hibrida específicamente a”, se refiere a la unión, formación de dúplex o hibridación de exclusivamente una molécula a una secuencia de nucleótidos particular, en condiciones rigurosas cuando esa secuencia está presente en un DNA o un RNA de una mezcla compleja (p. ej., un DNA o un RNA celular total). La expresión “condiciones rigurosas” se refiere a las condiciones en las que una sonda se hibrida con su secuencia diana pero no con otras secuencias. Las condiciones rigurosas son dependientes de la secuencia y serán diferentes en circunstancias diferentes. Las secuencias más largas se hibridan de manera específica a temperaturas más altas. En general las condiciones rigurosas se seleccionan de manera que estén aproximadamente 5ºC por debajo del punto de fusión térmico Tm correspondiente a la secuencia específica, a una fuerza iónica y a un pH definidos. La Tm es la temperatura (en condiciones de fuerza iónica, pH y concentración de ácido nucleico definidas) a la que el 50% de las sondas complementarias a la secuencia diana, se hibridan a la secuencia diana en el equilibrio. (Debido a que las secuencias diana generalmente están presentes en exceso, al valor de Tm, el 50% de las sondas se encuentran ocupadas en el equilibrio. Típicamente, las condiciones rigurosas serán aquellas en las que la concentración de sales es una concentración de ion Na menor que aproximadamente 1,0 M, típicamente una concentración de ion Na (u otras sales) de aproximadamente de 0,01 M a 1,0 M, a pH de 7,0 a 8,3, y la temperatura es de al menos 30ºC en el caso de las sondas cortas (p. ej., de 10 a 50 nucleótidos) y de al menos aproximadamente 60ºC en el caso de las sondas largas (p. ej., mayores que 50 nucleótidos). Las condiciones rigurosas se pueden también alcanzar con la adición de agentes desestabilizantes, tales como la formamida. Según aquí se utiliza, “una sonda de ácido nucleico” se define como un ácido nucleico capaz de unirse a un ácido nucleico diana de secuencia complementaria a través de uno o más tipos de enlaces químicos, normalmente a través de apareamiento de bases complementarias, normalmente a través de formación de puentes de hidrógeno. Según aquí se utiliza, una sonda puede incluir bases naturales (es decir, A, G, C o T) o bases modificadas (7-desazaguanosina, inosina, etc.). Además, las bases de una sonda pueden encontrarse unidas mediante una unión distinta de la del enlace fosfodiéster, siempre y cuando esa unión no interfiera con la hibridación. Así, por ejemplo, las sondas pueden ser ácidos nucleicos peptídicos en los que las bases constituyentes se encuentran unidas mediante enlaces peptídicos en lugar de mediante uniones fosfodiéster. El experto en la técnica entenderá que las sondas pueden unir secuencias diana que carecen de una complementariedad completa con la secuencia de la sonda, dependiendo de la rigurosidad de las condiciones de hibridación. Las sondas están preferiblemente marcadas de manera directa por ejemplo con isótopos, cromóforos, lumíforo, cromógenos, o están marcadas de manera indirecta por ejemplo con biotina, a la que más tarde se puede unir un complejo con estreptavidina. Realizando ensayos con respecto a la presencia o ausencia de la sonda, se puede detectar la presencia o ausencia de la secuencia o subsecuencia seleccionada. Un “marcador” es una composición detectable mediante medios espectroscópicos, fotoquímicos, bioquímicos, inmunoquímicos o químicos. Por ejemplo, marcadores útiles incluyen 32 P, colorantes fluorescentes, reactivos densos a los electrones, enzimas (e.j., como las normalmente utilizadas en un ensayo ELISA), biotina, dioxigenina, o haptenos y proteínas para los que existen disponibles antisueros o anticuerpos monoclonales (p. ej., el péptido de la invención puede hacerse detectable, p. ej., incorporando un marcador radiactivo en el péptido, y puede usarse para detectar anticuerpos específicamente reactivos con el péptido). 65 Una “sonda de ácido nucleico marcada” es una sonda de ácido nucleico que está unida covalentemente, o a través de un fragmento enlazador, o a través de enlaces iónicos, de van der Waals o de hidrógeno, con un marcador, de manera que la presencia de la sonda se puede detectar detectando la presencia del marcador unido a la sonda. 4 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 La expresión “ácido nucleico diana” se refiere a un ácido nucleico (con frecuencia derivado de una muestra biológica), con respecto al que se diseña una sonda de ácido nucleico para que se le hibride específicamente. Lo que se ha de detectar es la presencia o la ausencia del ácido nucleico diana, o lo que se ha de cuantificar es la cantidad del ácido nucleico diana. El ácido nucleico diana tiene una secuencia que es complementaria a la secuencia de ácido nucleico de la sonda correspondiente dirigida a la diana. La expresión ácido nucleico diana se puede referir a la subsecuencia específica de un ácido nucleico de mayor tamaño hacia el que la sonda va dirigida, o se puede referir a la secuencia completa (p. ej., de un gen o de un mRNA) cuyo nivel de expresión se desea detectar. La diferencia en el uso resultará evidente por el contexto. “Se une sustancialmente” hace referencia a la hibridación complementaria entre un ácido nucleico sonda y un ácido nucleico diana, y abarca desapareamientos menores que pueden ser albergados disminuyendo la rigurosidad del medio de hibridación hasta conseguir la detección deseada de la secuencia polinucleotídica diana. Una “subsecuencia” se refiere a una secuencia de ácidos nucleicos o de aminoácidos que comprende una parte de una secuencia más larga de ácidos nucleicos o de aminoácidos (p. ej., un polipéptido), respectivamente. Las expresiones “se une específicamente a una proteína” o “específicamente inmunorreactivo con”, cuando se refieren a un anticuerpo, hacen referencia a una reacción de unión que es determinativa de la presencia de la proteína en presencia de una población heterogénea de proteínas y de otros compuestos biológicos. Por lo tanto, en condiciones de inmunoensayo elegidas, los anticuerpos especificados se unen preferentemente a una proteína particular y no se unen en una cantidad significativa a otras proteínas presentes en la muestra. La unión específica a una proteína en esas condiciones requiere un anticuerpo que se ha seleccionado por su especificidad con respecto a una proteína particular. Por ejemplo, los inmunoensayos ELISA en fase sólida se utilizan de manera rutinaria para seleccionar anticuerpos monoclonales específicamente inmunorreactivos con una proteína particular. Véase Harlow y Lane (1988) Antibodies, A Laboratory Manual, Cold Spring Harbour Publications, Nueva York, en cuanto a una descripción de los formatos de inmunoensayos y de las condiciones que se pueden utilizar para determinar una inmunorrectividad específica. El término “recombinante” cuando se usa con referencia a una célula, o a un ácido nucleico, o a un vector, indica que la célula, o el ácido nucleico, o el vector ha sido modificado mediante la introducción de un ácido nucleico heterólogo o mediante la alteración de un ácido nucleico natural, o que la célula deriva de una célula de este modo modificada. Así, por ejemplo, las células recombinantes expresan genes que no se encuentran en la forma natural (no recombinante) de la célula, o expresan genes naturales que en caso contrario se expresan de manera anormal, se infraexpresan o no se expresan en absoluto. El término “idénticas” en el contexto de dos ácidos nucleicos o de dos secuencias polipeptídicas se refiere a los residuos presentes en las dos secuencias que son el mismo residuo cuando se alinean con respecto a la correspondencia máxima. El alineamiento óptimo de secuencias para su comparación se puede llevar a cabo, p. ej., mediante el algoritmo de homologías locales de Smith y Waterman (1981) Adv. Appl. Math. 2:482, mediante el algoritmo de alineamiento por homologías de Needleman y Wunsch (1970) J. Mol. Biol. 48:443, mediante la búsqueda por el método de similitudes de Pearson y Lipman (1988) Proc. Natl. Acad. Sci. USA 85:2444, mediante aplicaciones para ordenador de estos algoritmos (GAP, GESTFIT, FASTA, and TFASTA in the Wisconsin Genetics Software Package, Genetics Computer Group, 575 Science Dr., Madison, WI), o mediante inspección. Un algoritmo adicional que es adecuado para determinar similitudes en secuencias es el algoritmo BLAST que se encuentra descrito en Altschull y col. (1990) J. Mol. Biol. 215:403-410. Un programa para realizar análisis con BLAST se encuentra públicamente disponible a través del National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov/). Descripción detallada de la presente invención La presente invención se describe a continuación con más detalle. 50 Un carbohidrato, que exhibe al menos un único resto semejante a un glucosaminoglucano con carga negativa y que por medio de él es capaz de establecer una unión esencialmente específica con una proteína de membrana de eritrocitos infectados por malaria o con uno de sus análogos, se puede usar como receptor para unir ligandos, que se expresan en la superficie de células infectadas por malaria, tales como eritrocitos infectados por Plasmodium falciparum. Preferiblemente, dicho resto de glucosaminoglucano está sulfatado y más concretamente, puede ser un resto de sulfato de heparán. Muy preferiblemente, el carbohidrato es fucoidán, o uno de sus fragmentos funcionales. 55 60 65 En la técnica anterior se ha mostrado que las rosetas originadas por P. falciparum se pueden disgregar con concentraciones bajas de heparina, efecto que es inmediato y reversible (Carlson, J., H.P. Ekre, H. Helmby, J. Gysin, B.M. Greenwood y M. Wahlgren. 1992. Disruption of Plasmodium falciparum erythrocyte rosettes by standard heparin and by heparin devoid of anticoagulant activity. Am. J. Trop. Med. Hyg. 46, 595-602, Rowe, A., A.R. Berendt, K. Marsh y C.I. Newbold. 1994. Plasmodium falciparum: a family of sulfated glycoconjugates disrupts erytrocyte rosettes. Exp. Parasitol. 79, 506-516). Sin embargo, con anterioridad a la presenta invención, no ha sido posible explicar los mecanismos o bases de este fenómeno y, por consiguiente, no ha sido posible hasta la fecha crear alguno de estos receptores ventajosos y útiles como el presente carbohidrato receptor. Los glucosaminoglucanos, o GAG, que son el carbohidrato receptor, se componen de unidades repetidas de disacáridos sulfatados o acetilados y se encuentran en el cuerpo humano unidos a una región central proteica en forma de proteoglucanos (PG) (Yanagisha, M. y V. Hascall. 1992. Cell surface heparan sulfate protoeglycans. J. Biol. Chem. 267, 9451-9454). El sulfato de heparán y el sulfato de condroitina son GAG expuestos en todas las superficies de 5 ES 2 257 818 T3 5 10 15 20 25 30 35 células humanas, pero los GAG son diversos y varían de una célula a otra y pueden variar dentro de la misma célula debido a modificaciones secundarias de las largas cadenas de los carbohidratos (desacetilaciones, O-sulfataciones, etc.). La heparina se encuentra únicamente en los mastocitos y se caracteriza por un grado más alto de sulfatación y de epimerización que el sulfato de heparán. No obstante, el sulfato de heparán y la heparina son similares debido a regiones parecidas a la heparina, también encontradas en el sulfato de heparán (Faham, S., E.R. Hileman, R.J. Fromm, J.R. Lindart y C.D. Rees. 1996. Heparin structures and interactions with basic fibroblast growth factor. Science, 271, 1116-1120). El HS y la heparina, ambos miembros de la heterogénea familia de los GAG, están compuestos por residuos alternos de glucosamina y ácido urónico. La glucosamina puede estar N-sulfatada o N-acetilada y puede contener un éster O-sulfato en posición C-6. El ácido urónico existe en forma del epímero ácido glucurónico o del epímero ácido idurónico y puede estar O-sulfatado en posición C-2. A diferencia de las cadenas de heparina que están extensamente sulfatadas, las cadenas de HS están menos extensamente modificadas y los grupos sulfato están distribuidos de manera desigual a lo largo de las cadenas debido al estado incompleto de modificación en cada una de las etapas de la biosíntesis de HS (Lindahl y col. 1994). Por consiguiente, el HS y la heparina son similares debido a las regiones altamente sulfatadas, parecidas a la heparina, encontradas en el HS. En general, la microheterogeneidad existente dentro de la estructura de los GAG modula sus actividades de unión y sus actividades biológicas (Casu, 1991). Sus propiedades de unión suelen estar asociadas con sus grupos sulfatos y carboxilo aniónicos. El incremento en la densidad de carga y en el peso molecular a veces está asociado con la unión a una proteína más fuerte, pero esto no es una regla estricta (Ruoslahti, 1989). Por lo tanto, se puede conseguir un aumento general de las propiedades de unión con una sobresulfatación química (Casu, 1991). La mayoría de los GAG expresan sus propiedades biológicas a través de interacciones con componentes del plasma y de tejidos (Jackson y col., 1991; Kjellén y col. 1991) y su distribución ubicua en las superficies celulares los hacen muy adecuados para la unión a microorganismos. El carbohidrato receptor, o su equivalente funcional anteriormente mencionado, es más específicamente capaz de una unión esencialmente específica a al menos uno de los segmentos indicados como sitios de unión de la secuencia de aminoácidos según SEQ ID NO: 1, en la que se expone una nueva variante de la proteína de membrana de eritrocitos, procedente de Plasmodium falciparum, (PfEMP1). Aunque esto se trata de manera más completa en otro lugar de esta solicitud, especialmente en relación con el polipéptido ligando posteriormente mencionado, se debe saber que dichos segmentos de unión son secuencias que, según la presente invención, se ha encontrado que se unen de manera específica y con fuerza a restos semejantes a glucosaminoglucanos sobre sustancias receptoras, tales como las presentes en la mayoría de las células, o el presente polipéptido. De esta manera el carbohidrato receptor es capaz de unirse a una parte terminal amino, y preferiblemente a una parte esencial, de los segmentos de unión indicados en SEQ ID NO: 1. Por consiguiente, la proteína descrita es SEQ ID NO: 1 puede ser considerada como un ligando, mientras que el carbohidrato definido según lo que antecede, puede ser considerado como su receptor. Muy preferiblemente, el receptor se une a una parte esencial de dicha secuencia o de cualquier secuencia que tenga una identidad o similitud sustancial con SEQ ID NO: 1. 40 La presente invención se refiere a un polipéptido, que es capaz de actuar como ligando en relación con el carbohidrato receptor anteriormente descrito. Dicho polipéptido ligando se origina a partir de una proteína de membrana de eritrocitos infectados por malaria y puede ser designada como una variante nueva de PfEMP1. 45 50 55 60 65 Por lo tanto, mediante una RT-PCR de células aisladas, el autor de la presente invención ha identificado una nueva variante de PfEMP1 de un parásito formador de rosetas. En la secuencia se han identificado grupos de motivos de unión a GAG, indicados como sitios de unión en el listado de secuencias que se proporciona más adelante. Además, se ha mostrado que la forma recombinante de la nueva variante de PfEMP1, o polipéptido ligando, según la invención, se adhiere a heparina en fase sólida, a sulfato de heparán en la superficie de eritrocitos y disgrega las rosetas. Además, las rosetas formadas de manera natural también parecen estar mediadas por uniones al mismo GAG. La invención se refiere de manera específica a un polipéptido aislado que se origina a partir de una proteína de membrana de eritrocitos infectados por malaria, que comprende 400-500 aminoácidos de la parte amino terminal de la secuencia según SEQ ID NO: 1. Además, el polipéptido según la invención es capaz de establecer una unión esencialmente específica con un resto semejante a un glucosaminoglucano de carga negativa. En la realización preferida de la invención, el polipéptido según la invención es capaz de unirse a cualquiera de los carbohidratos receptores descritos en lo que antecede. En SEQ ID NO: 1 se muestra la secuencia de aminoácidos completa de PfEMP1 procedente de FCR3S1.1. La situación de los motivos de unión a GAG potenciales se muestran en color rosa. Los motivos n.os 4, 5 y 9, 10 (aminoácidos 221-232 y 533-549 respectivamente) se observan en forma de una región única debido a que están situados uno al lado del otro (véase la sección de métodos para la descripción de la identificación de los motivos de unión a GAG). Estos datos de secuencias se encuentran disponibles procedentes de GenBank con el número de registro AF003473. Otro aspecto de la invención es un método para preparar un polipéptido ligando según aquí se ha definido, que comprende las etapas de: (1) insertar en un vector de expresión un ácido nucleico que codifica dicho polipéptido; 6 ES 2 257 818 T3 (2) transfectar una célula hospedadora capaz de expresar dicho ácido nucleico, con dicho vector de expresión, para expresar dicho polipéptido; y 5 (3) recuperar dicho polipéptido expresado. De manera ventajosa, el polipéptido se purifica hasta una forma biológicamente pura. Los vectores, de expresión, las células hospedadoras, los parámetros del procedimiento, etc. son de fácil elección por una persona con experiencia en este área. 10 15 20 25 30 35 40 45 50 55 En una de las realizaciones particulares de la invención, el polipéptido se puede clonar usando métodos de amplificación de DNA, tales como el método de la reacción en cadena de la polimerasa (PCR) (véanse p. ej. Sambrook y col. Molecular Cloning: A Laboratory Manual, 2ª ed., Cold Spring Harbour, NY, 1989; Berger y Kimmel, Methods in Enzymology. Vol. 152: Guide to Molecular Cloning Techniques, Academic Press, Inc., San Diego, California, 1987; Co y col. (1992) J. Immunol. 148:1149). Así, por ejemplo, la secuencia de ácido nucleico, que se describirá posteriormente con más detalle, o una subsecuencia, se amplifica por PCR usando un cebador con sentido que contiene un sitio de restricción, y un cebador antisentido que contiene otro sitio de restricción. Esto producirá un ácido nucleico que codifica la secuencia o subsecuencia deseada y que contiene sitios de restricción terminales. Este ácido nucleico se puede luego ligar fácilmente dentro de un vector que contiene los sitios de restricción apropiados correspondientes. Los cebadores de PCR adecuados son fáciles de escoger por una persona con experiencia en la técnica sobre la base de la secuencia que ha de ser expresada. También se pueden adicionar sitios de restricción apropiados mediante mutagénesis dirigida a un sitio específico (véanse Gillman y Smith (1979) Gene, 8:81-97; Roberts y col. (1987) Nature 328:731-734). Los ácidos nucleicos según la invención, que se describen posteriormente con más detalle, pueden ser expresados en diversas células hospedadoras, que incluyen E. coli, otros hospedadores bacterianos, levaduras y diversas células eucariotas superiores, tales como las líneas de células COS, CHO y HeLa y líneas celulares de melanoma. El gen de la proteína recombinante estará operativamente unido a secuencias de control de la expresión apropiadas de cada uno de los hospedadores. En el caso de E. coli, estas secuencias incluyen un promotor, tal como los promotores de T7, trp, o lambda, un sitio de unión a ribosomas y preferiblemente una señal de terminación de la transcripción. En el caso de células eucariotas, las secuencias de control incluirán un promotor y preferiblemente una secuencia estimuladora de la transcripción derivada de genes de inmunoglobulinas, de SV40, citomegalovirus, etc., y una secuencia de poliadenilación, y pueden incluir secuencias dadoras y aceptoras de corte y empalme. Los plásmidos se pueden transferir a la célula hospedadora elegida mediante métodos muy conocidos, tales como la transformación con cloruro de calcio en el caso de E. coli, y el tratamiento con fosfato cálcico o la electroporación en el caso de células de mamífero. Las células transformadas con los plásmidos se pueden seleccionar mediante una resistencia a antibióticos conferida por genes contenidos en los plásmidos, tales como los genes amp, gpt, neo y hyg. Una vez expresados, los polipéptidos recombinantes según la invención, se pueden purificar conforme a procedimientos estándar de la técnica, que incluyen precipitación con sulfato amónico, columnas de afinidad, cromatografía en columna, electroforesis en gel y procedimientos similares (véanse en general R. Scopes, Protein Purification, Springer-Verlag, N.Y. (1982), Deutcher, Methods in Enzymology, vol. 182: Guide to Protein Purification, Academic Press Inc., N.Y. (1990)). Se prefieren las composiciones sustancialmente puras, con una homogeneidad como de al menos aproximadamente 90%-95%, y son muy preferidas las composiciones con una homogeneidad del 98%-99%. Una vez purificados, parcialmente o hasta alcanzar la homogeneidad según convenga, los polipéptidos según la invención se pueden usar, p. ej., como inmunógenos para la producción de anticuerpos. Como reconocería toda persona experta en este campo, después de una síntesis química, expresión biológica o purificación, las proteínas, polipéptidos o proteínas de fusión según la presente invención pueden tener una conformación sustancialmente diferente de las conformaciones naturales de los polipéptidos constituyentes. En este caso, puede ser necesario desnaturalizar y reducir el polipéptido y después hacer que el polipéptido se repliegue en la conformación preferida. Los métodos para reducir y desnaturalizar proteínas y para inducir el replegado son muy conocidos por los expertos en la técnica (véanse p. ej. Debinski y col. (1993) J. Biol. Chem. 268:14065-14070; Kreitman y Pastan (1993) Bioconj. Chem., 4:581-585; y Buchner y col. Anal. Biochem., 205:263-270). El experto reconocerá que se pueden hacer modificaciones en los polipéptidos y proteínas en cuestión sin disminuir sus actividades biológicas, p. ej. con el fin de facilitar la clonación, la expresión o la incorporación de la molécula diana en una proteína de fusión. Esas modificaciones son muy conocidas y todos los péptidos y proteínas así modificados se entiende que se encuentran abarcados dentro del alcance de la presente invención según se define en las reivindicaciones adjuntas. 60 65 Según se ha indicado en lo que antecede, la presente invención también se refiere a ácidos nucleicos que codifican los polipéptidos según la invención. Los ácidos nucleicos según la invención incluyen por lo tanto, pero no se limitan a ellos, DNA, RNA, un mRNA transcrito, un cDNA transcrito por transcripción inversa a partir de un mRNA y un RNA transcrito a partir de ese cDNA, un DNA amplificado a partir de ese cDNA, un RNA transcrito a partir de ese DNA amplificado, o subsecuencias de cualquiera de estos ácidos nucleicos, y se pueden preparar mediante cualquiera de los métodos adecuados, que es de fácil elección por una persona experta en este campo. Estos métodos incluyen, por ejemplo, la clonación y la restricción de secuencias apropiadas o la síntesis química directa con métodos tales como el método del fosfotriéster (Narang y col., Meth. Enzymol. 68:90-99 (1979)); el método del fosfodiéster (Brown y col., 7 ES 2 257 818 T3 Meth. Enzymol. 68:109-151 (1979)); el método de la dietilfosforamidita (Beaucage y col., Tetra. Lett., 22:1859-1862 (1981)); y el método en soporte sólido (Patente de EE.UU. Núm. 4.458.066). 5 10 15 20 25 30 35 40 45 50 55 60 65 La síntesis química produce un oligonucleótido monocatenario. Éste se puede convertir en un DNA bicatenario por hibridación con una secuencia complementaria o por polimerización con una DNA-polimerasa usando la cadena sencilla como molde. La secuencia de DNA obtenida mediante síntesis química está limitada en longitud por la técnica usada, aunque sin embargo, secuencias más largas se obtiene fácilmente mediante la ligación de esas secuencias cortas hasta alcanzar la longitud deseada. Como alternativa, se pueden clonar subsecuencias y las subsecuencias adecuadas se pueden escindir usando enzimas de restricción adecuadas. Los fragmentos se pueden luego ligar para producir secuencias de DNA del tamaño deseado. Un ácido nucleico según la invención se puede usar p. ej., en el método anteriormente mencionado para preparar un polipéptido, tal como una sonda, etc. Para su uso como sonda, suele ser aconsejable marcar la secuencia con un marcador detectable. El marcador se puede incorporar durante la etapa de amplificación en la preparación del ácido nucleico, p. ej. mediante PCR, mediante amplificación y transcripción usando un nucleótido marcado que incorpora un marcador en el ácido nucleico transcrito o, de manera alternativa, mediante su adición directa, como por ejemplo, mediante traslado de la mella o cualquier otro método adecuado. Los marcadores detectables adecuados para usar según la presente invención incluyen cualquier composición detectable por medios espectroscópicos, fotoquímicos, bioquímicos, inmunológicos, inmunoquímicos, eléctricos, ópticos o químicos, y los métodos de detección de marcadores son muy conocidos por los expertos en la técnica. En un aspecto alternativo de la invención, el polipéptido se produce en forma de una proteína de fusión recombinante, que comprende dicho polipéptido, y que comprende restos semejantes a glucosaminoglucanos adecuados, fusionados a otra proteína o polipéptido. Esa proteína de fusión que comprende el polipéptido puede tener más ventajas para determinadas aplicaciones que el polipéptido per se. En una realización preferida de la invención, las proteínas de fusión se sintetizan utilizando la metodología de ácidos nucleicos recombinantes. De manera general, esta metodología implica crear un ácido nucleico que codifica la molécula de fusión dirigida a un receptor, situando el ácido nucleico en una casete de expresión bajo control de un promotor adecuado, expresar la proteína en un hospedador, aislar la proteína expresada y, si se requiere, renaturalizar la proteína. Las técnicas suficientes para guiar a un experto a través de estos procedimientos, se encuentran p. ej., en Sambrook y col. Molecular Cloning: A Laboratory Manual, 2ª ed., vol. 1-3, Cold Spring Harbour, 1989; Berger y Kimmel, Guide to Molecular Cloning Techniques, Methods in Enzymology. Vol. 152, Academic Press, Inc., San Diego, California; y en Current Protocols in Molecular Biology, F.M. Ausubel y col., redactores, Current Protocols (Green Publishing Associates, Inc., y John Wiley & Sons, Inc.) (Suplemento de 1994). Como alternativa, la proteína de fusión se produce por cualquiera de los métodos de síntesis química muy conocidos en la técnica. Así, una proteína de fusión según la invención puede comprender un polipéptido, anticuerpo o sus fragmentos biológicamente activos, según la presente invención. Sobre los efectos de ejemplos de proteínas de fusión sobre la formación de rosetas p. ej. se trata en la sección Parte Experimental de esta memoria descriptiva, véase p. ej., la Fig. 4. La presente invención también se refiere a un polipéptido según la invención para usar como medicamento así como su uso en la fabricación de un medicamento. Ese medicamento es eficaz porque es capaz de disolver eficazmente las rosetas formadas por los eritrocitos infectados por un parásito de la malaria, según se describe con más detalle en la sección introductoria de esta solicitud. Por lo tanto, un medicamento que comprende el polipéptido según la invención, per se o en forma de una proteína de fusión, será eficaz para en la disolución y prevención de la oclusión de vasos sanguíneos, especialmente en la malaria cerebral. Además, se ha demostrado también que las rosetas anteriormente descritas están asociadas con otras complicaciones graves de la malaria (Carlson, J., y col. Lancet 336, 14571460 (1990); Treutiger y col., Am. J. Trop. Med. Hyg. 46, 503-510 (1992); y Rowe, A. y col., Inf. Immun. 63, 23232326 (1995)). Por lo tanto, un medicamento que comprende un polipéptido según la invención es también eficaz en el tratamiento de estas otras enfermedades. Por consiguiente, la invención también abarca el uso de dicho polipéptido en la fabricación de un medicamento contra la malaria, preferiblemente, contra la malaria producida por P. faciparum, y/o contra otras complicaciones graves de la malaria. En consecuencia, en un aspecto más, la invención se refiere a una preparación farmacéutica que comprende dicho polipéptido o dicha proteína de fusión en un vehículo farmacéuticamente aceptable o aceptable en veterinaria, p. ej. un vehículo acuoso, tal como disolución salina tamponada o un vehículo similar. Estas disoluciones están estériles y generalmente se encuentran libres de materiales no deseables. Estas disoluciones se pueden esterilizar mediante técnicas de esterilización convencionales muy conocidas. Las preparaciones farmacéuticas según la invención se pueden usar en cualquiera de los métodos de administración adecuados, tales como en administración parenteral, tópica, oral o incluso local, para un tratamiento profiláctico y/o terapéutico, y se pueden administrar en diversas formas de dosificaciones unitarias dependiendo del método de administración elegido. Además, las composiciones farmacéuticas según la invención pueden comprender cualquiera de las sustancias auxiliares farmacéuticamente aceptables requeridas para una aproximación a las condiciones fisiológicas, tales como agentes de tamponamiento y ajustadores del pH, agentes ajustadores de la toxicidad y agentes similares, por ejemplo acetato sódico, cloruro sódico, cloruro potásico, cloruro cálcico, lactato sódico, etc. Los métodos existentes para preparar las composiciones administrables apropiadas serán conocidas por los expertos en este campo o resultarán evidentes para ellos, y se encuentran descritos con más detalle en p. ej, Remington Pharmaceutical Science, 15ª edición, Mack Publishing Company, Easton, Pennsylvania (1980) (Para una revisión corta sobre métodos de suministro de fármacos, véase Langer, Science 249:1527-1533, 1990)). 8 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 Se sobreentiende que en el presente contexto, el termino “prevenir” se refiere a la prevención de una enfermedad, como la malaria, o de sus síntomas, mediante el uso de un medicamento, así como a la prevención mediante el uso de una composición vacunal. Por lo tanto, la presente invención abarca tratamientos preventivos o profilácticos y los medicamentos usados en ellos, tratamientos que incluirán fármacos que participan de manera activa en la prevención de una enfermedad particular, tal como la malaria, o de sus síntomas. Además, la invención también abarca tratamientos que inducen una respuesta preventiva en un paciente, tal como una respuesta inmunológica en el caso de una vacuna. Por consiguiente, “un medicamento para la prevención de la malaria” también incluye composiciones vacunales. El método comprende administrar a dicho paciente una cantidad eficaz de la composición farmacéutica que aquí se describe, dependiendo dicha cantidad de la gravedad de la enfermedad y del estado general de salud del paciente. Preferiblemente, la infección de malaria tratada con el método según la invención, es una infección producida por P. falciparum. En la realización preferida, las composiciones vacunales según la invención incluirán una molécula según la invención, tal como un polipéptido, en una cantidad inmunológicamente efectiva junto con un vehículo adecuado y farmacéuticamente aceptable. En este contexto, son ejemplos de vehículos adecuados p. ej. la tiroglobulina, albúminas tales como la albúmina sérica humana, el toxoide tetánico, poliaminoácidos tales como poli(D-lisina; D-ácido glutámico), la proteína del núcleo central del virus de la gripe y del virus de la hepatitis B así como otros vehículos muy conocidos por los expertos en la técnica. Las vacunas también pueden incluir un diluyente fisiológicamente tolerable, tal como agua, agua tamponada, disolución salina tamponada, disolución salina, y además pueden incluir también cualquier adyuvante adecuado, tal como el adyuvante incompleto de Freund, fosfato de aluminio, hidróxido de aluminio, alumbre, hidróxido de amonio en el caso de pacientes humanos, etc. La respuesta inmunitaria del paciente puede incluir la generación de anticuerpos, la activación de linfocitos T citotóxicos frente a las células que expresan los polipéptidos u otros mecanismos conocidos en este campo. (Véanse p. ej. Paul, Fundamental Immunology, 2ª edición, Raven Press; Sedagh y col., Proc. Natl. Acad Sci. (1994) 91:9866-9867; Patente de EE.UU. Núm. 4.722.848; y Langford, C.L. y col., 1986, Mol. Cell. Biol. 6:3101-3199). Otro aspecto muy interesante y altamente provechoso de la presente invención es el uso del polipéptido definido en lo que antecede, para identificar sustancias que se unen a una proteína de membrana de eritrocitos infectados por malaria, tal como la nueva variante descrita en SEQ ID NO: 1 o sus análogos. De esa manera, se pueden aislar nuevas sustancias de receptores, eficaces en el tratamiento y/o en la prevención de infecciones de malaria, a partir de entornos adecuados o de masas que las comprenden. En otro aspecto, la invención se refiere a ensayos de diagnóstico y de escrutinio, en los que p. ej. los polipéptidos según la invención se usan para la detección de anticuerpos, o en los que anticuerpos como los descritos más adelante se usan para detectar PfEMP1 o sus fragmentos. Además, se pueden detectar ácido nucleicos en muestras biológicas. (Para una revisión sobre procedimientos de inmunoensayos para diagnóstico, véase p. ej. Basic and Clinical Immunology, 7ª edición, Stites, D., y Terr, A. 1991). De manera ventajosa, los polipéptidos según la invención se marcan uniéndoles, covalentemente o no covalentemente, una sustancia que proporciona una señal detectable. Se conocen una amplia variedad de marcadores y de técnicas de conjugación y se han publicado extensamente tanto en la literatura científica como en la de patentes. Véanse por ejemplo patentes que instruyen sobre el uso de estos marcadores, que incluyen las Patentes de EE.UU. Núms: 3.817.837; 3.850.752; 3.939.350; 3.996.345; 4.277.437; 4.275.149; y 4.366.241. Una persona experta en este campo se dará cuenta fácilmente de que los carbohidratos receptores, y el polipéptido ligando según la invención, son también útiles para una amplia variedad de fines diagnósticos, como por ejemplo en inmunoensayos. Los métodos, el resto de reactivos, cantidades, etc. son fáciles de determinar por alguien experto en el área, sobre la base de la información proporcionada en esta solicitud (en relación con inmunoensayos, véase p. ej. Harlow y Lane). 50 Descripción detallada de los dibujos Además de la descripción dada en esta sección, los dibujos serán comentados también más adelante en el apartado de “Resultados”. 55 Figura 1. Identificación de la PfEMP1 formadora de rosetas. 60 La Figura 1A. Un eritrocito aislado infectado por P. falciparum, formando rosetas, se observa por microscopia óptica soportado por una micropipeta de 5 µm (A,1). Los eritrocitos no infectados se separan de la célula infectada y un examen detenido confirma que ésta está efectivamente infectada por un único parásito (A,2-3). La Figura 1B muestra la amplificación de una banda de 434 pb en 4 (en la reacción 3, 4, 5 y 7) de 8 eritrocitos formadores de roseta e infectados por un único parásito, usando cebadores degenerados generados a partir de la secuencia principal del dominio DBL-1 de PfEMP1. 65 La Figura 1C muestra el patrón de amplificación usando los mismos cebadores que en B, de cultivos heterogéneos de cultivos de FCR3S1.2 formador de rosetas (R+ ) y de los parásitos FCR3s/a R− . Nótese que el producto de 434 pb se observa solamente con los parásitos R+ . 9 ES 2 257 818 T3 La Figura 1D muestra el patrón de hibridación en una transferencia Northern de la secuencia de 434 pb con un mRNA extraído del parásito FCR2S1.2 de alta tasa de formación de rosetas (R+ 84%) y la débil hibridación con el parásito FCR3S/a R− (R+ 9%). 5 10 15 20 25 La Figura 1E muestra la autorradiografía de un extracto de eritrocitos infectados por FCR3S1.2, insoluble en Tritón X-100 y soluble en SDS, después de un marcaje con yodo radiactivo. PfEMP1 (señalada con una flecha) está marcada en los eritrocitos infectados por FCR3S1.2 y es escindida con concentraciones bajas de tripsina. Figura 2. Mapa de la estructura de cDNA, clones de secuenciación, secuencia de aminoácidos deducida y situación de motivos de unión a GAG en la PfEMP1 formadora de rosetas procedente de FCR3S1.2. A muestra la situación del fragmento de 434 pb y los tres fragmentos (I, II y III) que fueron inicialmente clonados para la secuenciación. Los sitios de digestión con enzimas de restricción aparecen indicados con flechas. En la parte inferior se muestran clones adicionales solapantes, usados en la secuenciación. B muestra la estructura primaria de la PfEMP1 formadora de rosetas, procedente de FCR3S1.2. PfEMP1 presenta dos dominios semejantes al dominio de unión Duffy (DBL) (del inglés, “Duffy Binding-Like domain”) (DBL-1 y DBL-4), una región interdominios rica en cisteína (CIDR), una región transmembrana (TM) y un segmento C-terminal ácido (ATS). C muestra la distribución de aminoácidos en diferentes regiones de la PfEMP1 procedente de FCR3S1.2. Figura 3. La PfEMP1 formadora de rosetas procedente de FCR3S1.2 se une a sulfato de heparán. Todos los geles son SDS-PAGE al 10% teñidos con Coomassie. A muestra las proteínas GST, DBL-1-GST o ATS-GST después de la purificación sobre Sepharose-glutation y SDS-PAGE. B muestra la capacidad de unión de diferentes proteínas de fusión a Sepharose-heparina después de una SDS-PAGE. C muestra la inhibición producida por diferentes glucosaminoglucanos sobre la unión de DBL-1-GST a Sepharose-heparina seguida de una SDS-PAGE. D y E muestran la unión de DBL-1-GST (D) y de AST-GST (E) a monocapas de RBC normales, visualizada con un mAb contra GST, marcado con biotina y FITC-avidina. Figura 4. Disgregación de rosetas naturales preformadas, con DBL-1-GST o con ATS-GST. Los resultados son las medias y los errores estándar de tres experimentos. 30 35 Figura 5. Efecto de glucosaminoglucanos (GAG) sobre la formación de rosetas producida por P. falciparum. A muestra la disgregación de las rosetas ejercida por diferentes GAG. Los cultivos de FCR3S1.2 se incubaron con los GAG durante 1 h a 37ºC y se compararon con un cultivo de control. Los resultados son las medias y los errores estándar de tres experimentos independientes. B muestra el efecto del tratamiento enzimático de eritrocitos no infectados, marcados con C-FDA, en un ensayo competitivo de reformación de las rosetas en presencia de eritrocitos normales y de pRBC infectados por FCR3S1.2. Los resultados son las medias y los errores estándar de tres experimentos independientes; de dos experimentos en el caso de la neuraminidasa. Parte experimental 40 Los siguientes ejemplos tienen únicamente intención de ilustrar la presente invención y no de limitar el alcance de la invención según ésta se define en las reivindicaciones adjuntas. A lo largo de la presente solicitud, se utilizan las siguientes abreviaturas: PfEMP1, proteína 1 de membrana de eritrocitos procedente de Plasmodium falciparum; DBL, semejante al dominio de unión Duffy; GST, glutation-S-transferasa; GAG, glucosaminoglucano; pRBC, RBC parasitado; ICAM-1, molécula 1 de adhesión intercelular; TM, transmembrana. 45 Ejemplo 1 Materiales y métodos 50 55 60 65 Parásitos Los parásitos P. falciparum se cultivaron conforme a métodos estándar con un suero AB+ Rh+ al 10% añadido al medio tamponado (RPMI suplementado con Hepes, gentamicina y bicarbonato sódico). El FCR3S1.2 se clonó con micromanipulación a partir del parásito FCR3 previamente clonado por dilución límite (Udomsangpetch, R., B, Wåhlin, J. Carlson, K. Berzins, M. Torii, M. Aikawa, P. Perlmann, y M. Wahlgren. 1989. Plasmodium falciparum infected erythrocytes form spontaneous erythrocyte rosettes. J. Exp. Med. 169, 1835-1840). Su tasa de formación de rosetas fue habitualmente >80% (R+ ). FCR3S/a se enriqueció negativamente con respecto a una baja tasa de formación de rosetas a partir FCR3 usando Ficoll-isopaque (<10%, R− ). Debe advertirse que a FCR3S se le había denominado previamente Palo Alto (Uganda) en publicaciones de los autores de la invención (Carlson, J., H.P. Ekre, H. Helmby, J. Gysin, B.M. Greenwood y M. Wahlgren. 1992. Disruption of Plasmodium falciparum erythrocyte rosettes by standard heparin and heparin devoid of anticoagulant activity. Am. J. Trop. Hyg. 46, 595-602, Udomsangpetch, R., B, Wåhlin, J. Carlson, K. Berzins, M. Torii, M. Aikawa, P. Perlmann, y M. Wahlgren. 1989. Plasmodium falciparum-infected erythrocytes form spontaneous erythrocyte rosettes. J. Exp. Med. 169, 1835-1840, Scholander, C., C.J. Treutiger, K. Hultenby y M. Wahlgren. 1990. Novel fibrillar structure confers adhesive property to malaria infected erythrocytes. Nature Med. 2, 204-208, Carlson J. y M. Wahlgren, 1992. Plasmodium falciparum erythrocytes rosetting is mediated by promiscuous lectin-like interactions. J. Exp. Med. 176, 1311-1317, Carlson J., G. Holquist, D.W. Taylor, P. Perlmann y M. Wahlgren. 1990. Antibodies to a histidine rich protein (PfHRP1) disrupts spontaneously formed Plasmodium falciparum erythrocyte rosettes. Proc. Natl. Acad. Sci. U.S.A. 87, 2511-2515, Helmby, H., L. Cavelier, U. 10 ES 2 257 818 T3 5 Petterson y M. Wahlgren. 1993. Rosetting Plasmodium falciparum-infected erythrocytes express unique antigens on their surface. Infect. Immun. 61, 284-288). Estudios moleculares de los parásitos “Palo Alto” han revelado, sin embargo, que son idénticos a los parásitos del linaje FCR3 (Fandeur, T., S., O. Bonnefoy, Mercerau-Puijalon. 1991. In vivo and in vitro derived Palo Alto lines of Plasmodium falciparum are genetically unrelated. Mol. Biochem. Parasitol. 47, 167-178). Optimización de una RT-PCR de P. falciparum aislado 10 15 20 25 30 Dos cebadores degenerados (DBL-1.1, 5’-GG(A/T) GC (A/T) TG(TC) GC(A/T) CC(AT) T(A/T)(T/C)(A/C)G3’; DBL-1.2, 5’-A(A/G)(A/G) TA(T/C) TG(T/A) GG(A/T) AC(A/G) TA(A/G) TC-3’, que mapean en la región conservada de todas las DBL-1 de PfEMP1, se modificaron a partir de las secuencias de Su y col. Los parámetros de la amplificación se optimizaron primero de manera que los productos amplificados fueran visibles con una tinción normal con bromuro de etidio (EB) (Cobb, B.D. y J.M. Clarckson, 1994. A simple procedure for optimising the polymerase chain reaction (PCR) using modified Taguchi methods. Nucl. Acid. Res. 22, 3801-3805). Brevemente expuesto, de uno a cinco parásitos, obtenidos por dilución límite, fueron directamente introducidos en el tampón de RT-PCR (Stratagene) con una concentración diferente de los cebadores, MgCl2 , KCl y Tris-HCl. Tanto el DNA como el RNA se separaron de los parásitos calentando a 93ºC durante 3 min. El DNA fue degradado mediante adición de 10 U de DNasa (Stratagene). La transcripción inversa se llevó a cabo inmediatamente después de la adición de los cebadores aleatorios y de la transcriptasa inversa (Perkin-Elmer). La reacción de PCR se realizó posteriormente en el mismo tubo. Por comparación de la eficiencia de la amplificación entre diferentes reacciones, se encontró que los parámetros optimizados para la RT-PCR de células aisladas fueron los siguientes: Tris-HCl 100 mM, pH 8,3, MgCl2 35 mM, KCl 500 mM, y la concentración final de los cebadores fue 1 µM. En los experimentos posteriores, eritrocitos de formaciones de rosetas, infectados por trofozoitos individuales, se aislaron con una pipeta de vidrio de 5 µm utilizando un microscopio de inversión. El pRBC seleccionado se separó de los RBC no infectados y fue repetidamente cogido, expulsado y volteado para tener la seguridad de manera concluyente de que contenía pigmento y que la célula seleccionada era un RBC infectado por un único trofozoito (véase la Fig. 1A). Para la detección del producto se necesitaron 50 ciclos de amplificación a 93ºC durante 20 segundos, a 55ºC durante 30 segundos y a 72ºC durante 1 minuto. En cada experimento se incluyeron varios controles; un control que hace de blanco (sin parásito(s)) y un control sin transcriptasa inversa para descartar la posibilidad de contaminación y de amplificación debida a la presencia de DNA genómico. RT-PCR con RNA total procedente de cultivos heterogéneos de FCR3S1.2 o FCR3S/a y análisis de transferencia Northern 35 Se realizó la purificación del RNA total procedente tanto del parásito FCR3S1.2 (R+ ) como del parásito FCR3s/a (R ) y se llevó a cabo una RT-PCR según se ha descrito (Sambrook, J., E.F. Fritsch y T. Maniatis. 1989. Molecular Cloning: A Laboratory Manual, segunda edición, Cold Spring Harbour Laboratory Press). Todos los productos amplificados se clonaron con el Original TA Cloning Kit (Invitrogen) y se secuenciaron. Se llevaron a cabo análisis de transferencia Northern utilizando métodos estándar (Sambrook, J., E.F. Fritsch y T. Maniatis. 1989. Molecular Cloning: A Laboratory Manual, segunda edición, Cold Spring Harbour Laboratory Press). Las membranas se hibridaron con sondas durante la noche a 60ºC usando el fragmento de 434 pb marcado con 32 P-dCTP. Los lavados se realizaron en condiciones rigurosas (60ºC, SSC 0,1X) y las transferencias se examinaron en un Molecular Dynamics Phosphoimager. − 40 45 50 55 60 Clonación y secuenciación del cDNA total Se generaron un cebador específico aguas arriba (L-6, 5’-GAC ATG CAG CAA GGA GCT TGA TAA-3’) en la secuencia de 434 pb y un cebador aguas abajo (L-5, 5’-CCA TCT CTT CAT ATT CAC TTT CTG-3’) que mapea en la secuencia conservada de ATS, y se llevó a cabo una transcripción inversa según se ha descrito anteriormente. La PCR se realizó con ExpandTM High Fidelity PCR System (Boehringer Mannheim). Se amplificó un fragmento único de 4,9 kb, que se digirió en tres fragmentos con Hind III y EcoR V y se clonó en el vector pZErO-1 (Zero Background, Invitrogen). La secuenciación se realizó usando un gel de LongRangerTM (FMC) en un secuenciador A.L.F. Sequencer (Pharmacia). La región 5’ del transcrito de var1 de FCR3S1.2 se clonó mediante escrutinio de una biblioteca de cDNA (Schilichtherler, no publicado) utilizando como sonda el fragmento de 434 pb y se secuenciaron siete fragmentos solapantes. La región 3’ terminal se clonó mediante una RT-PCR interna (del inglés, “nested RTPCR”). La transcripción inversa se hibridó con un oligo-dT y se realizó una PCR con un cebador específico de 5’ (P1, 5’-CTT TCG ACT CTA CCA TCC T-3’) aguas arriba de la región TM y con un cebador 3’ (P-4, 5’-TTA GAT ATT CCA TAT ATC TGA TA-3’) que mapea en la secuencia C terminal de PfEMP procedente de FCR3(var2). Se secuenciaron cinco fragmentos solapantes. En total se secuenciaron catorce clones solapantes en las dos direcciones con el fin de garantizar que la secuencia era correcta y que se había transcrito desde un único gen. Análisis de secuencias 65 El análisis de las secuencias de DNA y aminoácidos (edición, traducción, ordenación de los péptidos, representación, etc.) se realizó con el programa del Genetic Computer Group (GCG) (Devereux, J.P., Haeberli, P. y O. Smithies. 1984. A comprehensive set of sequence analysis programs for VAX. Nucl. Acid. Res. 12,387-395). Para identificar la secuencia se realizó un alineamiento de la secuencia de aminoácidos deducida con las secuencias de PfEMP1 publicadas del GenBank. La identificación de motivos de unión a GAG potenciales en FCR3S1.2-var1 y en las otras 11 ES 2 257 818 T3 5 secuencias de PfEMP publicadas, se hizo realizando en primer lugar una búsqueda con respecto a la presencia de uno cualquiera de los 4 motivos de aminoácidos KK, KR RK o RR, y en segundo lugar comprobando manualmente cada una de las secuencias identificadas con respecto a la presencia de los motivos XBBXBX o XBBBXXBX en los que B es un aminoácido básico (K, R, H) y X es un residuo hidropático. Un cierto grado de libertad relacionado con la posición de los residuos básicos de los motivos es aceptable (Cardin, A.D. y H.J.R. Weintraub, 1989. Molecular modeling of protein-glycosaminoglycan interactions. Arteriosclerosis 9, 21-32). Expresión de DBL-1 o ATS utilizando el vector pGEX-4T-1 10 15 20 25 Los dos fragmentos DBL-1 y ATS se amplificaron con cebadores específicos (Ex-1.1, 5’-ATC GAA TTC TGC AAA AAA GAT GGA AAA GGA A-3’ y D-1, 5’-GTA TTT TTT TTG TTT GTC AAA TTG-3’ para DBL-1; Ex2, 5’-ATC GAA TTC TCT GAA AAT TTA TTC CAA A-3’). Los fragmentos amplificados se insertaron en el sitio de clonación EcoR I de pGEX-4T-1 en dirección aguas abajo de la secuencia de la glutation-S-transferasa. La E. coli BL21 se usó como cepa de expresión. La expresión de las dos proteínas de fusión se indujo con IPTG 0,1 mM a 30ºC durante 4 h y las proteínas de fusión se purificaron sobre Sepharose-glutation (Pharmacia) según se describe en las instrucciones proporcionadas por el fabricante (GST Gen Fusion System, Pharmacia). Las construcciones encargadas de la expresión se secuenciaron mediante una secuenciación por ciclos para comprobar que los plásmidos recombinantes tenían las secuencias esperadas en los marcos de lectura correctos. La escisión de las proteínas de fusión con trombina se realizó conforme a un procedimiento estándar. El análisis de transferencia Western de las proteínas de fusión DBL-1-GST y ATS-GST se hizo con un mAb anti-GST marcado con biotina (clon GST-2, IgG2b, Sigma) y con ALP-avidina (Sigma) para revelar el patrón de expresión de proteínas. Aunque la inducción de la expresión se hizo a baja temperatura y la purificación se hizo en presencia de un cóctel de inhibidores de enzimas (EDTA 0,5 mM, Pefabloc®SC (AEBSF), Boehringer Mannheim), todavía se produjo algo de rotura de la DBL-1-GST. Las proteínas de fusión, teñidas con el mAb anti-GST, disminuyeron con el tratamiento con trombina. Esta información junto con el conocimiento de que los plásmidos tenían las secuencias esperadas, aseguró que las proteínas de fusión eran efectivamente las correctas. Ensayo de bloqueo y de unión a heparina 30 35 La unión potencial de las proteínas de fusión a la heparina se estudió mezclando una de las proteínas de fusión DBL-1-GST o ATS-GST, o GST solo (20 µl, 150 µg/ml en PBS) con 20 µl de Sepharose-heparina al 50% (Pharmacia) e incubando durante 5 min a temperatura ambiente en ausencia de suero; la unión a una Sepharose no acoplada se utilizó como control. La mezcla de Sepharose-heparina y la proteína se lavó tres veces en volúmenes grandes de tampón PBST (PBS más Tween-20 al 0,05%) antes de extraer las proteínas unidas en el tampón de carga de una SDSPAGE al 10%. También se determinó la inhibición de la unión de la proteína de fusión DBL-1-GST a heparina, sulfato de heparán o sulfato de condroitina (Lövens Kemiske Fabrik, Dinamarca, pureza mayor que el 90%). Veinte µl de una concentración de 150 µg/ml de la proteína de fusión DBL-1-GST se mezclaron por separado durante 5 minutos con un volumen igual de heparina, de sulfato de heparán o de sulfato de condroitina, titulados desde 10 mg/ml hasta 0,5 mg/ml, antes de la adición de Sepharose-heparina. Las actividades inhibidoras se comprobaron mediante SDS-PAGE. 40 Ensayo de bloqueo y de unión a eritrocitos 45 50 Portaobjetos de vidrio para inmunofluorescencia, de diez pocillos, se recubrieron previamente con poli-L-lisina al 10% en PBS durante 30 min. Se prepararon monocapas de RBC mediante adición de 20 µl de RBC de grupo sanguíneo 0 Rh+ , lavados 3 veces, al 0,5% en PBS, a cada uno de los pocillos. Veinte µl de DBL-1-GST, ATS-GST o GST solo (80 µg/ml) en PBS, se añadieron a los pocillos durante 30 min. La proteína de fusión DBL-1-GST, en experimentos posteriores, se incubó en presencia de heparina, sulfato de heparán o sulfato de condroitina (titulados desde 20 mg/ml hasta 8 mg/ml) para estudiar la actividad inhibidora de cada uno de los GAG. Los portaobjetos se lavaron tres veces con PBS y la unión de la proteína de fusión se detectó con el mAb anti-GST marcado con biotina, y con un conjugado ExtraAvidin®FITC (Sigma). La fluorescencia se determinó en un microscopio de UV Nikon Optiphot-2, usando lentes oculares de x10 aumentos y lentes de inmersión con un aumento de x100. Ensayo de disgregación de las rosetas 55 60 Este ensayo se realizó esencialmente según se encuentra descrito (Carlson, J. y M. Wahlgren, 1992. Plasmodium falciparum erythrocytes rosetting is mediated by promiscuous lectin-like interactions. J. Exp. Med. 176, 1311-1317). Las proteínas de fusión recombinantes (25 ml en PBS de DBL-1-GST o ATS-GST) se añadieron a partes alícuotas de 25 µl de un cultivo de formaciones de rosetas en ≈80%, de FCR3S1.2, en una placa de microtitulación. Las mezclas se incubaron durante 30 min a 37ºC tras lo cual la tasa de formación de rosetas se evaluó y se comparó con controles falsamente tratados después de una tinción con naranja de acridina. Tratamiento enzimático de RBC normales 65 Eritrocitos humanos del grupo sanguíneo O Rh+ (suspensión al 5% en RPMI), antes del marcaje con C-FDA (Carlson,J., G. Holmquist, D.W. Taylor, P. Perlmann y M. Wahlgren. 1990. Antibodies to a histidine-rich protein (PfHRP 1) disrupt spontaneously formed Plasmodium falciparum erythrocyte rosettes. Proc. Natl. Acad. Sci. U.S.A. 87, 2511-2515), se incubaron durante 60-90 min o con heparinasa III (25ºC, pH 7,5; Sigma) o con condroitinasa (ABC (37ºC, pH 8,0; Sigma); o con neuraminidasa de C. perfringens (37ºC, pH 6,0; Sigma).Las células se lavaron 12 ES 2 257 818 T3 tres veces después del tratamiento y se resuspendieron en medio completo para parásitos de la malaria, con suero al 10%. Suspensiones de eritrocitos de control sometieron a un tratamiento falso, se lavaron y se incubaron de la manera anteriormente descrita. 5 Resultados Identificación de una nueva variantes PfEMP1 formadora de rosetas 10 15 20 25 Con la finalidad de identificar y aislar una variante de PfEMP1 de un parásito formador de rosetas, se desarrolló un ensayo de RT-PCR de células aisladas usando una micromanipulación. Debido a que los mensajes de la PfEMP1 se expresan mayoritariamente en la fase de anillo, es una tarea difícil amplificar el cDNA de trofozoitos aislados. Sin embargo, el autor de la presente invención consiguió hacerlo en cuatro de los ocho pRBC estudiados, y cuando se hubo amplificado, se encontró en todos los casos que era una secuencia de 434 pb (Fig. 1B). Esta secuencia se confirmó mediante amplificación de transcritos de var procedentes de cultivos heterogéneos, en los que el fragmento amplificado de 434 pb se detectó también que era único para el P. falciparum formador de rosetas y no se encontró en los parásitos no formadores de rosetas (Fig. 1C). Tanto la RT-PCR de células aisladas como la RT-PCR con el RNA total procedente de los cultivos heterogéneos, se repitieron varias veces para tener la seguridad de que los resultados eran reproducibles. Además, el producto de 434 pb se encontró que también estaba presente en 7 de los 12 parásitos en fase de anillo usando una RT-PCR de células aisladas (datos no mostrados). El análisis de las secuencias reveló que el producto amplificado codificaba la secuencia semiconservada del dominio DBL-1 de los genes var situado en 5’. Se encontró que diez secuencias de 434 pb, obtenidas procedentes de distintas amplificaciones, eran idénticas. También se aislaron, se subclonaron y se secuenciaron nueve transcritos distintos de var amplificados por PCR, procedentes de parásitos no formadores de rosetas. En todos los casos fueron diferentes de la secuencia de 434 pb (no mostrado). El análisis de transferencia Northern con mRNA procedente del clon FCR3S1.2 y con la secuencia de 434 pb como sonda marcada, reveló la presencia de un transcrito de aproximadamente ≈7,5 kb, debiéndose la diferencia con el tamaño del cDNA codificador de 6,7 kb a la región en 5’ que no se traduce, que tiene un tamaño relativamente grande (Sundström y col., no publicado). La débil hibridación observada con el mRNA procedente de parásitos R− se debe probablemente a la hibridación a un transcrito diferente (Fig. 1D). Así, según la presente invención, se ha encontrado un transcrito único de PfEMP 1 en parásitos formadores de rosetas. 30 Estructura del cDNA de la PfEMP1 formadora de rosetas 35 40 45 La región codificadora completa del transcrito de var que contiene el motivo de 434 pb, se reunió con los 13 fragmentos solapantes y se encontró que la secuencia codificadora estaba compuesta por 6.684 pb (SEQ ID NO: 1). Los 6.684 pb codifican un polipéptido de 2.228 aa con un peso molecular estimado de 260 kDa. Un polipéptido aislado y sensible a tripsina, de tamaño similar, se observó después del marcaje de superficie del FCR3S1.2 con 125 I-lactoperoxidasa (Fig. 1E). En un análisis con profundidad del transcrito de FCR3S1.2-var1, se encontró que la estructura completa era similar a la de las secuencias de var publicadas. Sin embargo, la secuencia de la nueva variante según la presente invención difiere sustancialmente de las secuencias publicadas con anterioridad en que es más corta que las secuencias previas, ya que contiene dos dominios DBL (DBL-1 y DBL-4) en lugar de cuatro, separados por una región interdominios rica en cisteína (CIDR) (Fig. 2B). Tanto la región TM como el segmento C-terminal de carácter ácido (ATS) del FCR3S1.2var1 exhibieron un cierto grado de homología (≈80%) con respecto a las secuencias previamente publicadas. Sin embargo, ni las secuencias potencialmente variables del fragmento de 434 pb del gen var ni el resto de regiones del cDNA estaban contenidas en otras secuencias de var publicadas, tales como la secuencia descrita en el documento WO 96/33736. La PfEMP1 formadora de rosetas contiene grupos de motivos de unión a glucosaminoglucanos 50 55 60 65 La secuencia de FCR3S1.2-var1 se estudió con respecto a la presencia de motivos potenciales de unión a GAG. Se identificaron 19 secuencias potenciales de unión a GAG y se encontró que ≈95% de ellas (18/19) estaban situadas en el terminal N. Una proporción de 8/19 estaban situadas en DBL-1, 5/19 estaban situadas en el CIDR en posición C-terminal con respecto a DBL-1, y 5/19 estaban situadas en DBL-4. Solamente uno de los motivos potenciales de unión a GAG se observó apartado de la región TM (SEQ ID NO: 1). La distribución N-terminal de estos grupos de aminoácidos es por lo tanto consecuente con la accesibilidad de la FCR3S1.2-var1 a la superficie del pRBC. Por lo tanto, ésta puede ser la base molecular de la formación de rosetas, y con ello se explica porqué las rosetas son sensibles a la heparina. La PfEMP1 formadora de rosetas se une a un GAG semejante a sulfato de heparán Para confirmar experimentalmente los descubrimientos anteriores, dos dominios del transcrito de FCR3S1.2-var1 se expresaron más tarde: un dominio que contenía 8 motivos de unión a GAG (DBL-1, 1.008 pb que corresponden a 336 aa) y otro dominio que era la secuencia C-terminal ácida (ATS) altamente cargada que carece de motivos de unión a GAG (1.353 pares de bases que corresponden a 451 aa). La DBL-1-GST purificada se unió eficientemente a Sepharose acoplada a heparina después de unos pocos minutos a temperatura ambiente, mientras que la proteína de fusión ATS-GST no lo hizo (Fig. 3B) y una segunda construcción de DBL-1-GST que cubre una secuencia distinta de var (var-2, Su, X.-Z., V.M. Heatwole, S.P. Wertherimer, F. Guinet, J.A. Herrfeldt, D.S. Peterson, J.A. Ravetch y T.E. 13 ES 2 257 818 T3 5 10 15 20 Wellems, 1995. The large diverse gene family var encodes proteins involved in cytoadherence and antigenic variation of Plasmodium falciparum-infected erythrocytes. Cell 82, 89-100), que carece de motivos de unión a GAG, tampoco pudo unirse a la matriz de heparina (no mostrado). En la adhesión pudieron competir de manera dependiente de la dosis la heparina o el sulfato de heperán pero no el sulfato de condroitina, otro GAG expresado en la superficie de eritrocitos con carga negativa (Fig. 3C). Considerando todo en conjunto, esto indica que la unión de DBL-1 a sulfato de heparán es dependiente de la estructura y no simplemente de interacciones iónicas entre las dos moléculas. El sulfato de heparán o un GAG semejante a sulfato de heparán parece ser por lo tanto la diana para la unión de la nueva variante de PfEMP1. La PfEMP1 formadora de rosetas se une directamente a los eritrocitos Para estudiar la unión potencial de la PfEMP1 recombinante a los eritrocitos, se formaron monocapas de eritrocitos no infectados sobre portaobjetos de vidrio. Las células se incubaron después con concentraciones diferentes de las proteínas de fusión. Aunque la ATS-GST no se unió a los eritrocitos según se detecta con un mAb anti-GST, proporcionó una clara tinción de superficie de todos los eritrocitos no infectados (Fig. 3D, E). Esta unión fue titulable y pudo ser inhibida con pequeñas cantidades de heparina o de sulfato de heparán pero no con el GAG relacionado, sulfato de condroitina, lo que sugiere que la unión era específica. En publicaciones previas se ha sugerido que el sulfato de heparán esta presente en eritrocitos humanos (Trybala, E., B. Svennerholm, T. Bergström, S. Olofsson, S. Jaensson y J.L. Goodman. 1993. Herpes simplex virus type 1-induced hemagglutination: glycopprotein C mediates virus binding to erythrocyte surface heparan sulfate. J. Virol. 67, 1278-1285, Baggio, B., G. Mazaro, G. Gambaro, F. Marchini, H.E. Williams y A. Borsatti. 1990. Glycosaminoglycan content, oxalate self-exchange and protein phosphorylation in erythrocytes of patients with idiopatic calcium oxalatenephrolithiasis. Clinical Science, 79, 113-116) y por lo tanto se concluye que la proteína de fusión DBL-1-GST se une con sulfato de heparán específicamente tanto cuando éste esta unido a la matriz de fase sólida como cuando está en eritrocitos normales. 25 La DBL-1 recombinante disgrega las roseta y bloquea la nueva formación de rosetas 30 35 40 El efecto de la proteína de fusión con DBL-1 sobre las rosetas preformadas se estudió con el fin de confirmar el papel biológico de PfEMP1 en la formación de rosetas. Partes alícuotas de un cultivo de FCR3S1.2 de una alta proporción de formaciones de rosetas, se incubaron con concentraciones decrecientes de DBL-1-GST o de ATSGST. DBL-1 produjo una reversión de las rosetas dependiente de la dosis, con una reversión del 40%-50% a una concentración de ≈50 µg/ml, mientras que ATS-GST no mostró ningún efecto (Fig. 4). Las rosetas no se volvieron a formar después de una incubación prolongada. La formación de rosetas es dependiente de sulfato de heparán Para establecer el papel del sulfato de heparán también en la formación de rosetas, se estudió la actividad disgregadora de diferentes GAG sobre rosetas de FCR3S1.2. Las rosetas de FCR3S1.2 fueron sensibles tanto a heparina como a sulfato de heparán, pero ni el sulfato de condroitina A, ni el sulfato de queratán, ni el ácido hialurónico ejercieron efecto alguno sobre las rosetas (Fig. 5A). El sulfato de condroitina B tuvo un efecto pequeño sólo a concentraciones altas (Fig. 5A). Estos descubrimientos se confirmaron mediante tratamiento del eritrocito no infectado con enzimas: el tratamiento con heparinasa, pero no con condroitinasa ni con neuraminidasa, bloqueó la unión (Fig. 5B). Ejemplo 2 45 Materiales y métodos 50 55 60 65 Parásitos y formación de rosetas - Se utilizaron dos cepas de laboratorio distintas de P. falciparum de una alta proporción de formaciones de rosetas: FCR3S1 (previamente denominada R+ PA1) y TM284 (aislada en Tailandia, 1.990). Los parásitos se cultivaron conforme a procedimientos estándar (Udomsangpetch y col. 1989). Se obtuvieron muestras clínicas de campo procedentes de pacientes que acudían al Albert Schweitzer Hospital, Lambaréné, Gabón, entre abril y junio de 1.996. En el estudio se incluyeron pacientes con un recuento de parásitos de P. falciparum en fase asexual superior a 10.000/µl de sangre. Se recogió una muestra de sangre venosa o de sangre capilar después de que los pacientes o sus padres dieran un consentimiento informado. La sangre se lavó tres veces con RPMI y se cultivó conforme a procedimientos estándar (Udomsangpetch y col. 1989). La evaluación del crecimiento del parásito y de la formación de rosetas se realizó cada 6-8 horas usando un microscopio Leitz de luz UV. Brevemente expuesto, una parte alícuota del cultivo del parásito se mezcló con una cantidad pequeña de naranja de acridina y la muestra se analizó. Los ensayos se realizaron en muestras clínicas con formaciones de rosetas cuando la mayoría de los parásitos en cultivo había alcanzado la fase de trofozoito. La tasa de formación de rosetas se expresó como el número de eritrocitos infectados presentes en las rosetas en relación con el número total de eritrocitos infectados en fase tardía. Se efectuó el recuento de 300 células infectadas. La parasitemia se calculó como el número de eritrocitos infectados con respecto al número de eritrocitos no infectados. Sacáridos - Varios GAG, polisacáridos, monosacáridos y disacáridos de heparina, se evaluaron con respecto a la actividad de disgregación de rosetas. Heparina, sulfato de heparán, sulfato de condroitina, sulfato de dermatán, (todos ellos procedentes de intestino porcino) así como fucoidán (Fucus vesiculosus), sulfato de dextrano (PM 8.000), sulfato de queratán (córnea bovina), ácido hialurónico (cresta de gallo), monosacáridos y disacáridos de heparina/HS (producidos mediante digestión de heparina y HS por acción de distintas heparinasas) se adquirieron procedentes de Sigma 14 ES 2 257 818 T3 5 10 15 (St. Louis, EE.UU.). Dextrano (PM 60.000) procedió de Medisan Pharmaceuticals, Estocolmo, Suecia. Una heparina de alto peso molecular, con una baja afinidad por antitrombina III (heparina HMW-LA) (del inglés, “High Molecular Weight - Low Affinity heparin”) se produjo mediante filtración en gel de una heparina estándar en Sephacryl S200 (Pharmacia; Uppsala, Suecia) seguida por el paso a través de una columna de Sepharose 4B-antitrombina (Carlson y col. 1992). La modificación de la heparina de pulmón bovino y las caracterizaciones estructurales se realizaron según se ha descrito (Feyzi y col. 1997). Tratamiento de eritrocitos y de eritrocitos infectados - Los tratamientos de glóbulos rojos (RBC) de grupo sanguíneo 0 Rh+ y los cultivos se realizaron con heparinasa III (0,033 UI/ml, 25ºC, pH 7,5), condroitinasa ABC (20 UI/ml, 37ºC, pH 7,5), neuraminidasa de Clostridium perfringens (0,1 UI/ml, 37ºC, pH 6,0) y fosfolipasa C (0,1 UI/ml, 30ºC, pH 7,5). Las enzimas se adquirieron procedentes de Sigma y de Seikagaku Corporation. La tasa de formación de rosetas se evaluó después de una incubación de 210 minutos con una enzima, sin cambiar ninguna de las condiciones del cultivo, y se comparó con cultivos de control sometidos a un tratamiento falso. No se observaron parásitos extracelulares ni un cambio grande en la morfología de los RBC a las concentraciones y al tiempo de incubación utilizados. La digestión con tripsina (100 UI/ml, 37ºC, pH 7,5) y quimotripsina (104 UI/ml, 37ºC, pH 7,5) se detuvo con inhibidor de proteasas procedente de semilla de soja (Sigma) después de una incubación de 20 minutos, y se evaluó la tasa de formación de rosetas. Se añadió peryodato sódico en RPMI a los cultivos y a los RBC no infectados en una concentración 10 mM. La tasa de formación de rosetas se verificó después de una incubación de 15 minutos a temperatura ambiente y se comparó con la de los cultivos de control sometidos a un tratamiento falso. 20 25 30 35 40 45 50 55 60 65 Ensayos de disgregación de las rosetas - Se realizaron ensayos en muestras clínicas de tipo salvaje en cultivos que presentaban una tasa de formación de rosetas superior al 20% (intervalo del 23,6%-86,2%, media 48,6%) y una parasitemia del 1%-10%. En el caso de las cepas de laboratorio, se usaron cultivos de parásitos con unas tasas de formación de rosetas del 50%-70% y una parasitemia del 5%-8%. Partes alícuotas (12,5 µl-25 µl) de cultivos de los parásitos se mezclaron con cantidades iguales de un compuesto glucoconjugado sulfatado en RPMI, en una placa de microtitulación de 96 pocillos, a las concentraciones finales indicadas. Después de una incubación durante 30 minutos a 37ºC, se realizó la evaluación de las rosetas según se ha descrito en lo que antecede. La tasa de formación de rosetas se comparó con la del cultivo mezclado con RPMI. Ensayo de competición usando eritrocitos marcados con diacetato de carboxi-fluoresceína (C-FDA) - Con el fin de medir la capacidad relativa de los RBC tratados para formar rosetas, se realizó un ensayo de competición como el descrito por Carlson y Wahlgren (Carlson y col. 1992), con algunas modificaciones. RBC de grupo sanguíneo 0 Rh+ se pretrataron durante 60-90 min con enzimas o con peryodato según se ha descrito anteriormente, y se mezclaron con una pequeña cantidad de disolución de trabajo de C-FDA (Sigma) hasta alcanzar una concentración final de 250 µg/ml. Las células se incubaron durante 10-15 minutos a temperatura ambiente, a continuación se lavaron tres veces con RPMI y por último se resuspendieron hasta alcanzar un valor de hematocrito del 5% en un medio de cultivo para parásitos de la malaria, que contenía suero AB+ al 10%. Los controles se sometieron a un tratamiento falso y se marcaron según se ha descrito en lo que antecede. Cultivos recién obtenidos de formaciones de rosetas, crecidos en RBC de grupo sanguíneo 0 Rh+ , procedentes del mismo donante, se resuspendieron según se ha indicado anteriormente. Una parte alícuota de 25 µl de cultivo se mezcló con un volumen igual del RBC no infectado y marcado con C-FDA, que se había sometido a pretratamiento con enzima o con peryodato. Las rosetas se disgregaron mecánicamente extrayendo las células a través de una aguja de inyección (0,60 mm de diámetro) 6-8 veces. Después de una incubación de 30 minutos, se evaluó la re-formación de las rosetas y se calculó la proporción de RBC marcados con respecto a RBC no marcados presentes en las rosetas. Los ensayos se consideraron válidos cuando la proporción de RBC marcados/no marcados en el ensayo fue de 0,91,1 y la proporción de RBC marcados/no marcados que participaban en las rosetas fue de 0,9-1,1 en las muestras de control. Resultados Disgregación de rosetas procedentes de cepas de laboratorio de FCR3S1 y TM284 por acción de SG - La disgregación de rosetas por acción de los GAG y de otros tres polisacáridos relacionados (dextrano, sulfato de dextrano y fucoidán) realizada en dos cepas de laboratorio, reveló diferencias en la sensibilidad a los GAG (Tabla 1). Aún teniendo una estructura molecular similar, algunos compuestos carecieron por completo de actividad de disgregación de rosetas a concentraciones altas (1-10 mg/ml), mientras que otros compuestos fueron potentes disgregadores de rosetas incluso a concentraciones más bajas (1-10 µg/ml; Tabla 1 y datos no mostrados). FCR3S exhibió una alta sensibilidad a heparina y HS, mientras que el sulfato de dermatán/condroitina tuvieron un efecto pequeño o nulo. Por otra parte, TM284 exhibió una sensibilidad relativamente más alta al sulfato de dermatán/condroitina que FRC3S1 y fue menos sensible a HS/heparina (Tabla 1). Aún así, la heparina disgregó el 80% de las rosetas de TM284 a una concentración de 1 mg/ml (datos no mostrados). Sensibilidad de muestras clínicas de tipo salvaje a los SG - Se caracterizaron treinta y dos muestras clínicas procedentes de pacientes con el fin de analizar las propiedades de parásitos recientes de P. falciparum. La sensibilidad de las rosetas frente a los diferentes GAG y frente a otros polisacáridos sulfatados fue claramente dependiente de la muestra clínica. En general, se pudieron distinguir dos grupos principales (Fig. 1). Un grupo fue más sensible a los glucosaminoglucanos heparina y sulfato de heparán, y algo menos sensible a los galactosaminoglucanos (sulfato de condroitina y sulfato de dermatán). En el segundo grupo de muestras clínicas, los galactosaminoglucanos fueron 15 ES 2 257 818 T3 5 competidores más eficaces que los glucosaminoglucanos. En ambos grupos, el fucoidán fue un potente disgregador de rosetas en contraste con el sulfato de dextrano que fue mucho menos eficaz que los GAG en la mayoría de las cepas. Esta situación indicó que la carga era un determinante importante pero no el único determinante en la disgregación de las rosetas. Sobre la colección completa de muestras clínicas de tipo salvaje, el fucoidán fue el disgregador de rosetas más eficaz para la mayoría de las muestras clínicas y el sulfato de condroitina fue el menos eficaz, mientras que el sulfato de dermatán, heparina, HS y sulfato de dextrano tuvieron una posición intermedia. Esto fue también cierto cuando se realizaron ensayos con otras concentraciones (10-100 µg/ml; datos no mostrados). No se observó una correlación clara entre las diferencias en sensibilidad a los SG de las muestras clínicas y la parasitemia, proporción de formación de rosetas o el grupo sanguíneo AB0 del paciente (datos no mostrados). 10 15 20 25 Disgregación de rosetas por acción de heparina modificada - Con el fin de investigar la importancia relativa de diferentes características moleculares, se ensayó una heparina modificada con respecto a la disgregación de rosetas en la cepa FCR3S1 sensible a heparina/HS. Cuando grupos N-sulfato se reemplazaron por el grupo acetilo de carga neutra, la heparina fue 100 veces menos eficiente en la disgregación de rosetas comparada con la forma natural (Fig. 2). En contraste a este marcado efecto, la O-desulfatación pareció ser mucho menos importante, ya que la retirada de los grupos 2-O-sulfato o 6-O-sulfato produjo una reducción de 10 veces de la eficiencia de la disgregación. Incluso la muestra más completamente O-desulfatada con sólo aproximadamente el 30% de unidades de disacárido todavía 2-O-sulfatadas, presentó un orden similar de eficiencia. Sensibilidad de las rosetas a disacáridos - Debido a que el efecto de la heparina pareció estar fuertemente relacionado con la presencia del grupo N-sulfato, se ensayó si los disacáridos individuales pudieran tener una capacidad de reversión de las rosetas. Diferentes disacáridos que se obtienen mediante escisión de heparina y HS con heparinasa, se sometieron al ensayo de formación de rosetas. Los más activos contenían todos ellos la glucosamina N-sulfatada, mientras que la eficiencia de los disacáridos se redujo con la acetilación del grupo amino, lo que corrobora los datos obtenidos con las heparinas modificadas (Fig. 3). La O-sulfatación por otra parte tuvo sólo una influencia limitada. Mientras que la 6-O-sulfatación pareció ser menos importante, el 2-O-sulfato tuvo cierto efecto positivo en adición al del N-sulfato. De manera adicional, los disacáridos de heparina II-H (∆HexA-GlcN(6-OSO3 )), III-H (∆HexA-(2OSO3 -GlcN) y IV-H (∆HexA-GlcN), que carecen todos ellos de N-sulfatación y tienen un grupo amino con carga positiva, no exhibieron efecto disgregador de rosetas (datos no mostrados). 30 Un disacárido activo y un disacárido inactivo se estudiaron con detalle: la reversión completa de las rosetas se obtuvo con el disacárido IV-S N-sulfatado (∆HexA-GlcNSO3 ) en una concentración 45 mM, mientras que el disacárido IV-A N-acetilado (∆HexA-GlcNAc) careció por completo de efecto (Fig. 4A). 35 40 45 50 55 60 En un experimento preliminar el disacárido de heparina más predominante recuperado después de la digestión con heparinasa, el I-S (∆HexA(2-OSO3 )-GlcNSO3 (6-OSO3 ), se tituló frente a la heparina con respecto a la disgregación de las rosetas en la cepa FCR3S1. A una concentración 30 mM de disacárido, las rosetas se disgregaron en la misma medida que con heparina a una concentración de 1 mg/ml (corresponde a una concentración 70 µM de moléculas de heparina), es decir, la cadena de heparina fue unas 20 veces más eficiente sobre una relación en pesos y unas 500 veces más eficiente sobre una relación en moles. Cuando las muestras clínicas de tipo salvaje se ensayaron con esta concentración de disacárido, en comparación con los otros competidores, este disacárido exhibió un patrón similar al de la heparina (Fig. 1). Sensibilidad de las rosetas frente a monosacáridos - Cuando se hizo el ensayo con glucosamina, los monosacáridos N-sulfatados proporcionaron una reversión de las rosetas del -50% a una concentración 50 mM, y ni grupos sulfato adicionales y ni las cargas negativas en aumento potenciaron la disgregación de las rosetas. Algo de actividad podría también atribuirse a la glucosamina N-acetilada con un éster O-sulfato en posición C-6 (Fig. 5B). Se obtuvieron resultados similares cuando se el ensayo se hizo con la capa TM284, aunque se requirieron concentraciones ligeramente más altas (datos no mostrados). Así mismo, la galactosamina N-sulfatada (que no está presente en ningún GAG) careció de actividad disgregadora de rosetas, mientras que la glucosamina N-sulfatada (común en heparina/HS) produjo la disgregación total de las rosetas (Fig. 4B). Oxidación de glucanos y tratamiento enzimático de cultivos completos - Diferentes tratamientos de los cultivos de eritrocitos infectados produjeron cambios en el comportamiento de formación de rosetas sin ningún cambio grande sobre la morfología de los RBC en las dos cepas ensayadas (Fig. 6A). Cuando los cultivos se trataron con las proteasas tripsina o quimotripsina la formación de rosetas se suprimió por completo, lo que indica que o el receptor o el ligando del complejo de adhesión es una proteína altamente sensible a proteasas. La heparinasa III, que escinde de manera selectiva enlaces -4GlcNRα[1→4]-GlcA1- (en donde R puede ser N-acetamido o N-sulfo) de cadenas de sulfato de heparán (Linhardt y col. 1990) produjo una reducción drástica en la capacidad de formación de rosetas de FCR3S1 y un descenso algo menor en la capacidad de formación de rosetas de TM284. La condroitinasa ABC, que escinde enlaces GalNAcα[1→4]-GlcA en el sulfato de condroitina tuvo únicamente efecto sobre la formación de rosetas de la cepa TM284. No se observó ningún efecto ni con el tratamiento con neuraminidasa ni con el tratamiento con fosfolipasa C. El peryodato sódico que oxidaría cualquier tipo de glucano con grupos hidroxilo vecinales tuvo un efecto intermedio sobre ambas cepas de parásitos. 65 Oxidación de glucanos y tratamiento enzimático de RBC no infectados - Con el fin de evaluar si los anteriores resultados pueden ser atribuidos a los RBC infectados per se o a los RBS no infectados que participan en la formación de las rosetas, se realizaron ensayos de competición con RBC no infectados pretratados y marcados con C-FDA. El 16 ES 2 257 818 T3 tratamiento de los RBC no infectados con peryodato sódico disminuyó 4 veces su capacidad de unión a las rosetas en comparación con la de los RBC no tratados. La capacidad de unión a las rosetas de los RBC tratados con heparinasa III disminuyó también 4-5 veces. 5 10 El tratamiento con hepariansa III en presencia de inhibidor de proteasas procedente de semilla de soja no revertió el efecto, y la adición de HS a la heparinasa bloqueó por completo la actividad de la heparinasa (datos no mostrados). Así mismo, el tratamiento con tripsina y quimotripsina afectó a la capacidad de unión, con una disminución de 25 veces, pero menos que el tratamiento del cultivo completo. Este descubrimiento sugiere que la principal molécula sensible a proteasas es el ligando presente sobre el RBC no infectado, aunque no todas las estructuras de receptores presentes en el RBC no infectados son sensibles a una degradación proteolítica. Esto puede ser o bien debido a una sensibilidad reducida a las proteasas de las proteínas glucosiladas/proteoglucanos, o bien debido a que los glucanos de los receptores se situarían sobre una región central no proteinácea. En el caso de la cepa TM-284, se observó una disminución de la capacidad de unión de 2 veces después del tratamiento con condroitinasa ABC, mientras que FCR3S1 no se afectó. (Fig. 6B). 15 Discusión 20 25 30 35 40 45 50 55 60 65 La presente invención describe la identificación de una nueva variante de PfEMP1 como el ligando en la formación de rosetas y sulfato de heparán, o una molécula semejante a sulfato de heparán, como el receptor en la formación de rosetas. Se desarrolló una técnica de RT-PCR de células aisladas con el fin de investigar la asociación de la expresión de la nueva variante de PfEMP1 con el proceso de unión-formación de rosetas a nivel de células aisladas. Se encontró que los mensajes de PfEMP1 estaban presentes en los parásitos en fase de anillo, en trofozoitos y en esquizontes, aunque eran menos abundantes en los parásitos en fases más maduras. Sin embargo, éstos se estudiaron con gran detalle debido a que forman rosetas y los anillos no lo hacen. Una de las especies de mRNA de PfEMP1 se amplificó a partir de parásitos formadores de rosetas aislados y la aparición del mismo fragmento en amplificaciones hechas con el RNA total procedente de cultivos heterogéneos R+ , pero no en amplificaciones hechas con el RNA procedente de parásitos no formadores de rosetas o de parásitos de baja tasa de formación de rosetas, indicó que el mensaje era exclusivo de los parásitos formadores de rosetas. Se evidenció, sin embargo, que los parásitos no eran homogéneos incluso en cultivos de una alta tasa de formación de rosetas, lo que sugiere que los parásitos no formadores de rosetas pueden expresar PfEMP1 diferentes. De manera similar, aunque se encontró una fuerte hibridación a un mensaje de ≈7,5 kb procedente de los parásitos formadores de rosetas, había todavía una pequeña hibridación a especies ligeramente más pequeñas con RNA procedente de los parásitos R− . Esto probablemente refleja la transcripción de un gen var diferente, ya que la secuencia de FCR1S.2-var1 no se encontró en los productos amplificados procedentes de los parásitos R− . La clonación del cDNA de longitud completa de células eucariotas es siempre difícil. Por ejemplo, Harshman y col (1995) Hum. Mol. Genet. 4:1259-1266, han mostrado que métodos diferentes de identificación de los cDNA procedentes de una región genómica dan como resultado un conjunto sorprendentemente diferente de genes candidatos. Para poder conseguir esto, los parámetros de la RT-PCR primero se optimizaron, de manera que la mayoría de los transcritos de PfEMP1 pudieran ser amplificados. Con estas condiciones y con una secuencia de cebadores procedente del cDNA único de 434 pb de PfEMP1 formadora de rosetas, se amplificó un gran fragmento individual aguas abajo, de 4,9 kb, de cDNA, que tras la digestión con EcoR I y Hind III se fragmentó en bandas definidas que indicaban que el producto amplificado estaba compuesto por una sola secuencia. Posteriormente se confirmó mediante secuenciación que la especie de 4,9 kb de cDNA era un producto amplificado único. Secuencias específicas de PfEMP1 formadora de rosetas tanto de la región variable, aguas arriba con respecto al dominio transmembrana, como del fragmento de 434 pb, se utilizaron para obtener las secuencias de regiones solapantes de las regiones 3’ y 5’ de este transcrito. Se secuenciaron cinco fragmentos solapantes para determinar el solapamiento en 3’ y siete fragmentos solapantes para determinar el solapamiento en 5’. Se comprobó de nuevo que eran correctas mediante una RT-PCR con cebadores específicos que flanquean las regiones solapantes después del empalme de la secuencia codificadora completa. Cada uno de los 14 fragmentos amplificados por PCR se secuenció en ambas direcciones y se encontró que los fragmentos solapantes eran correctos e idénticos en todas las regiones. Por lo tanto, se estableció la hipótesis de que el transcrito empalmado derivaba ciertamente de un solo gen. La elevada sensibilidad de las rosetas a la heparina y a los glucosaminoglucanos (GAG) anteriormente especificados hizo que los autores de la presente invención especulasen que el parásito utiliza carbohidratos sulfatados como receptor en la formación de rosetas. La aparición de motivos de unión a GAG potenciales en esta nueva secuencia de PfEMP1 se comprobó por ello después del empalme del transcrito. Se identificaron entonces grupos de motivos de unión a GAG, cuya secuencia consenso había sido previamente propuesta por otros autores. Todos los motivos mostraron una composición idéntica o similar a la de otros motivos de unión a heparina o a sulfato de heparán publicados, encontrados tanto en parásitos de la malaria como en otros organismos (Sinnis, P., P. Clavijo, D. Fenyö, B.T. Chait, C. Cerami y V. Nussenzweig. 1994. Structural and functional properties of region II-plus of the malaria circumsporozoite protein. J. Exp. Med. 180, 297-306, Jackson, L.R., J.S. Busch y D.A. Cardin. 1991. Glycosaminoglycans: molecular properties, protein interactions, and role in physiological processes. Physiol. Rev., 71, 481-530). La DBL-1 expresada, que contiene 8 motivos, se unió a Sepharose-heparina, a la membrana de RBC normales, disgregó rosetas formadas de manera natural y bloqueó la nueva formación de rosetas, mientras que la proteína de fusión con ATS no lo hizo. La actividad inhibidora del sulfato de heparán así como la incapacidad del sulfato de condroitina para inhibir o bloquear la unión, proporcionó la información de que era la estructura molecular de los GAG la que era importante para la unión. En experimentos complementarios, se expresó la región de DBL-1 de un segundo transcrito del gen var (var-2) que carece de motivos de unión a GAG, y se encontró que no se unía a Sepharose-heparina (Sahlen y col., referencia 17 ES 2 257 818 T3 no mostrada), lo que también apoya la existencia de un papel funcional de las secuencias de unión a GAG presentes en la DBL-1 formadora de rosetas. 5 10 15 20 25 30 35 40 45 La reversión de las rosetas, obtenida mediante la adición de DBL-1 recombinante a rosetas formadas de manera natural, indicó que el parásito utiliza la nueva variante de PfEMP1 como el ligando principal en la formación de rosetas. La supresión de la formación de rosetas, mediante tratamiento con heparinasa, de RBC normales proporcionó una confirmación más de esta interacción específica ligando-receptor, sugiriendo realmente que el sulfato de heparán, o al menos una molécula semejante al sulfato de heparán, está implicada en esa unión. El tratamiento con heparinasa también disgregó las rosetas de otras cepas de parásitos (TM180, TM284), mientras que las rosetas de la cepa R29 no se vieron afectadas (datos no mostrados), descubrimientos que están en acuerdo con los de Rowe y col. (Rowe, J.A., J.M. Moulds, C.I. Newbold y L.H. Miller. 1997. P. falciparum rosetting mediated by a parasite-variant erythrocyte membrane protein and complement-receptor 1. Nature 288:292-295). En experimentos independientes, monosacáridos y disacáridos derivados de la heparina, que tenían la misma carga neta pero que tenían sus grupos sulfato en posiciones diferentes, se estudiaron con respecto a sus actividades de disgregación de rosetas. Aquellos que tenían los grupos sulfato en la misma posición que el sulfato de heparán inhibieron la unión, mientras que los otros no lo hicieron (Barragan y col., referencia no publicada y véase lo que antecede). Además, mientras que el monosacárido Nsulfatado glucosamina, un componente del sulfato de heparán, presentó una buena actividad anti-formadora de rosetas, la galactosamina, N-sulfatada de manera idéntica, no lo hizo (Barragan y col., referencia no publicada). También se ha encontrado que la heparina disgrega las rosetas de 27 de las 54 muestras clínicas de P. falciparum (50%) lo que sugiere que el sulfato de heparán es usado por estos parásitos como el receptor en la formación de rosetas (Carlson, J., H.P. Ekre, H. Helmby, J. Gysin, B.M. Greenwood y M. Wahlgren. 1992. Plasmodium falciparum erythrocyte rosettes by standard heparin devoid of anticoagulant activity. Am. J. Trop. Med. Hyg. 46, 595-602). Los receptores usados por muestras clínicas recientes resistentes a heparina, pueden ser otros GAG, debido a que se ha encontrado que rosetas de la mayoría de los parásitos pueden ser disgregadas por acción de unos u otros de las GAG humanos (Barragan y col., referencia no publicada). Además, otros glucanos sulfatados, tales como fucoidán, disgregaron rosetas de casi todas las muestras clínicas recién obtenidas (Fig. 1). Así pues, según la presente invención, se ha encontrado que FCR3S1.2 utiliza sulfato de heparán, o una molécula semejante a sulfato de heparán, presente en la superficie del eritrocito, como receptor en la formación de rosetas, y que los otros GAG pueden ser receptores de otros parásitos. El sulfato de heparán es una molécula presente en todas las células, incluyendo eritrocitos (Trybala, E., B. Svennerholm, T. Bergström, S. Olofsson, S. Jaensson y J.L. Goodman. 1993. Herpes simplex virus type 1-induced hemagglutination: glycoprotein C mediates virus binding to erythrocyte surface heparan sulfate. J. Virol., 67, 1278-1285, Baggio, B., G. Mazaro, G. Gambaro, F. Marchini, H.E. Williams y A. Borsatti. 1990. Glycosaminoglycan content, oxalate selfexchange and protein phosphorylation in erythrocytes in patients with idiopathic calcium oxalate nephrolithiasis. Clinical Science 79, 113-116); se ha sugerido que 4 x 106 moléculas se expresan en la superficie de hepatocitos normales (Kjellen, L., Å. Oldberg y M. Höök. 1980. Cell surface heparan sulfate. J. Biol. Chem. 21, 10407-10413). La densidad sobre los RBC debe ser también alta si éste es efectivamente el receptor utilizado por el parásito para la formación de rosetas. La implicación de los GAG como estructuras de receptores para otras interacciones célula a célula de P. falciparum ha sido sugerida con anterioridad p. ej. en las uniones al endotelio, en la invasión al hígado y en la invasión a eritrocitos (Sinnis, P., P. Clavijo, D. Fenyö, B.T. Chait, C. Cerami y V. Nussenzweig. 1994. Structural and functional properties of region II-plus of the malaria circumsporozoite protein. J. Exp. Med. 180, 297-306, Kulane, A.,H-P. Ekre, P. Perlmann, L. Rombo, M. Wahlgren y B. Wahlin. 1992. Effect of different fractions of heparin on Plasmodium falciparum merozoite invasion of red blood cells in vitro. Am. J. Trop. Med. Hyg., 46, 589-594, Robert, C., B. Pouvelle, P. Meyer, K. Muanza, A. Scerf, y J. Gysin. 1995. Chondroitin-4-sulfate (proteoglycan) as Plasmodium falciparum-infected erythocyte adherence receptor of brain microvascular endothelial cells. Res. Immunol. 146, 383-393, Rogerson, S.J., S.C. Chaiyaroj, K. Ng, J.C. Reeder y G.V. Brown. 1995. Chondrotin sulfate A is a cell surface receptor for Plasmodium falciparum-infected erythrocytes. J. Exp. Med. 182, 15-20). Considerado en conjunto, esto puede indicar que el parásito ha adaptado una estrategia más general para interaccionar con el hospedador utilizando los proteoglucanos cargados negativamente como los receptores expuestos en el exterior de todas las superficies celulares. 50 55 60 65 Según la presente invención, se ha encontrado también que la capacidad de disgregación de rosetas no está sólo determinada por el peso molecular de los SG. El ácido hialurónico, con mucho la más grande de todas las moléculas ensayadas, no exhibió actividad de disgregación de rosetas mientras que moléculas más pequeñas si lo hicieron. Así mismo, no siempre se observó una asociación entre la carga negativa media y la capacidad de reversión de las rosetas, p. ej., el ácido hialurónico que tiene una densidad media de cargas negativas más alta que el fucoidán, no exhibió actividad de disgregación de rosetas mientras que el fucoidán sí lo hizo. La comparación entre la heparina y el fucoidán, por otra parte, sugiere que el efecto de un posicionamiento correcto en una estructura tridimensional podría ser mucho más esencial que la cantidad media de carga negativa, que es claramente inferior en el fucoidán Patankar y col. 1993). Una asociación a cargas negativas podría ser la explicación de las diferencias entre heparina y HS, aunque no se pueden excluir determinantes más específicos de las secuencias. Cuando se realizan ensayos con la cepa FCR3S1 sensible a heparina/HS se evidencia que las preparaciones de heparinas modificadas con un grado global de sulfatación reducido, y por lo tanto con una carga negativa, pierden capacidad de competición aunque no de una manera estrictamente dependiente de la carga. Este descubrimiento apoya la conclusión de que otros determinantes deben tener importancia para la unión a eritrocitos infectados. Preparaciones de heparina N-desulfatada fueron reversoras de rosetas al menos 100 veces más débiles comparadas con la heparina. En contraste con el efecto de la N-desulfatación, la O-desulfatación pareció estar relacionada con una menor reducción de la eficiencia de la competición, lo que indica la importancia del tipo de sulfato, es decir de la N-sulfatación. Se puede 18 ES 2 257 818 T3 5 10 15 20 25 sacar una conclusión análoga mediante la comparación de la heparina, el revertidor de rosetas más eficiente, con el HS. Una de las diferencias básicas entre la heparina y el HS es el grado y la distribución de los grupos N-sulfato que a su vez conduce a un posicionamiento predominante de la O-sulfatación en relación con bloques N-sulfatados (Salmivirta y col. 1996). La N-sulfatación alcanza el 40%-60% de todos los disacáridos en una cadena de HS media (Maccarana y col. 1996) mientras que este valor en el caso de la heparina es de más del 90%. Verdaderamente, la diferencia en el efecto de competición entre la heparina y el HS en la formación de rosetas se podría explicar debido a la presencia más abundante de N-sulfatación en la heparina. Para determinar mejor la importancia de la posición de la sulfatación sobre la característica aniónica de un carbohidrato, se realizaron ensayos con monosacáridos y disacáridos derivados de heparina/HS con respecto a la actividad disgregadora de rosetas. Se sometieron a ensayo 29 muestras clínicas de tipo salvaje con respecto a la sensibilidad frente a la heparina y frente al disacárido 1-S de la heparina (∆HexA(2-OSO3 )-GlcNSO3 -(6-OSO3 )), y el patrón de sensibilidad obtenido fue muy similar para los dos compuestos a concentraciones equipotentes, mientras que pudo diferir del de otros GAG y polisacáridos. Los resultados de los autores de la invención hablan por lo tanto a favor de un sitio idéntico de acción para la heparina y para el disacárido 1-S de la heparina, sugiriendo que los resultados que se obtienen con monosacáridos y disacáridos reflejan al menos parte de los sitios de unión a heparina/HS situados sobre los eritrocitos infectados. La carga molecular negativa neta no puede explicar por sí misma la actividad de anti-formación de rosetas: algunos monosacáridos con una carga negativa alta no exhibieron efecto disgregador de las rosetas, mientras que otros monosacáridos con una única carga negativa disgregaron rosetas. Así mismo, el hecho de que un grado de sulfatación más alto no aumentó la potencia de reversión de rosetas, corrobora que es la posición del grupo(s) sulfato más que su número lo que es el factor determinante. En el caso de los disacáridos, la 6-O-sulfatación parece ser menos importante, mientras que el 2-O-sulfato tiene cierto efecto positivo añadido al del grupo N-sulfato. Esto se podría explicar por la libertad rotacional de la unión glucosídica que da como resultado la posible exposición de ambos grupos sulfato sobre el mismo lado del plano del azúcar, mientras que el 6-O-sulfato se proyectaría en el lado opuesto. Así mismo, la glucosamina N-sulfatada (presente en la heparina y en el HS) suprime la formación de rosetas, mientras que su estereoisómero, la galactosamina N-sulfatada (no presente en ningún GAG) no lo hace, todo lo cual enfatiza que la glucosamina N-sulfatada es parte de la secuencia de unión. 30 35 40 Para analizar si la competición por parte de heparina y de oligosacáridos derivados de heparina refleja la existencia de un ligando semejante a heparina/HS sobre los eritrocitos, cultivos totales y eritrocitos no infectados se trataron con diferentes procedimientos de degradación de glucanos. En el caso de la cepa FCR3S1 sensible a heparina/HS se provocó una clara disminución de la formación de rosetas tanto mediante una oxidación de glucanos inespecífica con peryodato como mediante una digestión selectiva de cadenas de heparina/HS por acción de heparinasa (Fig. 6). La formación de rosetas no fue impedida por ninguno de los tratamientos de los cultivos con condroitinasa, neuroaminidasa o fosfolipasa C, lo que apoya la opinión de que la naturaleza del ligando es de tipo heparina/HS. El tratamiento proteolítico de los cultivos, por otro lado, indicó que en el mecanismo de formación de rosetas también están implicados componentes proteináceos, ya sea como ligandos semejantes a lectinas (es decir, sobre el eritrocito infectado) o como molécula transportadora de los epítopos de glucanos (es decir, sobre el eritrocito no infectado). La formación de rosetas por la cepa TM284 pareció ser más sensible a la competición por parte del sulfato de condroitina y del sulfato de dermatán, aunque también fueron eficaces cantidades más altas de heparina/HS. Estas observaciones se confirmaron mediante un tratamiento enzimático de los eritrocitos ya que la condroitinasa tuvo un profundo efecto sobre la formación de rosetas. 45 50 55 60 65 El tratamiento independiente de eritrocitos no infectados se realizó con el fin de establecer si los eritrocitos infectados o si los eritrocitos no infectados formadores de rosetas contenían características específicas implicadas en la formación de las rosetas. La sensibilidad más alta de los eritrocitos no infectados a la destrucción de glucanos implicaría que estructuras de tipo glucano constituyen partes del receptor(s) en la formación de rosetas. El razonamiento opuesto sería válido para el componente destruido proteolíticamente que parece estar situado en el lado de los eritrocitos infectados, aunque también una parte de los glucanos podría ser retirada mediante escisión proteolítica de las proteínas de su región central. Sin embargo, los eritrocitos infectados parecen ser mucho más sensibles a la degradación proteolítica en comparación con a la oxidación de glucanos. Se ha sugerido con anterioridad que la formación de rosetas puede estar mediada por interacciones de tipo lectina, con implicación no obligatoria de diferentes antígenos de los grupos sanguíneos AB0 (Carlson y col. 1992). También se ha atribuido a CD36 una función de receptor (Handunnetti y col. 1992) y recientemente, se ha publicado que el receptor 1 del complemento desempeña un papel en la formación de las rosetas (Rowe y col. 1997). El hecho de que la sensibilidad a la heparina disminuye cuando los mismos parásitos se cultivan en eritrocitos de su grupo sanguíneo AB0 preferido (Carlson y col. 1992) podría indicar una implicación simultánea de más de un único receptor en la formación de rosetas y que la heparina no interacciona con estos receptores. También se ha demostrado la existencia de un papel de las proteínas séricas en la formación de las rosetas (Scholander, 1996). Aunque no se puede excluir una interacción de los GAG con factores séricos, este efecto tendría una importancia pequeña ya que cepas con diferentes dependencias a suero se afectaron de la misma manera (datos no mostrados). Además, una proteína de fusión recombinante que cubre el dominio de unión semejante a Duffy (DBL-1) situado en posición C-terminal de PfEMP1, se adhirió directamente a los eritrocitos y se unió a una matriz que contenía heparina, en ausencia de factores séricos (Chen y col. 1998). 19 ES 2 257 818 T3 5 10 Como conclusión, la presente invención proporciona la identificación, mediante una RT-PCR de células aisladas y clonación del cDNA, de una nueva variante de la proteína 1 de membrana de eritrocitos infectados por Plasmodium falciparum, PfEMP1, que es un ligando de adhesión. Las rosetas de la nueva variante PfEMP1 contienen grupos de motivos de unión a glucosoaminoglucanos. Se ha encontrado que una proteína de fusión recombinante (DBL-1-GST) se adhiere directamente a los eritrocitos normales, disgrega las rosetas formadas de manera natural, bloquea una nueva formación de las rosetas y se une a una matriz de Sepharose-heparina. Las interacciones de adhesión se pudieron inhibir con sulfato de heparán o con enzimas que quitan el sulfato de heparán de la superficie de las células mientras que otras enzimas u otros glucosaminoglucanos con carga negativa parecida no tuvieron efecto sobre la unión. Además, se ha demostrado que el fucoidán, un glucano sulfatado, es particularmente eficaz en la disgregación de las rosetas. Se sugiere que la nueva variante PfEMP1 es el ligando de la formación de rosetas, y que los carbohidratos, sulfato de heparán, o una molécula similar a sulfato de heparán, son el receptor tanto en el caso de la unión de PfEMP1 como en el caso de las rosetas de eritrocitos formadas de manera natural. 15 20 25 30 35 40 45 50 55 60 65 20 ES 2 257 818 T3 REIVINDICACIONES 5 1. Un polipéptido aislado que se origina a partir de una proteína de membrana de eritrocitos infectados por malaria, que comprende 400-500 aminoácidos de la parte amino terminal de la secuencia según SEQ ID NO: 1. 2. El polipéptido según la reivindicación 1, capaz de establecer una unión específica con un resto semejante a un glucosaminoglucano de carga negativa. 10 3. El polipéptido según la reivindicación 1 ó 2, capaz de establecer una unión específica con un resto semejante a un glucosaminoglucano sulfatado. 4. Un método para preparar un polipéptido según cualquiera de las reivindicaciones 1-3, que comprende las etapas de: 15 (1) insertar en un vector de expresión un ácido nucleico que codifica dicho polipéptido; (2) transfectar una célula hospedadora capaz de expresar dicho ácido nucleico, con dicho vector de expresión, para expresar dicho polipéptido; y 20 (3) recuperar dicho polipéptido expresado. 5. Un ácido nucleico que codifica un polipéptido según cualquiera de las reivindicaciones 1-3. 25 6. Una proteína de fusión recombinante que comprende un polipéptido según cualquiera de las reivindicaciones 13. 7. Un polipéptido según cualquiera de las reivindicaciones 1-3, para usar como medicamento. 30 8. Uso de un polipéptido según cualquiera de las reivindicaciones 1-3, en la fabricación de un medicamento para el tratamiento o la prevención de la malaria, o en la vacunación contra la malaria. 9. Uso según la reivindicación 8, en el que la infección de la malaria es una infección por P. falciparum. 35 10. Una composición farmacéutica que comprende un polipéptido según cualquiera de las reivindicaciones 1-3, en un vehículo farmacéuticamente aceptable. 11. Uso de un polipéptido según cualquiera de las reivindicaciones 1-3, para identificar in vitro sustancias que se unen a la proteína 1 de membrana de eritrocitos infectados por P. falciparum. 40 45 50 55 60 65 21 ES 2 257 818 T3 22 ES 2 257 818 T3 23 ES 2 257 818 T3 24 ES 2 257 818 T3 25 ES 2 257 818 T3 26 ES 2 257 818 T3 27 ES 2 257 818 T3 LISTA DE SECUENCIAS (1) INFORMACIÓN GENERAL: 5 (i) SOLICITANTE: (A) NOMBRE: KAROLINSKA INNOVATIONS AB (B) CALLE: TOMTEBOGATAN 10 (C) CIUDAD: ESTOCOLMO (E) PAÍS: SUECIA (F) CÓDIGO POSTAL: 171 77 (G) TELÉFONO: +46-(0)8-728 65 10 15 (H) TELEFAX: +46-(0)8-303423 (ii) TÍTULO DE LA INVENCIÓN: POLIPÉPTIDOS DE LA MALARIA (iii) NÚMERO DE SECUENCIAS: 1 20 (iv) FORMA DE LECTURA POR ORDENADOR: (A) TIPO DE MEDIO: Disco flexible (B) ORDENADOR: IBM PC compatible 25 (C) SISTEMA OPERATIVO: PC-DOS/MS-DOS (D) SOPORTE LÓGICO: PatentIn Release n.º 1.0, Versión n.º 1.30 (EPO) (2) INFORMACIÓN SOBRE EL SEQ ID NO: 1: 30 (i) CARACTERÍSTICAS DE LA SECUENCIA: (A) LONGITUD: 2.228 aminoácidos (B) TIPO: aminoácidos 35 (C) TIPO DE CADENA: monocatenaria (D) TOPOLOGÍA: lineal (ii) TIPO DE MOLÉCULA: péptido 40 (iii) HIPOTÉTICA: NO (v) TIPO DE FRAGMENTO: N-terminal (ix) CARACTERÍSTICAS: 45 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 79..86 (ix) CARACTERÍSTICAS: 50 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 102..107 (ix) CARACTERÍSTICAS: 55 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 201..207 (ix) CARACTERÍSTICAS: 60 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 221..232 (ix) CARACTERÍSTICAS: 65 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 341..350 1 ES 2 257 818 T3 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 377..382 5 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 411..418 10 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 533..549 15 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 569..576 20 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 646..651 25 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 688..693 30 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 941..949 35 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 1032..1039 40 (ix) CARACTERÍSTICAS: (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 1152..1159 (ix) CARACTERÍSTICAS: 45 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 1170..1175 (ix) CARACTERÍSTICAS: 50 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 1232..1239 (ix) CARACTERÍSTICAS: 55 (A) NOMBRE/CLAVE: Sitio de unión (B) SITUACIÓN: 1771..1777 (xi) DESCRIPCIÓN DE LA SECUENCIA: SEQ ID NO: 1: 60 65 2 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 3 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 4 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 5 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 6 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 7 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 8 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 9 ES 2 257 818 T3 5 10 15 20 25 30 35 40 45 50 55 60 65 10