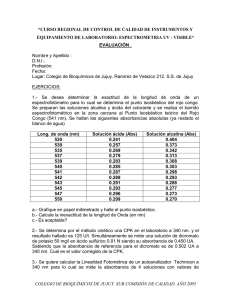
Estudios espectrofotométricos de formación de complejos. La
Anuncio

Estudios espectrofotométricos de formación de complejos. La espectrofotometría es una herramienta valiosa para determinar la composición y constantes de formación de especies que forman complejos en solución. Las mediciones de absorción son muy útiles para estudiar este tipo de sistemas ya que no afectan de manera importante al equilibrio que se esta estudiando (al menos en la mayoría de los casos). Las técnicas más comunes que se utilizan para los estudios complejo-ion son 1) método de las variaciones continuas, 2) método de la relación molar, 3) método de la relación de pendiente y 4) método de ajuste de curvas con ayuda de computadora. Método de las variaciones continuas. En este método, las soluciones del catión y del ligando con concentraciones analíticas idénticas se mezclan de tal manera que el volumen total y la cantidad total de mols de los reactivos en cada mezcla son constantes, pero la relación molar de los reactivos varía en forma sistemática, por ejemplo, 1:9, 8:2, 7:3, etc. Entonces se mide la absorbancia de cada solución en una longitud de onda apropiada y se corrige por cualquier absorbancia que la mezcla pudiera manifestar si no ocurriera reacción alguna. Por ejemplo, si el ligando absorbe, la absorbancia corregida sería la absorbancia de la mezcla de reacción menos la absorbancia del ligando si no hubiera reaccionado. La absorbancia corregida se grafica contra la fracción en volumen de un reactivo, es decir, VM/(VM + VL), donde VM es el volumen de la solución del catión y VL es el volumen de la solución del ligando. En la gráfica se presenta un máximo, o un mínimo si el complejo es menos absorbente que los reactivos, cuando se da una relación de volumen VM/VL que corresponde a la relación de combinación del catión y el ligando en el complejo. La curvatura de la gráfica obtenida es el resultado de que la reacción de formación de complejos es incompleta (la formación de un complejo nunca es al 100% siempre queda un ε que no reacciona, el valor de ε es de mayor o menor grado dependiendo del sistema en estudio). La constante de formación del complejo se puede evaluar mediante mediciones de las desviaciones respecto a las líneas rectas teóricas, las cuales representan la curva que resultaría si la reacción entre el ligando y el metal fuese completa. Es posible manejar modelos matemáticos para facilitar el cálculo del valor Kf o se pueden aplicar métodos de ajuste de curvas con ayuda de computadoras. Método de la relación molar. En este método se prepara una serie de soluciones en las cuales la concentración analítica de un reactivo, casi siempre el catión, se mantiene constante mientras la del otro varía. Luego se elabora una gráfica de la absorbancia contra la relación molar de los reactantes. Si la constante de formación es razonablemente favorable, se obtienen dos rectas de diferentes pendientes que se cortan en una relación molar que corresponde a la relación de combinación en el complejo. Cambien en este caso se encuentra una desviación a la linealidad en la cercanía de la relación molar correspondiente al complejo debido a que la cuantitatividad de la reacción no es al 100%. Cuanto más cercana es la curva a las rectas extrapoladas; cuanto más grande es la desviación respecto a las rectas, más pequeña es la constante de formación del complejo. La constante de formación se puede evaluar a partir de los datos de la porción curva de las gráficas de relación molar donde la reacción es menos completa. Si se forman dos o más complejos, podrían ocurrir cambios sucesivos de la pendiente en la gráfica de la relación molar siempre que los complejos tengan distintas absortividades molares y constantes de formación. Método de la relación de pendientes. Este método es útil en particular para complejos débiles, pero es aplicable sólo a sistemas en los cuales se forma un complejo sencillo. En el método se supone que 1) la reacción de formación de complejos puede ser forzada a terminar mediante un exceso de cualquier reactivo y 2) en estas condiciones se cumple la ley de Beer. Considere la reacción en la cual se forma el complejo MxLy mediante la reacción xM + yL ⇆ MxLy Las expresiones de balance de masa para este sistema son CM = [M] + x[MxLy] CL = [L] + y[MxLy] donde CM y CL son las concentraciones molares analíticas de los dos reactivos. Ahora se supone que a concentraciones analíticas muy altas de L, el equilibrio se desplaza en forma marcada a la derecha y [M] << x[MxLy]. En estas condiciones, la primera expresión de balance de masa se simplifica a CM = x[MxLy] Si el sistema se apega a la ley de Beer A1 = εMxLyb[MxLy] = εMxLybcM/x Una gráfica de absorbancia en función de cM es lineal cuando hay suficiente L presente para justificar la suposición de que [M] << x[MxLy]. La pendiente de la gráfica es εMxLyb/x. Cuando cM es muy grande, se supone que [L] << y[MxLy], y la segunda ecuación de balance de masa se reduce a cL = y[MxLy] y A2 = εMxLyb[MxLy] = εMxLybcL/y. Una vez más, si las suposiciones que se han hecho son válidas, se tiene que una gráfica de A contra cL es lineal a altas concentraciones entre M y L: M L b / x x y M L b / y x = y x y Métodos ejecutados con computadora para determinar las constantes de formación de complejos. Principios. Considere la formación de un complejo ML 1:1 formado por el ion metálico M y el ligante L. M + L ⇆ ML Kf = [ML] [M][L] si el ion metálico no complejado y el complejo absorben radiación a la longitud de onda del análisis, es posible escribir A = εMLb[ML] + εMb[M]. La expresión para el balance de masa en el caso del ion metálico es cM = [M] + [ML] Si se despeja [M] y se sustituye en la ecuación de absorbancia para obtener A = εMLb[ML] + εMb(cM - [ML]) = εMLb[ML] + εMbcM - εMb[ML] Cuando la concentración del ligando es cero, [ML] = 0 y la absorbancia AL=0 se calcula mediante AL=0 = εMbcM Combinando las dos ecuaciones anteriores y reacomodando términos se llega a ΔA = A – AL=0 = εMLb[ML] – εMb[ML] = ΔεMb[ML] donde ΔA es la diferencia en absorbancia con y sin el ligante presente, y Δε es la diferencia en las absortividades molares de ML y M. A partir de la expresión de la constante de formación se puede escribir [ML] = Kf x [M][L]. Además, si los experimentos e efectúan en presencia de un exceso de ligando, CL ̴ [L]. Si se sustituyen estas expresiones y el balance de masa en el ΔA se obtiene A = K f cL [M] = K f c L c M−[ML] b Se efectúan algunas operaciones en esta expresión para obtener A K f c L cM = b 1 K f cL Esta ecuación es el fundamento de varios métodos que se resuelven mediante computadora para determinar la constante de formación Kf. En el experimento común, se usa una concentración constante de metal y se varía la concentración del ligando cL. Luego se mide el cambio de la absorbancia ΔA en función de la concentración total del ligando, y se analizan desde el punto de vista estadístico los resultados para obtener Kf. Por desgracia, la relación entre ΔA y Kf es no lineal y, por consiguiente, se tiene que aplicar la regresión no lineal. Es posible hacer lineal la ecuación si se obtienen el recíproco de ambos miembros: 1 K f cL b 1 1 = = A K f c L cM K f c L cM cM Como se puede observar al graficar b/ΔA contra 1/cL se puede obtener el valor de Kf al calcular la pendiente de la recta. Algunas veces, esta ecuación se llama ecuación de Benesi-Hildebrand. De cualquier manera se considera más confiable la regresión no lineal, para lo cual hay que tener una paquetería como Origin que genera este tipo de ajuste. Punto isosbéstico. Un caso particular de calculo de constante de equilibrio se presenta en los sistemas ácidobase donde tanto la forma ácida como alcalina absorben radiación electromagnética. Al trazar el espectro del visible a diferentes valores de pH se encuentra que los diferentes espectros obtenidos se cruzan en un punto determinando, este punto se conoce como punto isosbéstico y se caracteriza por que la absortividad molar de la forma ácida y alcalina es la misma en ese punto. Los indicadores ácido-base son un ejemplo de la dependencia de la absorción molecular de la luz y del pH de la disolución ya que la forma protonada del indicador presenta una coloración y la desprotonada presenta otra. La medición de la medición de la absorbancia, a diferentes valores de pH impuesto en disolución permite deducir el valor de pKa del indicador. Considerando el equilibrio [H '' ][I n'−' ] Ka= [HIn] Hin ⇆ H+ + In- si expresamos en forma logarítmica y despejamos el pH obtenemos pH = pK alog [In '−' ] [HIn] El balance de masa para este sistema se expresa como Co = [HIn] + [In-], si despejamos a la '−' [I n ] forma ácida y la sustituimos en la ecuación de pH obtenemos pH = pK alog C 0−[I n'−'] Si para nuestras mediciones de absorbancia seleccionamos la longitud de onda donde absorbe la forma alcalina entonces la absorbancia estará dada por concentración de la especie alcalina tenemos [I n'−' ] = '−' A = In b[I n ] despejando la A In In I n b In sustituyendo esta expresión en el I n pH obtenemos pH = pK alog A /In b In I n C 0− A / In b In In Si consideramos que a un pH muy alcalino el balance de masa estará representado por '−' C 0 = [I n ] pHmuy alcalino = ApHmuy alcalino In b lambdaIn Incluyendo esta relación en la expresión del pH pH = pK alog A /I n In lambdaIn ApHmuy alcalino/ I n lambdaIn b b− A / I n In lambdaIn b eliminando los términos semejantes finalmente tenemos pH = pK alog A In ApHmuy alcalino− A In Entonces se puede obtener el pKa obteniendo la absorbancia de diferentes soluciones a pH conocido y tomando como referencia la absorbancia a pH muy alcalino donde la especie alcalina predomina. Como se puede ver el pKa es la ordenada al origen de la recta. Si es preferible hacer las mediciones en la longitud de onda donde principalmente absorbe la forma ácida se puede hacer un tratamiento similar para HIn y que la relación de absorbancias se refiera a esta especie. Este fenómeno fue empleado para determinar el pH de las disoluciones antes que el electrodo de vidrio fuera desarrollado. De hecho la determinación espectrofotométrica del pH aún se utiliza para calibrar electrodos selectivos de pH o en medios no acuosos en los cuales dichos electrodos no pueden utilizarse. Por supuesto este método puede emplearse para determinar no solo el pKa de los indicadores ácido-base, sino el pK de pares redox o complejos. Otra aplicación del punto isosbéstico es como control de calidad espectrofotométrico en bioquímica clínica y química de alimentos. Fuente: D. A. Skoog, F. J. Holler, S. R. Crouch, Principios de análisis instrumental, 6ta edición, Cengage Learning, México, 2008.