Vitamina
Coenzima
Acido ascorbico (C)
no es una coenzima
Niacina
NAD(P)+/NAD(P)H
Riboflavina (B2)
FMN & FAD
Tiamina (B1)
Thiamin-pyrophosphate
Piridoxal (B6)
Pyridoxal phosphate
Biotina
Biotina
Folato
Tetrahidrofolato
Cobalamina (B12)adenosyl-and methylcobalamin
Vitamina A
Retinal
Vitamina K
Vitamina K
Pantotenato (B3)
Coenzima A
Niacina
nicotinamida
Vitamina B2 = riboflavina
NAD+
(NADP)
Riboflavinamonofosfato (FMN)
FAD+
Coenzima Q
Citocromas
Citc, citc1
citb
Cita, cita3
Grupo hemo unido covalentemente
(enlaces tioester con dos residuos cisteina)
Grupo hemo unido no-covalentemente
(grupo hemo hierro-protoporfirina IX)
Grupo hemo A, hierro-porfirina diferente
1
citocroma con grupo prostetico hem
UBIQUINONA
2
CENTROS FERRO-SULFURADOs
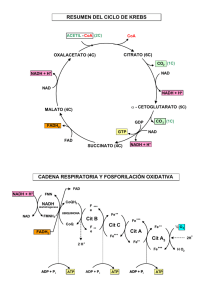
Complejos enzimaticos de la cadena respiratoria
Transporte de electrones hasta el aceptor final, el oxigeno, para formar H2O
Complejo enzimatico
(I)
Procesos conversion de energia
(II)
FMN
FeS
Succinato Q reductasa
Succinato-Q-reductasa
FAD
FeS
QH2-citocromo c
hemo
hemo c1
FeS
(III)
(IV)
Grupo prostetico
NADH-Q reductasa
Citocromo c
hemo c
Citocromo c oxidasa
hemo a
hemo a3
Cu
Lado M
NADH
Succinato
medio
Lado C
Q
Q
Q
cit c
cit c1
cit a
O2
3
(I)
NADH-CoQ
reductasa
NADH
FMN
FeS red
Complejo I
Q
(II)
(III)
(IV)
Succinato-CoQ
reductasa
Coenzima Q citocroma c
reductasa
Citc
oxidasa
NADH-CoQ
reductasa
COMPLEJO I
NAD+
Succinato
FMNH
FeS ox
NADH-CoQ reductasa
FAD
FeS red
QH2
Q
COMPLEJO II
fumarato
QH2
Q
FADH2
FeS ox
Succinato-CoQ reductasa
QH2
Citb564
citb566
FeS red
citc1
citb562
citb566
FeS ox
citc1
citc
Fe3+
Fe2+
Fe3+
Fe2+
Fe3+
Fe2+
Coenzima Q - citocroma c reductasa
Fe2+
citc
Fe3+
COMPLEJO III
Citc
Fe2+
citc
Fe3+
Cita-CuA
Fe2+
Cita-CuA
Cita3-CuB
½ O2 + H+
Cita3-CuB
H2O
Fe3+
COMPLEJO IV
Citc oxidasa
Complejo II
Succinato-CoQ
reductasa
Complejo III
4
Complejo III
Complejo IV
Coenzima Q citocroma c
reductasa
Variaciones de Potencial REDOX y energía libre en la cadena respiratoria
DETECCION DE SECUENCIA DE TRANSPORTADORES ELECTRICOS
Azul: reducidos; rojo: oxidados
Isocitrato
Malato
Beta-OH-acil-CoA
glutamato
NAD+
FAD
Piruvato
Alfa-cetoglutarato
NADH,H+
ADP,Pi
FMN
Complejo I
(FeS)
ATP
Succinato
Glicerol-P
Acil-CoA
FADH2
ADP,Pi
ATP
CoQ
Citb562
Citb566
(FeS)
citc1
Complejo III
citc
ADP,Pi
ATP
H+ + O2
Cita-CuA
Cita3-CuB
Complejo IV
H2O
5
FOSFORILACION OXIDATIVA
Es el proceso en lo cual se produce ATP por los
electrones que son transferidas del NADH o FADH2 al
O2 en una serie de reacciones.
El asamblaje respiratorio esta localizado en la membrana
interior de la mitocondria. Los transportadores de los
electrones están organizados de manera vectorial. El flujo
de los electrones produce un gradiente de protones.
NADH,H+
FADH2
ATP
ATP
ATP
ATP
ATP
Hipótesis quimi-osmotica de Mitchell, 1961
HIPOTESIS QUIMIOSMOTICA
1961
de Peter Mitchell
1920-1992
Acoplamiento de transporte de electrones con fosforilación
oxidativa
-Membrana semipermeable
- se bombean protones del lado matriz al espacio entre
membranas, se forma un gradiente de protones
-Protones vuelvan a la matriz a través conducto de
protones (parte Fo de la ATP-sintasa)
-Síntesis de ATP (parte F1 de la ATP-sintasa, lado matriz)
El movimiento de protones tiene dos conscuencias mayores
(1) un gradiente de pH a traves de la membrana interna de la mitocondria
Propone que el transporte de electrones y la sintesis de ATP están
acoplados por un gradiente de protones (- más bien que por un intermediario
covalente de alta energía o una proteina activada)
La hipótesis incluye tres propuestas:
- la cadena de transporte de electrones genera un gradiente de protones
NADH, H+ + CoQ – 4 H+ NAD+ + CoQH2 + 4 H+
Dentro de matriz
fuera de matriz
-transporte vectorial de los H+
el transporte de protones ocurre in una dirección, del interior hacia afuera
- la membrana es impermeable para los protones gradiente de H+
GRADIENTE DE CARGA
Conc. H+ interno >> conc. H+ externo
= pH
(2) Un gradiente de voltaje (potencial de membrana)
Interior
++++++++++++++++
Membrana
=
Exterior
-------------- Gradiente electro-quimico = fuerza de protones (mV)
Cada pH equivale un potencial de membrana de 1 pH = 60mV
Por lo tanto la fuerza de protones + 60x (pH)
Ej.: en una típica célula la fuerza de protones en mitocondrias respirando
es aproximadamente 220mV
= 160mV
Total 160mV + 60 mV = 220 mV
pH = -1
Otro complejo, que esta ubicado en la membrana interior, es el complejo de la
ATP-sintasa
El gradiente de protones creado por la cadena del transporte de electrones habilita
a este complejo enzimatico sintetizar ATP cuando los protones fluyen de vuelta a la
matriz del mitocondrio
GRADIENTE DE PROTONES
Este complejo puede ser dividido facilmente en dos componentes
F1: cinco subunidades,
subunidades actividad enzimatica de ATP sintasa
Fo: proteina integral, canal de protones
“Proton-motiv-force”
6
citosol
mitocondrio
Espacio entre membranas
F0
3 H+
matriz
ADP, Pi
Complejo V
F1
ATP
ATP-sintasa
ATP síntesis:
catálisis rotacional
Animación:
http://www2.uah.es/biomodel/biomodel-misc/anim/metab/atp-sint.html
http://www2 uah es/biomodel/biomodel misc/anim/metab/atp sint mec html
http://www2.uah.es/biomodel/biomodel-misc/anim/metab/atp-sint-mec.html
7
Generacion de calor por mitocondrias desacoplados
Desacoplador:
- agente que disipa el gradiente de H+
Ej. 2,4-dinitrofenol
Producción de ATP
- Fosforilación a nivel de sustrato
- FOSFORILACION OXIDATIVA
Resumen de la degradación de glucosa en condiciones aerobicas:
Glucosa + 36 ADP + 36 Pi + 36 H+ + 6 O2 6 CO2 + 36 ATP + 42 H2O
8
Algunas proteínas de los complejos de la fosforilaciòn
oxidativo están codificados en el DNA mitocondrial
Estrés oxidativo
- Observaciones en recien nacidos?
- droga para perder peso?
Para reforzar visite por ejemplo:
http://www2.uah.es/biomodel/biomodel-misc/anim/metab/t-e-mitoc.html
http://www2.uah.es/biomodel/biomodel-misc/anim/metab/atp-sint.html
http://www2 uah es/biomodel/biomodel misc/anim/metab/atp sint mec html
http://www2.uah.es/biomodel/biomodel-misc/anim/metab/atp-sint-mec.html
http://www.science.smith.edu/departments/Biology/Bio231/etc.html
Además adjunto información adicional:
Coenzimas derivadas de vitaminas
• tienen que ser obtenidas de la dieta
• son sintetizadas por microorganismos y
plantas
• deficiencia
d fi i
i de
d vitaminas
it i
lleva
ll
a
enfermedades
• la mayoría de vitaminas tienen que ser
transformadas enzimaticamente para
funcionar como coenzima
9
NIACINA
NICOTINAMIDE MONOPHOSPHATE
N
Vitamina
Acido ascorbico (C)
Niacina
Riboflavina (B2)
Tiamina (B1)
Piridoxal ((B6)
Biotin a
Folato
Cobalamina (B12)
Vitamina A
Vitamina K
Pantotenato (B3)
H
NICOTINAMID
O
O
C
C
OH
N
NH2
N
NICOTINIC ACID
NICOTINAMIDE
(NIACIN)llevan a “pellagra” (dermatitis, diarrhea,
• Deficiencia
dementia)
• Se requiere en cantidades relativamente altas en
relacion a otras vitaminas
• No una verdadera “vitamina” porque puede ser
sintetizada a partir de triptofano en el hígado
O
C
NH2
Nicotinamid coenzimas
N
O
H2
C
O
PO2-
OH
OH
NH2
O
ADENOSINE MONOPHOSPHATE
Coenzima
no es una coenzima
NAD(P)+/NAD(P)H
FMN & FAD
Thiamin-pyrophosphate
Pyridoxal
y
phosphate
p
p
Biotina
Tetrahidrofolato
adenosyl-and methylcobalamin
Retinal
Vitamina K
Coenzima A
N
PO2-
H
O
C
CH2
O
N
C
NH2
N
NH2
N
N
R
R
OH
OH(OPO3)
O
H
H
N
O
OXIDIZED
REDUCED
NAD+ / NADP+
• Sirven de cofactor en reacciones de oxido-reducción
Riboflavina
Vitamina B2
• Funcionan como co-sustrato de dehidrogenasas
• La reducción del NAD+/NADP+ y la oxidación del
NADH/NADPH implica dos electrones a la vez
• Funcionan en transferencia de iones de hidro
• en reacciones catabólicas se forman NADH/NADPH
• NADH esta acoplada a la producción de ATP en las
mitocondrias
• NADPH es un agente de reducción muy importante
en reacciones biosinteticos
• Las formas reducidas, NADH/NADPH, absorben luz
a la longitud de onda 340nm, las formas oxidadas,
NAD+/NADP+ no absorben
• Vitamina soluble en agua
• Deficiencia severa lleva a
retardo de crecimiento,
problemas reproductivas,
degeneración neuronal
• Carne, productos lacteos y
verduras de verde oscura,
legumbres y “grains” son
buenas fuentes de esta
vitamina
10
FMN/FAD
FAD y FMN pueden transferir uno
o dos electrones a la vez
Quinone
forma
Hidroquinone
forma
semiquinone forma
Tiamina pirofosfato TPP
Tiamina
• tiamina es la primera vitamina descrita (amina vital = vitamin)
• deficiencia lleva a la enfermedad Beriberi
(desorden neurologico, problemas del corazón, anorexia)
• Beriberi prevalece en paises menos desarrollados donde el grano
tratado (limpio, polished) constituye la mayoria de la dieta
• asociado con desordenes relacionados con alcohol (WernickesKorsofff sindrome, perdida de memoria, caminar de manera no
estable)
• Sirve de cofactor en reacciones de decarboxilacion de
ceto acidos
• también funciona como grupo prostetico en
transcetolasas, que catalizan la transferencia de unidades
de dos carbonos en el metabolismo de carbohidratos
El anillo tiazolium es la parte
activa del TPP
Piridoxal
OH
N
O
HOH2C
N
CH3
H
O
HOH2C
N
CH3
H
PYRIDOXINE
Ylid = a
molecule with
opposite
charges on
adjacent
atoms
H2C
HC
O
HOH2C
NH3
O
H 2C
PYRIDOXAL
PRYIDOXAMINE
NH3
O
HC
O
O
P
O
CH3
H
H 2C
O
O
H 2C
O
P
O
O
H2C
O
O
N
CH3
H
PYRIDOXAL 5' PHOSPHATE
N
CH3
H
PYRIDOXAMINE 5' PHOSPHATE
11
PiRIDOXAL-FOSFATO (PLP)
PLP en la reacción de
transaminación
O
- H2O
R
C
H
+
NH2
R
R2
+ H2O
ALDEHYDE
AMINE
C
H
N
R2
SCHIFF BASE
• Importante en el metabolismo de amino acidos
• unido a la enzima como una base de Schiff por la
reacción con lisina
• PLP funciona en transaminación, decarboxilación,
racemización, isomerización, eliminación de cadenas
laterales en reacciónes que involucran amino acidos
PLP en la reacción de decarboxilación de
amino acidos
12