INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA
Anuncio

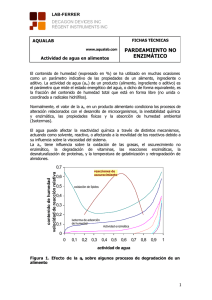
INSTITUTO POLITÉCNICO NACIONAL UNIDAD PROFESIONAL INTERDISCIPLINARIA DE BIOTECNOLOGÍA QUÍMICA Y FUNCIONALIDAD DE LOS ALIMENTOS PRÁCTICA 4 CINÉTICA DE OSCURECIMIENTO NO ENZIMÁTICO 1. OBJETIVOS a) Conocer como se produce la reacción de Maillard (oscurecimiento no enzimático) tanto en un alimento como en sistemas modelo. b) Determinar la cinética del oscurecimiento no enzimático en un alimento. c) Identificar los factores influyentes, tanto intrínsecos como extrínsecos de la reacción. d) Determinar el efecto del tipo de reactante (azúcar y aminoácido), pH y temperatura del medio, así como la presencia de un inhibidor en la rapidez de la reacción. 2. INTRODUCCIÓN Entre las reacciones que sufren los componentes de los alimentos se encuentran las de oscurecimiento oxidativo y no oxidativo. Estos fenómenos son muy importantes en el almacenamiento y procesamiento de los alimentos debido a sus repercusiones deseables o indeseables en el color, sabor y valor nutritivo de éstos. El primer tipo se refiere a las reacciones enzimáticas entre compuestos fenólicos (sustratos) y el oxígeno catalizadas por polifeloxidasas, por lo tanto no están implicados los carbohidratos. Entre los ejemplos se pueden citar los cortes de manzana, pera, plátano, aguacate, lechuga, etc. MANUAL DE PRÁCTICAS DE QUÍMICA Y FUNCIONALIDAD DE LOS ALIMENTOS Las reacciones de caramelización y Maillard comprenden el segundo tipo de oscurecimiento, no enzimático, ni oxidativo y donde si intervienen los carbohidratos. En la caramelización (pirólisis) los azúcares se deshidratan, fragmentan y polimerizan para producir melanoidinas a altas temperaturas, actividad acuosa muy reducida y en medio tanto ácido como alcalino. En la segunda (Maillard), reaccionan el grupo carbonilo reductor de azúcares con un grupo amino libre proveniente de aminas primarias, aminoácidos o proteínas en un medio alcalino y una actividad acuosa entre 0.6 y 0.9. El incremento de temperatura las favorece, aunque se han observado en condiciones de refrigeración, pues su energía de activación es baja. Su nombre se debe a que fueron descritas por primera vez por el químico francés L. C. Maillard en 1913. Mucho tiempo después, Hodge propuso un mecanismo en 1953, el cual sigue siendo el más aceptado hasta la fecha. En su etapa inicial, al reaccionar los grupos carbonilo y amino se forman las glucosilaminas; éstas a su vez producen aldosaminas o cetosiminas según el tipo de carbonilo por medio de la llamada transposición de Amadori o Heyns. La solución formada tiene la capacidad reductora, no presenta absorbancia de irradiaciones ultravioleta (UV) y no es colorida. En la etapa intermedia, los azúcares se deshidratan produciendo 5-hidroximetil-2-furaldehído, sus derivados y reductonas, se fragmentan, se producen compuestos –dicarbonilo (degradación de Strecker) e incipientemente pigmentos. Aquí la solución se torna amarillenta y existe escasa absorbancia en la región UV cercana. Finalmente se forman los pigmentos, melanoidinas, ya sea en forma coloidal o insolubles, resultado de condensaciones complejas de aldoles y polimerizaciones. La solución adquiere un color rojizo o hasta un café muy oscuro, presenta fluorescencia (absorbancia a 420 y 490 nm) y su aroma es similar al del caramelo. Los productos lácteos y de cereales pueden sufrir este tipo de oscurecimiento no enzimático. 3. INVESTIGACIÓN PRELIMINAR a) Describir en un diagrama las reacciones por etapas que comprenden al oscurecimiento tipo Maillard de los alimentos. b) Explicar tanto los factores intrínsecos (tipo de reactantes) y los extrínsecos (pH, temperatura y actividad acuosa) que influyen en el desarrollo del oscurecimiento c) Proporcionar ejemplos de alimentos donde se desee la reacción de Maillard y sea indeseable, señalando los efectos positivos y negativos. 18 PRACTICA 4 MANUAL DE PRÁCTICAS DE QUÍMICA Y FUNCIONALIDAD DE LOS ALIMENTOS d) Explicar la desventaja nutricional de este tipo de oscurecimiento y las formas de su control. e) Describir brevemente en que consisten las otras reacciones de oscurecimiento y señalar sus efectos positivos y negativos. 4. MATERIALES Y REACTIVOS Agitadores Termómetro Balanza analítica Tubos de ensaye 18 x 150 Baños de agua con regulador de Agua destilada temperatura Cronómetro Leche en polvo descremada Charolitas de aluminio para pesar Solución al 10% de ácido cítrico Espátulas Solución al 0.3% de metabisulfito de sodio (Na2S2O4) Espectrofotómetro con tubos Solución saturada de lisina Estufa Solución saturada de glicina (25g en 100 mL) Gradillas Solución al 64.2% de fructosa Matraces aforados de 50 y 100 mL Solución 0.5N de NaOH Pipetas de 2 y 5 mL Solución al 64.2% de glucosa Pinzas 5. DESARROLLO EXPERIMENTAL 5.1. CINÉTICA DE OSCURECIMIENTO a) Se cubren 6 charolitas de aluminio con la leche en polvo descremada y se les coloca en la estufa a 125°C. Al cabo de 10, 20, 30, 40, 50 y 60 minutos se van sacando de la estufa. b) Tomar de cada charola 12 g y disolver con 10 mL de agua destilada perfectamente bien. Se realiza el experimento por duplicado. c) Calibrar el espectrofotómetro con agua destilada a cero de absorbancia y a una longitud de onda de 430 nm. Leer la absorbancia de cada solución. Reportar los resultados multiplicando el valor de absorbancia por el factor de dilución. Construir una curva con los valores medios de tiempo contra absorbancia. 19 PRACTICA 4 MANUAL DE PRÁCTICAS DE QUÍMICA Y FUNCIONALIDAD DE LOS ALIMENTOS 5.2. EFECTO DEL TIPO DE REACTANTES, TEMPERATURA, pH E INHIBIDOR Se preparan de acuerdo al cuadro las siguientes mezclas, calentando a 70°C. Se miden y anotan los tiempos en que se produce un cambio en la coloración en cada tubo. Efectuar por duplicado cada mezcla. Cuadro 1. Volúmenes de los reactivos Tubo Glicina Glucosa Fructosa Sacarosa Na2S2O4 NaOH Ácido Tiempo (mL) (mL) (mL) (mL) (mL) (mL) cítrico (min) (mL) Testigos A B C Muestras 1 2 3 4 5 6 7 8 1.5 1.5 1.5 3.5 - 3.5 - 3.5 - - - 1.5 1.5 1.5 1.5 1.5 1.5 1.5 1.5 3.5 3.5 3.5 3.5 - 3.5 3.5 3.5 3.5 - 2 2 - 2 2 - 2 2 Variables Tipo de aminoácido. Se efectúa la corrida como se indica en el cuadro sólo cambiando la glicina por lisina. Temperatura. Se realizan las corridas para los dos tipos de aminoácidos a 85°C en vez de 70°C. 6. INFORME DE RESULTADOS a) Discutir la cinética del oscurecimiento en leche a partir del gráfico elaborado, consultando la literatura correspondiente. b) Reportar las medias de los resultados del efecto de las distintas variables (segundo experimento) en sendas hojas de datos (cuatro en total). 20 PRACTICA 4 MANUAL DE PRÁCTICAS DE QUÍMICA Y FUNCIONALIDAD DE LOS ALIMENTOS c) Comparar con la literatura y discutir los tiempos de reacción con respecto: al tipo de aminoácido y azúcar empleados en cada reacción, a las sustancias modificadoras del pH y a la temperatura. d) Realizar observaciones y recomendaciones a la práctica. 21 PRACTICA 4