Ensayo de toxicidad crónica con microalgas clorofíceas
Anuncio

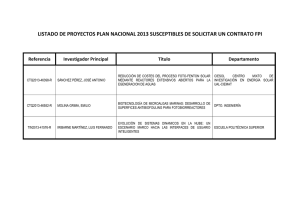
89 Ensayo de toxicidad crónica con microalgas clorofíceas Felipe Fernando Martínez-Jerónimo C lasificación del ensayo : AE Principio de la prueba Esta prueba se basa en la determinación de los efectos inhibitorios que sobre la tasa de crecimiento poblacional pueden producir los compuestos tóxicos puros, así como los contenidos en mezclas de composición conocida, en productos formulados o los que pueden estar presentes en muestras de agua o en efluentes con o sin tratamiento. Este ensayo se fundamenta en que una población microalgal, cuando se encuentra en condiciones propicias para su desarrollo, es capaz de aumentar su tamaño de población, por lo que en esas condiciones es posible detectar si los productos problema o muestras a analizar producen inhibición en la tasa de crecimiento poblacional. Las microalgas, como componentes del fitoplancton, constituyen el grupo de productores primarios que son fundamentales en todos los ecosistemas acuáticos, ya que determinan la productividad de los mismos y permiten el desarrollo de consumidores de 89 Amplia experiencia Ensayos de toxicidad crónica con microalgas clorofíceas 90 Ensayos para agua dulce diferente nivel trófico. Es por ello que resulta importante evaluar los efectos sobre este grupo de organismos. Siendo la tasa de crecimiento una respuesta sensible y fácil de monitorear, se puede evaluar la disminución de dicha respuesta como un indicador del estrés al cual están sujetas las poblaciones de microalgas. Este supuesto es válido para especies de microalgas que se reproducen asexualmente, por fragmentación o por la formación de autosporas. La tasa de crecimiento poblacional se puede medir directa o indirectamente, lo cual es una gran ventaja de esta prueba. Las mediciones directas se realizan mediante el conteo (en una cámara Neubauer o hemacitómetro) de los individuos en muestras representativas, mientras que las mediciones indirectas se obtienen a través de la determinación de la densidad óptica (o absorbancia) a una longitud de onda adecuada, el peso seco, el contenido de clorofila u otros pigmentos fotosintéticos, la concentración de proteínas, etc. Este método consiste en exponer a las microalgas a una serie de concentraciones o diluciones de las muestras problema, espaciadas geométricamente en base 2. En el bioensayo definitivo, la concentración mayor deberá inhibir completamente el crecimiento, en tanto que la tasa de crecimiento poblacional en la concentración menor no deberá diferir significativamente de la determinada para el tratamiento usado como control negativo. Se sugiere emplear como organismos de prueba a las microalgas clorofíceas Pseudokirchneriella subcapitata (anteriormente conocida como Selenastrum capricornutum o Raphidocelis subcapitata) (figura 6.1) o Ankistrodesmus falcatus (figura 6.2), que son especies de reproducción asexual y unicelulares, por lo que es sencillo realizar con ellas las cuentas para la determinación de la densidad celular, cuando se escoge a ésta como una medida directa del tamaño de la población algal. La respuesta medida es la inhibición en la tasa de crecimiento poblacional en un período de 96 horas de exposición. La ventaja de esta prueba es que es de fácil realización y proporciona una medida directa de los efectos sobre la población experimental expuesta. Esta prueba es adecuada para la evaluación de los efectos tóxicos crónicos de efluentes con o sin tratamiento, muestras de agua de cuerpos de agua receptores de descargas, compuestos puros y mezclas de composición conocida o desconocida, principios activos y productos formulados comerciales. Es útil además para la clasificación de la toxicidad de compuestos en el monitoreo de la calidad del agua en ecosistemas acuáticos y en la evaluación de la eficiencia de los sistemas de tratamiento de las aguas residuales. Ensayos de toxicidad crónica con microalgas clorofíceas 91 Figura 6.1. Microfotografía de Pseudokirchneriella subcapitata (antes denominada como Selenastrum capricornutum) (obtenida por microscopía de contraste de fases) Figura 6.2. Microfotografía de Ankistrodesmus falcatus (obtenida por microscopía de contraste de fases). Infraestructura en el laboratorio Para esta prueba se requiere que el laboratorio cuente con un área para trabajo en condiciones de esterilidad (cuarto de inoculación o campana de flujo laminar con filtración y esterilización de aire), además de área para esterilización 92 Ensayos para agua dulce de materiales y soluciones (con horno y autoclave). Adicionalmente, se deberá contar con una área acondicionada para el cultivo, la cual debe tener un sistema regulado de iluminación artificial con lámparas fluorescentes “luz de día”, con control de temperatura y con suministro de aire comprimido filtrado y libre de aceite. El suministro de aire se emplea sólo para la producción de inóculos y para la propagación de cultivos activos de la cepa, pues los bioensayos se realizan sin aireación, aunque en este último caso es deseable el contar con una placa agitadora orbital, a fin de evitar la sedimentación de las microalgas. También se puede evitar la sedimentación durante los bioensayos mediante agitación manual periódica. Material La cristalería que se requiere es la típica de un laboratorio, aunque debe incluir los materiales indispensables para el trabajo microbiológico, además de pipetas automáticas, propipetas, etc. De manera específica, se debe considerar que los ensayos toxicológicos se deben realizar en matraces Erlenmeyer de vidrio, de 50 o 125 mL de capacidad total, y tubos de ensaye con tapón de baquelita de 100 X 15. Equipo Los equipos requeridos son los básicos de cualquier laboratorio de análisis biológicos, los cuales incluyen: balanza analítica, microscopio óptico, estereomicroscopio, autoclave (de gas o eléctrica), potenciómetro, oxímetro salinómetro o conductivímetro y espectrofotómetro. Reactivos Es indispensable contar con los compuestos necesarios para la preparación del medio de cultivo para el crecimiento algal que se detallan más adelante. Este medio funciona también como agua de dilución para preparar las soluciones de la muestra problema durante el bioensayo. Para simplificar la preparación del medio de cultivo se sugiere la preparación de soluciones concentradas, que deberán conservarse en frascos herméticamente cerrados, protegidos de la luz y a baja temperatura. Todos los reactivos deberán ser grado analítico y de la máxima pureza posible, a fin de evitar exponer a los organismos a elementos traza o compuestos Ensayos de toxicidad crónica con microalgas clorofíceas 93 potencialmente tóxicos, lo que podría afectar la respuesta de las microalgas durante el bioensayo. Organismos de prueba La cepa utilizada debe provenir de un cepario o colección de laboratorio autorizado o certificado. Aunque particularmente A. falcatus es una especie que puede ser obtenida mediante colectas de muestras de fitoplancton de cuerpos de agua dulce, los procesos de aislamiento, purificación e identificación son laboriosos y tardados, por lo que es preferible adquirirla a través de un laboratorio que cuente con ella. Una vez obtenida, la cepa debe ser conservada de acuerdo a las instrucciones del proveedor, en refrigeración y en medio de cultivo solidificado con agar bacteriológico al 1.5%. La calidad microbiológica de la cepa debe ser revisada periódicamente, pues aun cuando no se requieren cepas axénicas, la carga bacteriana en la cepa unialgal debe ser reducida y la población algal nunca debe estar contaminada con hongos, protozoarios ni con otros organismos fotosintéticos, tales como las cianobacterias, que con relativa facilidad pueden contaminar a una cepa monoespecífica, sobre todo cuando no se realiza un manejo aséptico o cuando no se trabaja con medios de cultivo y materiales debidamente esterilizados. Cultivo y mantenimiento o almacenamiento de los organismos Las cepas se conservarán en tubos de ensaye de 150 X 15, con tapón de baquelita, que contendrán medio de cultivo solidificado mediante la adición de agar bacteriológico al 1.5%. También se recomienda mantener cultivos activos de la cepa en matraces de 125 o 250 mL. El mantenimiento de las condiciones asépticas en el medio de cultivo y en los materiales que se emplearán es fundamental para garantizar la calidad de respuesta de las microalgas; también se debe considerar que todo el manejo y conservación de las cepas, así como los procesos para realizar los bioensayos, presupone condiciones de esterilidad. El medio de cultivo sugerido es el recomendado por la Agencia para la Protección Ambiental de los Estados Unidos (USEPA, 2002), que se muestra en la tabla 6.1, el cual es adecuado tanto para la conservación de la cepa como para la propagación de los inóculos y como agua de dilución para los bioensayos. Sin embargo, para realizar cultivos de crecimiento rápido (preparación de inóculos) se recomienda, de manera adicional, el medio Basal de Bold que se muestra en la tabla 6.2. 94 Ensayos para agua dulce Tabla 6.1. Composición del medio de cultivo y agua de dilución para las pruebas de toxicidad con microalgas clorofíceas (USEPA, 2002) Macronutrientes Concentración Elemento (mg/L)* NaNO3 25.5 MgCl2•6H2O 12.2 CaCl2•2H2O 4.41 MgSO4•7H2O 14.7 K2HPO4 1.04 NaHCO3 15.0 Micronutrientes H3BO3 MnCl2•4H2O ZnCl2 CoCl2•6H2O CuCl2•2H2O Na2MoO4•2H2O FeCl3•6H2O Na2EDTA•2H2O Na2SeO4 (µg/L)* Concentración (mg/L)* N Mg Ca S P Na K C 4.20 2.90 1.20 1.91 0.186 11.0 0.469 2.14 Elemento (µg/L)* 185.0 B 416.0 Mn 3.27 Zn 1.43 Co 0.012 Cu 7.26 Mo 160.0 Fe 300.0 2.39 Se 32.5 115.0 1.57 0.354 0.004 2.88 33.1 0.91 *Las cantidades indicadas se diluyen en agua destilada o deionizada (con conductividad menor a 5 µS cm-1). Los medios de cultivo se preparan a partir de soluciones patrón o concentradas. Tanto para la propagación como para los bioensayos se requiere proporcionar iluminación continua con intensidad luminosa de 4,500 a 5,000 luxes y el crecimiento e incubación se logra a temperatura de 25 ± 1 °C. La calidad de respuesta de la cepa debe ser evaluada periódicamente con el compuesto tóxico de referencia, sulfato de cobre, evaluando la concentración media de inhibición (CI50). Los bioensayos en su fase de prueba definitiva, tienen duración de 96 horas. Ensayos de toxicidad crónica con microalgas clorofíceas 95 Tabla 6.2. Composición del medio de cultivo basal de Bold para el mantenimiento de cepas y propagación de microalgas clorofíceas Reactivo NaNO3 CaCl2•2H2O MgSO4•7H20 K2HPO4 KH2PO4 NaCl FeSO4•7H2O H2SO4 H3BO3 EDTA KOH ZnSO4•7H2O MnCl2•4H2O MoO3 CuSO4•5H2O Co(NO3)2•6H2O Concentración (mg/L)* 250 25 75 75 175 25 4.98 0.001 (ml/L) 11.42 50 31 8.82 14.4 0.71 1.57 0.49 *En agua destilada o deionizada. Procedimiento de prueba Preparación del material antes de la prueba Todos los materiales empleados deberán ser de vidrio de borosilicato, lavado de acuerdo al procedimiento complementario descrito en este documento, para eliminar todo vestigio de compuestos tóxicos que pudiera afectar los resultados en el bioensayo. Como se ha dicho, todo el manejo debe realizarse en condiciones asépticas, con materiales, medios de cultivo y soluciones esterilizadas de manera adecuada. Para ello puede usarse calor seco a 200 °C durante 1 hora, autoclave a 15 libras/pulgada2 por 15 minutos o filtración Millipore® con membranas estériles de 0.45 µm. En este último caso el equipo y membranas deben ser previamente esterilizados en autoclave. 96 Ensayos para agua dulce Desarrollo de la prueba El bioensayo es estático, sin renovación de la solución de prueba, realizándose siempre con soluciones acuosas de las muestras problema. Cuando se trate de materiales de baja hidrosolubilidad, se deberán emplear disolventes de baja toxicidad, como acetona, etanol, metanol o dimetil sulfóxido, teniendo siempre presente que su concentración no debe ser superior a 1 mL/L, independientemente de que se deberá implementar una segunda serie control que contenga la máxima cantidad de solvente utilizada. Se deberá evaluar el pH y la conductividad eléctrica de las muestras al inicio y al término de la prueba. Se ensayarán al menos 5 concentraciones o diluciones de los materiales a evaluar, contando cada una de ellas con al menos 3 réplicas. Los recipientes de prueba sugeridos son matraces Erlenmeyer de 50 o 125 mL, aunque también se pueden emplear tubos de ensaye de 100 X 15, de preferencia con tapón de baquelita o con tapones de algodón recubiertos de gasa. El volumen total de prueba será de 25, 75 o 7 mL. La temperatura debe ser de 25 ± 2 °C, la iluminación continua con intensidad de 4,500 a 5,000 luxes, proporcionada por lámparas fluorescentes “luz de día”. El inóculo inicial en todos los casos será de 10,000 células/mL. La respuesta evaluada será la densidad celular determinada a las 24, 48, 72 y 96 horas en todas las réplicas de todas las concentraciones y de la serie testigo, mediante conteo en la cámara Neubauer. Adicionalmente se deberán hacer observaciones al microscopio compuesto de muestras de los cultivos, para registrar posibles alteraciones en la morfología celular (con respecto a la serie testigo), así como determinar si ocurren cambios en los patrones de distribución citoplásmica de las células o en la coloración del cultivo. Para evaluar la densidad poblacional se empleará la cámara Neubauer o hemacitómetro y el microscopio compuesto al aumento de 40X. Se debe tener una variación máxima del 20% entre las dos cuentas de una misma muestra, de lo contrario se deberá repetir o aumentar el número de conteos por muestra, teniendo cuidado en el llenado de ambos lados de la cámara de Neubauer. La distribución de los recipientes de cultivo en el área de incubación deberá ser aleatoria, a fin de evitar sesgos por efectos diferenciales en la iluminación o en la temperatura. De manera resumida, el procedimiento de prueba se muestra en la tabla 6.3. Expresión de los resultados Se trazarán las curvas individuales de incremento poblacional para todas las concentraciones y el testigo, incluyendo en cada una, para cada tiempo, los datos de Ensayos de toxicidad crónica con microalgas clorofíceas 97 Tabla 6.3. Condiciones recomendadas para las pruebas de toxicidad crónica con microalgas clorofíceas Tipo de prueba Duración Iluminación Fotoperíodo Temperatura Aireación Recipientes de prueba Volumen de prueba Edad de cultivo al inóculo Densidad celular del inóculo Concentraciones o diluciones ensayadas Replicas por concentración Efecto medido Efectos adicionales medidos Periodicidad de las observaciones Criterio de aceptación de la prueba Estática sin renovación de la solución de prueba 96 horas (prueba definitiva) Artificial, controlada, con lámparas fluorescentes “luz de día” de 4,500 a 5,000 luxes Iluminación continua (24 horas luz:0 horas oscuridad) 25 ± 1 ºC No, agitación manual periódica durante toda la prueba Matraces Erlenmeyer de 50 o 125 mL o tubos de ensaye de 100 X 15, con tapón de baquelita o tapón de algodón 25, 75 o 7 mL 6 días (fase exponencial de crecimiento) 10,000 células/mL Mínimo 5, más el control negativo (prueba definitiva) Mínimo 3 Inhibición del crecimiento poblacional, medida como densidad celular Cambios en la morfología y el aspecto celular Cada 24 horas La densidad celular en el testigo, al término de la prueba (96 horas), debe ser superior a 1X106 células/mL y el coeficiente de variación para el control no debe exceder del 20% todas las réplicas, así como los valores promedio y las barras de error estándar para la densidad celular, que se expresará como células algales por mL. Adicionalmente, con los datos de densidad celular para todas las réplicas en cada concentración y en el control a las 96 horas, se realizará un análisis de varianza (ANOVA) de un factor, a fin de determinar si existen diferencias significativas entre las concentraciones y con respecto al control. Si el resultado del ANOVA es significativo, entonces se deberán realizar pruebas post hoc o comparaciones múltiples para determinar los tratamientos que difieren significativamente entre si. Se sugiere emplear métodos como el de Tukey, SNK o LSD; como complemento a estas comparaciones se aplicará la Prueba de Dunnett para determinar las concentraciones o diluciones que producen densidades celulares significativamente menores, con respecto al control negativo. El análisis de comparaciones múltiples también permite determinar los valores de 98 Ensayos para agua dulce LOEC, NOEC y la MATC (máxima concentración permisible del compuesto tóxico) o la concentración de seguridad para exposiciones crónicas. También con los datos promedio de densidad celular a las 96 horas se determinará el porcentaje de inhibición con respecto al control negativo y se calculará la concentración media de inhibición (CI50) o concentración efectiva media (CE50) e intervalo de confianza (P = 0.95%) a las 96 horas por el método que resulte más adecuado (Probit, Logit, Binomial o Ángulos Móviles Promedio). La inhibición se determinará como porcentajes de disminución en la densidad celular con respecto a la densidad celular promedio alcanzada en la serie utilizada como control negativo. En caso de que se detectaran efectos estimulatorios (mayor crecimiento poblacional en alguna concentración de la muestra problema que la registrada en el control negativo) no se incluirán esos datos para la determinación de la CE50, a fin de evitar errores en su estimación, aunque esto deberá quedar reflejado en las gráficas de crecimiento poblacional. Si este fuera el caso y si además se determinara que el efecto es significativo, se deberán discutir las posibles causas de la estimulación. Este ensayo es semejante a los protocolos de prueba propuestos como métodos estandarizados por la Agencia de Protección Ambiental de los Estados Unidos de América (USEPA, 1996), la Sociedad Americana de Evaluación y Materiales (ASTM, 2004) y la Organización para la Cooperación y el Desarrollo Económico (OECD, 1984). Bibliografía Andersen, R. A. (ed.). 2005. Algal culturing techniques. Phycological Society of America, Elsevier Academic Press, Amsterdam. 578 pp. American Society of Testing and Materials (ASTM). 2004. E 1218 – 04, Standard guide for conducting static toxicity tests with microalgae, ASTM International, West Conshohocken, PA 19428-2959, United States. 14 pp. Organization for the Economical Cooperation and Development (OECD). 1984. Alga, growth inhibition test, OECD Guideline for Testing of Chemicals No. 201. United Nations. 2005. Globally Harmonized System Of Classification and Labeling of Chemicals (GHS). Primera ed. revisada, ST/SG/AC.10/30/Rev.1, Nueva York y Ginebra. 526 pp. United States Environmental Protection Agency (USEPA). 1996. Algal toxicity. Tiers I and II. Ecological effects test guidelines. OPPTS 850.5400. EPA 712–C–96–164. ———. 2002. Short term Methods for estimating the chronic toxicity of effluents and receiving waters to freshwater organisms. Cuarta edición. U.S. EPA Office of Water, Washington, D.C. EPA-821-R-02-013. 335 pp.