proyecto plataforma virtual prueba saber 11 colegio
Anuncio

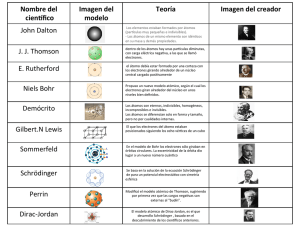
PROYECTO PLATAFORMA VIRTUAL PRUEBA SABER 11 COLEGIO ANDRES BELLO QUÍMICA PROFESORA: ADRIANA GUTIERREZ RIVAS GRADO 11 SAN JOSE DE CÚCUTA 20/07/12 1451. El elemento Q reacciona con el oxígeno formando el monóxido o el dióxido dependiendo de la temperatura, según la tabla Sabiendo que el número de oxidación del oxígeno es 2-. Con relación al número de oxidación del elemento Q se puede inferir que a. Su magnitud es 1 b. Tiene signo positivo c. Es de magnitud 3 d. Es igual al del oxígeno 1452. Con base en la información de la siguiente gráfica el elemento Te tiene a. mayor tamaño atómico que el elemento S y que el elemento Fr b. mayor electronegatividad que el elemento Fr y que el elemento S c. mayor electronegatividad que el elemento Po y que el elemento Fr d. menor tamaño atómico que el elemento H y que el elemento Po ANALIZA EL SIGUIENTE ESQUEMA Y RESPONDE LAS PREGUNTAS 1453 Y 1454 2 1453. El científico que introduce un modelo atómico nuclear con las siguientes características: Existe un núcleo cargado positivamente en el que se encuentra concentrada toda la masa. Los electrones giran alrededor de un núcleo en un número igual a la carga positiva del núcleo. La carga positiva del núcleo coincide con el número del orden del elemento en el sistema periódico, es decir su número atómico. Dicho autor corresponde a a. Thompson b. Dalton c. Rutherford d. Böhr 1454. El modelo atómico de Thompson explica a. La materia no está constituida por átomos b. Los átomos tienen un núcleo muy pequeño donde se concentra casi toda la masa c. Los átomos son los responsables de los fenómenos eléctricos naturales d. Los electrones saltan a distintos niveles de energía ANALIZA LA SIGUIENTE IMAGEN Y RESPONDE LAS 1455 Y 1456 1455. El número atómico del átomo representado en la siguiente imagen es a. 7 b. 17 c. 10 d. 8 1456. La masa atómica está representada en el átomo corresponde a a. 17 b. 18 c. 35 d. 52 DE ACUERDO CON LA SIGUIENTE TABLA RESPONDA LAS PREGUNTAS 1457 A LA 1460 ATOMOS X Y Z 1457. 1458. 1459. 1460. PROTONES ELECTRONES NEUTRONES CARGA 19 18 20 +1 20 18 20 +2 19 19 21 0 De acuerdo con la información presentada en la tabla es válido afirmar que a. X y Y son átomos de un mismo elemento con diferente carga b. Z es el catión del elemento Y c. X y Z son átomos de un mismo elemento diferente de Y d. X y Y tienen la misma masa atómica La mayor masa atómica corresponde a a. X = 19 b. Z y Y = 40 c. X y Y = 38 d. Z = 40 Son isótopos (átomos de un mismo elemento con diferente masa atómica) a. Y y Z b. Z y X c. X y Y d. Solo Y Son átomos isobaros a. X y Y b. Y y Z c. X y Z d. Solo Z LAS PREGUNTAS 1461 Y 1462 SE RESPONDEN TENIENDO EN CUENTA LA SIGUIENTE INFORMACION El número másico de un átomo se presenta como A = Z + N; donde Z corresponde al número atómico o número de protones, que en un átomo neutro equivale también al número de electrones y N representa el número de neutrones. La siguiente tabla muestra algunas características de tres elementos Elemento P G M Número X X+1 X+2 atómico Masa 19 20 23 atómica Número de 10 10 12 neutrones 1461. Es correcto afirmar que los números atómicos (X, X+1, X+2) para cada elemento son respectivamente a. 9; 10 y 11 b. 17; 18 y 19 c. 29; 30 y 31 d. 53; 54 y 55 1462. El número de protones, neutrones y electrones respectivamente del elemento G es a. 10; 10; 10 b. 11; 10; 11 c. 12; 12; 12 d. 11; 12; 10 1463. Para un elemento los valores A y Z son respectivamente 238 y 92 por lo tanto el número de neutrones es a. 92 b. 238 c. 146 d. 330 1464. Los átomos que ganan electrones cuando establecen un enlace químico para completar la regla del octeto tienen una carga a. Positiva b. Negativa c. Isoelectrónica d. Neutra 1465. Solo una de las siguientes afirmaciones no se puede tomar con una verdad absoluta a. Las cargas positiva repelen a las cargas negativas b. Cargas iguales se repelen, cargas desiguales se atraen c. Cargas desiguales se repelen y cargas iguales se atraen d. Los electrones se mueven desde la carga positiva hacia la carga negativa 1466. Tales de Mileto froto ámbar y observó que atraía pequeñas partículas. Siglos después Gilbert observó que por frotamiento muchas sustancias adquirían electricidad y distinguió entre las resinosas o positivas y las vítreas o negativas. De acuerdo con lo anterior podemos deducir que a. Todas las sustancias químicas tienen el mismo comportamiento del ámbar b. Los átomos están formados por una parte resinosa y una parte vítrea c. Los átomos tienen un carácter eléctrico d. Tales y Gilbert elaboraron un modelo atómico 1467. De acuerdo con la información del siguiente cuadro Material Asfalto Aceite Diesel Naftas obtenido Punto de 480 193 90 ebullición °C Es válido afirmar que en el proceso de destilación fraccionada, el orden en que se separan los siguientes derivados del petróleo son a. Asfalto, Naftas y aceite diesel b. Naftas, aceite diesel y asfalto c. Naftas, asfalto y aceite diesel d. Aceite diesel, naftas y asfalto 1468. El azufre es un sólido amarillo pálido que se quema en el aire para formar óxidos de azufre venenosos. Al calentarse se decolora y a 180°C forma una coloración marrón. Funde a 113 °C, no es soluble en agua. De las anteriores características del azufre, las subrayadas corresponden a a. Propiedades físicas b. Propiedades químicas c. Propiedades nucleares d. Propiedades alotrópicas 1469. Se coloca una bomba de plástico en la boca de un frasco de vidrio y en la parte inferior se coloca una vela encendida, al cabo de un tiempo la bomba comienza a inflar como se observa en la figura Este fenómeno tiene lugar porque al calentarse al sustancia gaseosa del frasco a. Hay un incremento de temperatura aumentando el número de moléculas b. Las partículas gaseosas se adhieren a la paredes de la bomba inflada c. Al aumentar la temperatura aumenta el tamaño de las partículas del gas d. Aumenta el movimiento y la distancia de las partículas del gas ocupando más volumen 1470. En el estado gaseoso las partículas se difunden hasta ocupar el mayor espacio posible. Una explicación para este fenómeno es a. En estado gaseoso las partículas constitutivas de la materia están íntimamente ligadas entre si b. En el estado gaseoso las partículas materiales gozan de libertad y se deslizan unas sobre otras c. En el estado gaseoso las partículas materiales carecen de cohesión, teniéndose que separarse d. En el estado gaseoso las partículas materiales pierden su masa, lo cual origina su evaporación 1471. La materia puede estar principalmente en tres estados: Sólido, líquido y gaseoso, el modelo que mejor representa unión (cohesión) entre las moléculas de un sólido es a. 1 b. 2 c. 3 d. 4 1472. la presión de vapor es la fuerza que ejercen las moléculas del líquido para tratar de escapar. De la presión de vapor del agua es válido afirmar que 1 a. 2 500 mL de 1 L H2O y H2O y 100 500 g g mayor en el recipiente dos porque hay mayor cantidad de agua y pueden escaparse mayor cantidad de moléculas b. mayor en el recipiente dos porque hay mayor superficie y pueden escaparse mayor cantidad de moléculas c. menor en el recipiente 1 porque hay menor cantidad de agua y pueden escaparse menor número de moléculas d. igual al del recipiente 1, porque la presión de vapor de una sustancia es una propiedad intensiva y no depende de la cantidad