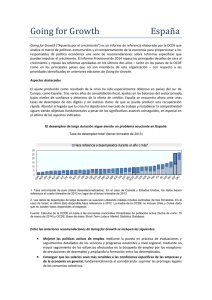
Universidad de Concepción VARIACIÓN ESPACIAL EN EL
Anuncio

Universidad de Concepción VARIACIÓN ESPACIAL EN EL CRECIMIENTO DEL ERIZO (Loxechinus albus) EN LA ZONA SUR DE CHILE Luis Alfredo Flores Vera Tesis Presentada a la Dirección de Postgrado de la Universidad de Concepción para optar al grado de MAGÍSTER EN CIENCIAS MENCIÓN PESQUERÍAS Julio 2009 ii UNIVERSIDAD DE CONCEPCIÓN DIRECCIÓN DE POSTGRADO La siguiente tesis se realizó en el Departamento de Oceanografía de la Facultad de Ciencias Naturales y Oceanográficas de la Universidad de Concepción y ha sido aprobada por la siguiente Comisión Evaluadora: Profesor Guía _________________________ Dr. Billy Ernst Elizalde Departamento de Oceanografía Universidad de Concepción Comisión Evaluadora _________________________ Dra. Ana Parma Biología y Manejo de Recursos Acuáticos Centro Nacional Patagónico _________________________ Dr. Carlos Molinet Instituto de Acuicultura Universidad Austral de Chile _________________________ Dr. Enrique Bay-Schmith Departamento de Zoología Universidad de Concepción Director de Programa _________________________ Dr. Leonardo Castro C. Departamento de Oceanografía Universidad de Concepción ii iii RESUMEN La pesquería del erizo ha sido desde los años 70´s una de las más importantes en el sector artesanal de Chile, tanto por la cantidad de recursos económicos que ha generado, como por el número de pescadores que en ella participan. Históricamente los principales volúmenes de captura han provenido de la zona sur del país y esta pesquería se destaca por un gran dinamismo, tanto en las zonas de explotación como en la manera en que ha sido manejada. En la actualidad se están abordando nuevos enfoques de investigación y gestión pesquera para este recurso basado en estrategias de manejo espacialmente explícitas y por lo tanto existe la necesidad de identificar las escalas a las cuales se producen variaciones espaciales importantes en los parámetros biológicos y pesqueros de este recurso. En esta tesis se evalúo el patrón de crecimiento y su variación espacial a distintas escalas en el erizo Loxechinus albus. Para cumplir esos objetivos se colectaron muestras de erizos en sitios determinados de la X y XI región, para posteriormente obtener mediciones de talla a la edad por medio de la lectura de las placas genitales de los erizos. Se observó un patrón de crecimiento no asintótico, y en particular lineal. Este tipo de patrón resulto invariante en el espacio. La escala intermedia (mesoescala) fue identificada como la más relevante en las variaciones que ocurren en el crecimiento del erizo. Lo anterior implica una simplificación de la representación del crecimiento en los modelos de dinámica poblacional y evaluación de stock usados, así como la consideración de escalas intermedias tanto en el monitoreo y los esquemas de manejo que puedan ser aplicados para la pesquería del erizo L. albus. iii iv ABSTRACT The sea urchin fishery since the 1970s has been one of the most important small-scale fisheries in Chile, in terms of the revenue and the number of fishers involve. Historically, the highest landings have been associated to southern Chile and the fishery in this zone is characterized by a spatially dynamic exploitation pattern and by the way it has been managed. Currently, a spatially explicit approach is being considered in the research and fisheries management of the sea urchin. Therefore, an important task is to identify the key scales in which spatial variation in biological and fisheries parameters are relevant. This thesis assessed the growth pattern and its spatial variation at different scales of the sea urchin Loxechinus albus. To accomplish theses objectives, samples of sea urchin were collected in several sites of the X and XI region. Then size at age data were generated by mean of the read of the growth band in the genital plates of the sea urchins. A non-asymptotic growth pattern was observed, especially a linear growth pattern. This pattern was invariant over space. The intermediate scale (mesoscale) was identified as the most important to the variations in the sea urchin growth. This implies a simplification of growth over the models commonly used in population dynamic and stock assessment, such as the consideration of the mesoscale in the fisheries monitoring and management approach that can be applied to the fisheries of the sea urchin L. albus. iv v A Luis y Fátima por su incondicional apoyo y ser mi punto de partida. Por darme la mejor de las herencias, la educación. Los amo con todo el corazón. A mis hermanos. A mis amigos. A Lily por siempre estar a mi lado y ser mi compañera de vida. v vi AGRADECIMIENTOS Agradezco sinceramente al Dr. Billy Ernst (Billy) por su apoyo antes y durante mi participación en el programa de pesquerías; por la confianza brindada a través de los últimos años y por enriquecer y ampliar mis conocimientos a través de las discusiones mantenidas. Gracias Billy por tu paciencia. A Alejandro Zuleta por darme la oportunidad de iniciarme en el estudio del mundo de los erizos y a la Dra. Ana Parma (Ana) por su desinteresada ayuda para colaborar en mi participación en el taller sobre el intercambio de experiencias de manejo de pesquerías de erizo. Un especial agradecimiento va para aquellas agencias e instituciones que permitieron financiar mis estudios y estadía en Chile: Fundación Capacitar (Ecuador), Dirección de Postgrado de la Universidad de Concepción (UDEC-Chile), Consejo Nacional de Investigación Científica y Tecnológica (CONICYT-Chile) y Conservation, Research and Education Opportunities (CREO-USA). El aporte de la CREO fue muy valioso para las actividades de campo en esta investigación. Agradezco mucho, en espacial a la Dra. Ana Parma, y a otros miembros de mi comité, los Drs. Carlos Molinet y Enrique Bay-Schmit, por las correcciones y sugerencias vertidas al manuscrito de mi tesis. Aquí hago un reconocimiento y agradecimiento de la ayuda brindada y desinteresada por parte de la Dra. Paulina Gebauer en mi entrenamiento para estimar edades en erizos y de Manira Matamala (Consultora Pupelde) al igual que su staff de Quellón y Melinka por su apoyo en las actividades de campo. A los profesores que colaboraron en mi formación durante mi estancia en el Programa de Pesquerías: Dr. Leonardo Castro, Dr. (c) Luis Cubillos, Dr. Guido Plaza, Dr. Ciro Oyarzun, Dr. Renato Quiñones, Dr. Pedro Real y Dr. Marcus Sobarzo. A las familias chilenas que me acogieron de tan buena manera: Tía Nancy Callellia, Doña. Patty Rivera, Familia. Riquelme-Cartes, Víctor Acuña y su familia (Melinka). Y finalmente mi más sincero agradecimiento para aquellos que engrandecen cada día de mi vida: mis amistades. A Paúl (“panita”) y Mónica (“mona”) por ser mis hermanos en estas tierras del sur, los quiero mucho. A las infaltables Lulu’s: Alejandra, Cecy, Katto (no se vi vii resientan también les tengo mucho cariño); gracias por los momentos compartidos, las llevo muy presente en mi corazón. A Pritha y Kelly, mis amiguitas ecuatorianas de Reñaca, gracias por su amistad y hospitalidad durante los fines de semana que pase con ambas. A mi pana Roberto (“el coleguita”) por las conversaciones y momento compartidos, eres grande panita. A Niki por ser el amigo silencioso que estuvo apoyándome siempre y motivándome a seguir en esto, gracias por tu fe en mí. Y finalmente a ti mi Dios, quien eres que me das el día a día, gracias por estas lindas bendiciones. vii viii TABLA DE CONTENIDO Capítulo I Antecedentes del erizo y su pesquería Introducción El erizo (Loxechinus albus) y su población Biología y Ecología Distribución Reproducción, asentamiento y reclutamiento Crecimiento Metodologías para la estimación del crecimiento en erizos Modelos de crecimiento Escalas espaciales y posibles forzantes Problemática de investigación Objetivo general Objetivos específicos Hipótesis Metodología Área de estudio Muestreo de campo Lectura de anillos de crecimiento en placas genitales Modelos de crecimiento y proceso de estimación Selección de modelo Comparación espacial II III Página 1 2 3 3 3 4 4 5 6 7 8 8 8 9 9 9 10 11 12 Growth pattern of the sea urchin, Loxechinus albus (Molina, 1782) in southern Chile: evaluation of growth models 18 Abstract Introduction Material and Methods Data sets Models Parameter estimation and model selection Results Size at age pattern Growth model selection Discission Observed pattern in the size at age relationship Growth model selection Implications for further analyses Acknowledgements References 19 20 22 22 23 24 25 25 26 27 27 29 32 33 33 Variabilidad espacial en el crecimiento somático del erizo, Loxechinus albus, en la costa sur de Chile: una aproximación línea jerárquica. 55 Resumen 55 viii ix IV Introducción Materiales y Métodos Área de estudio y muestreo de campo Datos talla a la edad basada en las placas genitales Análisis espacial basado en un enfoque lineal Resultados Crecimiento Análisis espacial Discusión Crecimiento Escalas espaciales y variaciones en el crecimiento Enfoques de análisis aplicados Implicaciones en la pesquería Agradecimientos Referencias 56 59 59 59 60 61 61 62 63 63 64 67 68 68 69 Discusión general 92 Literatura citada 95 ix x LISTA DE FIGURAS Figura 1. 2. 3. Página Capítulo I Desembarques anuales totales (tons) históricos de erizo clasificados de acuerdo a la zona proveniente del país. Fuente: Anuarios de SERNAPESCA Desembarques anuales totales (tons) históricos de erizo en la zona sur y Desagregados por región (X, XI y XII). Fuente: Anuarios de SERNAPESCA Áreas de operación de la pesquería de erizo en la zona sur (región X y XII) Figura 1. 2. 3. 4. 5. 2. 3. 4. 5. 6. 7. 8. 9. 13 14 Página Capítulo II Annual landings of sea urchin fisheries in Chile by geographical zone from 1968 to 2008. Lines and dots correspond to overall landings. Location of the three sampling sites in southern Chile (Chonos Archipelago). Overall size structure by site obtained from 1995-2004 fisheries sampling program. Arrows represent minimum and maximum test sizes sea urchin collected and aged in this study. Size-at-age data (dots) and fitted models (solid line: Von Bertalanffy; dashed line: Richards; dotted line: Schnute; dot dashed line: Tanaka; long dashed line: Linear). Residual values at age for the linear models fitted to the data from Amita Is. (a), Stokes Is. (b), and Williams Is. (c). Figura 1. 13 50 51 52 53 54 Página Capítulo III Sitios que representan las zonas establecidas para los muestreos en el sur de Chile. Procedencias agrupadas por ambientes ecológicos [ influencia oceánica (1, 3, 7 al 13) e influencia de canales y fiordos (2, 4 al 6)]. Distribución espacial de las procedencias muestreadas en la X y XI región del sur de Chile. Datos talla a la edad observada y modelo lineal ajustado para cada una de las procedencias. Estructura de edad observada de Loxechinus albus entre la X y XI Región en la zona sur de chile durante el estudio. Datos talla a la edad y modelo lineal ajustado de Loxechinus albus entre la X y XI región en la zona sur de Chile. Variabilidad en la talla a la edad (0 – 10) de Loxechinus albus entre la X y XI región en la zona sur de Chile Datos talla a la edad observada y modelo lineal ajustado para cada una de las zonas de análisis. Datos talla a la edad observada y modelo lineal ajustado para cada uno de los ambientes ecológicos de análisis (1) de influencia oceánica y (2) 82 83 84 85 86 87 88 89 90 x xi 10. de influencia de canales y fiordos. Relación entre el parámetro betha y la latitud para el erizo Loxechinus albus en la zona sur de Chile. 91 xi xii LISTA DE TABLAS Tabla 1. 2. 3. Página Capítulo I Factores que dan cuenta de variabilidad en el crecimiento de algunas especies de erizos reportado en la literatura. Zona y ubicación geográfica alrededor de los cuales se tomaron las en la Región X y XI para esta tesis. Modelos de crecimiento que fueron evaluados inicialmente para la representación de patrón de crecimiento en esta tesis. Tabla 1. 2. 3. 4. 5. 16 17 Página Capítulo II Alternative growth models fitted to size-at-age data of L. albus. Letters a-d represent model parameters, t is age, and τ1 and τ 2 correspond to a minimum and maximum age defined in the model Uncertainty in age estimation (three readings) based on average percent error (APE) and coefficient of variation (CV) estimated for subsamples from the collections of Stokes and Amita Islands. Parameter estimates and standard deviation (in parenthesis), and results of model selection for the respective age range in each zone: Amita Is. (1 to 10), Stokes Is. (0 to 13) and Williams Is. (1 to 12). Akaike’s information criterion (AIC), Akaike differences (Δi), normalized weights of AIC (Wi,1), Bayesian Information criterion (BIC) and normalized weights of BIC (Wi,2). Parameter estimates and standard deviation (in parenthesis), and results of the model selection using data for the age range between 2 and 10 years. Akaike’s information criterion (AIC), Akaike differences (Δi), normalized weights of AIC (Wi,1), Bayesian Information criterion (BIC) and normalized weights of BIC (Wi,2). Models used to fit sea urchin growth data in multi-model studies in bold the model chosen). * Taken from Grosjean 2001 (pages 54-55); a: EC (experimental culture), PR (plate readings) and MR (markrecapture); b: AIC (Akaike information criterion), BC (biological criterion), CV (coefficient of variation), PP (personal preference), R (correlation coefficient), RA (residual analysis), RRS (residual sum of square), SSE (square standard error). Tabla 1. 15 44 45 46 47 48 Página Capítulo III Estimadores de máxima verosimilitud de los parámetros de crecimiento para cada uno de los modelos implementados para evaluar las escalas de variación espacial en la zona sur de Chile [M1: modelo que no considera jerarquías; M2: modelo donde sólo considera los ambiente ecológicos (1) de influencia oceánica y (2) de influencia de canales y fiordos; M3: modelo que considera cada zona y M4: modelo que considera cada una de las procedencias]. 78 xii xiii 2. 3. 4. Resultados del test de razón de verosimilitud para evaluar la escala de mayor aporte de variabilidad en el crecimiento de Loxechinus albus. Significancia estadística a nivel de zonas del análisis comparativo de la distancia promedio entre tallas media a la edad (edades 2 a 10) en el erizo Loxechinus albus para la costa sur de Chile. Zonas: 1 (Canal de Chacao), 2 (Cailin), 3 (Punta Inio), 4 (Concoto y Amita), 5 (Jechica), 6 (Llanus, May y Tellez), 7 (Ipun, Stokes y Williams) y 8 (Lemu). El singo negativo (-) implica un promedio mayor en la fila, mientras que positivo (+) en la columna. NS equivale a no significativo. Significancia estadística a nivel de procedencias del análisis comparativo de la distancia promedio entre tallas media a la edad (edades 2 a 10) en el erizo Loxechinus albus para la costa sur de Chile. Procedencias: 1 (Canal de Chacao), 2 (Cailin), 3 (Punta Inio), 4 (Amita), 5 (Concoto), 6 (Jechica), 7 (Llanus), 8 (Tellez), 9 (May), 10 (Ipun), 11(Stokes), 12 (Williams) y 13 (Lemu). El singo negativo (-) implica un promedio mayor en la fila, mientras que positivo (+) en la columna. NS equivale a no significativo. 79 80 81 xiii CAPÍTULO 1 Antecedentes del erizo y su pesquería Introducción Chile es particularmente conocido por la diversidad y calidad de sus recursos bentónicos, los cuales son explotados principalmente por una numerosa flota artesanal distribuída a lo largo del país. La pesquería del erizo rojo ha tenido por muchas décadas un importante rol en el sector artesanal nacional debido a sus volúmenes de desembarque (Bustamante y Castilla 1987), reportándose en cinco años una captura acumulada de ca. 237000 tons. (SERNAPESCA 2000 - 2005). Esto ha hecho que se consolide a la vez internacionalmente como una de las pesquerías de erizo más grandes del mundo (Andrew et al. 2002), alcanzando en algunos años aproximadamente 65% del desembarque mundial (Williams 2002, Moreno et al 2008). La pesquería ha mostrado a través del tiempo un proceso largo de expansión en sus costas. Esta situación motivó a algunos (Barahona y Jerez 1997; Andrew et al. 2002; Williams 2002) a postular una posible sobreexplotación y el colapso de varias áreas como respuesta a un agotamiento secuencial, mientras que otros (Moreno et al. 2008) lo señalan como una expansión geográfica. Sin embargo, la posibilidad del agotamiento secuencial de áreas no se descarta ya que es una de las principales causas del colapso de muchas pesquerías de recursos bentónicos sedentarios (Orensanz et al 1998). De acuerdo a SERNAPESCA (1968 – 2004) los principales volúmenes de desembarque están en la zona sur del país (Figura 1). Los más representativos son los reportados para la X región, aunque debe tenerse en cuenta que una significativa parte de las capturas realizadas proviene de procedencias (sitios o lugares de pesca identificados en la base de datos del Instituto de Fomento Pesquero, IFOP) localizadas en la XI región. A partir de 1993 los desembarque de la XII región comenzaron a ser relevantes dentro de la producción total del país (Figura 2). 1 La pesquería en la región X/XI opera sobre cuatro grados de latitud, desde el Canal de Chacao (42º S) hasta la Península de Taitao (∼ 46º S) estando localizadas sus principales áreas de pesca en la parte insular: Isla de Chiloé (Región X), Isla Guafo (Región XI) y en el Archipiélago de las Guaitecas – Chonos (Región XI) (Figura 3). Ha sido clasificada en dos tipos: aquella dirigida al consumo doméstico y la orientada a la exportación (Barahona et al 2003). El comportamiento de cada flota en función de la distribución espacial y temporal del esfuerzo es distinto dando cuenta de un patrón puntual y discreto en la asignación espacial del esfuerzo. La pesquería orientada al consumo doméstico tiene un radio de operación cercano a los puertos de la X región, por lo tanto los viajes de pesca son diarios. El esfuerzo de pesca está dirigido a la captura de erizos de tallas grandes, los que se encontraría principalmente en aguas profundas. La pesca orientada a la exportación explota tallas menores y en aguas más someras. Sin embargo, al igual que la anterior, una fracción menor de esta pesquería opera en áreas cercanas a los principales puertos (e.g. Quellón, Melinka) y otra mayor en zonas remotas de la XI región. En este último caso, se constituyen “faenas de pesca”, las cuales son un grupo organizado de botes que realizan campamentos temporales en lugares vecinos a los sitios de pesca conocidos como “procedencias”. La complejidad de la dinámica espacio - temporal de este recurso y su pesquería representa un verdadero desafío para una adecuada administración y manejo de este sistema. Producto de esto es que el Fondo de Investigación Pesquera (FIP) financió la primera fase (2001 – 2002) del proyecto “Bases Biológicas para la Rotación de Áreas en la Pesquería del Erizo de las Regiones X – XI”, el cual fue conducido en sus inicios por el IFOP (Barahona et al 2003) y en su segunda fase por la Universidad Austral de Chile. La idea básica de estos proyectos es enfrentar el problema por medio del desarrollo de modelos espacialmente explícitos (e.g. METAPESCA), los cuales a su vez pueden ser empleados como herramienta para explorar procedimientos de manejos alternativos. El erizo (Loxechinus albus) y su población Al igual que la mayor parte de las especies bentónicas sedentarias, es muy probable que los erizos estén estructurados como metapoblaciones a una escala espacial grande (Orensanz 2 1986; Orensanz et al 1991), es decir por un conjunto de subpoblaciones que están interconectadas por la dispersión larval, y donde sus stocks tienen una distribución agregada en parches de alta densidad (Caddy 1975; Orensanz 1986; Defeo 1993; Orensanz y Jamieson 1998). Producto de esta estructura, el patrón de recuperación de poblaciones locales dependería de la distancia de dispersión larval y las características hidrodinámicas del océano dentro del dominio de la metapoblación (Carr y Reed 1993; Allison et al 1998). De igual manera, la distribución del esfuerzo de pesca podría ser heterogénea debido a que sigue de forma cercana el patrón de distribución espacial del recurso (Hancock 1973, 1979; Conan 1984; Orensanz et al 1991; Orensanz et al 2003). Por lo tanto, es relevante considerar las escalas espaciales en el momento de analizar tanto las poblaciones como su respectiva pesquería. Biología y Ecología Recientemente se ha sintetizado información sobre la ecología del erizo chileno (Vásquez 2001) y su pesquería (Andrew et al. 2002; Williams 2002). Barahona et al (2003) presentaron una revisión de los principales estudios biológicos, ecológicos y pesqueros del recurso erizo (L. albus) con énfasis en la zona sur de Chile, e identificaron un importante estado del conocimiento con relación a algunos parámetros de la historia de vida (ciclo biológico reproductivo, talla de primera madurez sexual, fecundidad potencial, fase larval, asentamiento y reclutamiento, crecimiento, repoblamiento y tecnología de procesos), pero consideraron escaso el conocimiento de la dinámica del recurso e insuficiente para fines de manejo. Distribución La especie se distribuye a lo largo de la costa suroriental del Océano Pacífico, desde Perú (Isla de Lobos de Afuera) hasta el extremo austral de Chile (Cabo de Hornos) y Tierra del Fuego en Argentina (Guisado y Castilla 1987), siendo la única especie de erizo sometida a explotación en este rango. Habita en fondos duros desde la zona intermareal hasta los 340 metros de profundidad (Larraín 1975), pero su extracción se concentra entre los 0 y 50 metros. Reproducción, Asentamiento y Reclutamiento 3 Es una especie con sexos separados y sin dimorfismo sexual. La época de desove varía a lo largo de la costa de Chile. Tiene un solo desove en el año que puede extenderse de uno a tres meses, dependiendo de la latitud (Bay-Schmith et al 1981). En las regiones X y XI el desove ocurre entre octubre y diciembre, encontrándose la máxima evacuación de gametos durante los dos últimos meses del año (Bay-Schmith et al 1981; Arias et al 1995). Evidencia del inicio de la actividad gametogénica se ha detectado en tallas entre los 25 y 47 mm en machos y entre los 25 a 38 mm en hembras (Buckle et al 1978; Bay – Schmith et al 1981). Basado en experimentos de laboratorio se sabe que las larvas permanecen en el plancton por algunas semanas (Arrau 1958; Guisado y Castilla 1987; González et al 1987). Sobre el asentamiento es poco lo reportado para esta zona (Gebauer 1992), sin embargo de manera general se conoce que el asentamiento ocurre principalmente en sistemas intermareales rocosos para después migrar al submareal y a aguas más profundas (Guisado y Castilla 1987; Vásquez 2001). De acuerdo a una categorización basada en su movilidad y desarrollo larval establecida por Castilla y Defeo (2001), el erizo rojo sería una especie con período larval planctónico largo y variable, con fecundación externa, alta fecundidad y que no presenta patrones migratorios regulares. Crecimiento El crecimiento del erizo ha sido estudiado de manera no sistemática a lo largo de la costa de Chile utilizando diversas metodologías. Lo reportado indica que el erizo presenta un crecimiento relativamente lento y una longevidad de hasta los 20 años, alcanzando un diámetro máximo de testa de 130 mm (Stotz et al 1992; Gebauer 1992; Gebauer y Moreno 1995). Recientemente Barahona et al (2003) encontraron diferencias entre dos localidades, una de la Región X (Quellón) y otra de la Región XI (Melinka). Así de acuerdo a la parametrización de la función de von Bertalanffy establecida se obtuvo que la talla a la edad 1 era de 14.0 y 20.5 mm mientras que la talla a la edad 12 era de 111.4 y 110.5 mm, respectivamente. Metodologías para la estimación del crecimiento en erizos 4 Las estimaciones del crecimiento en otras especies de erizos se han basado en datos de frecuencia de talla (DFT), experiencias de marcaje y recaptura (EMR) y en la lectura de placas (LP). La metodología menos exitosa y usada son los DFT (Botsford et al 1994; Vadas et al 2002). En cambio la LP (Crapp y Willis 1975; Sime 1982; White et al 1984; Nichols et al 1985; Sime y Cranmer 1985; Gage et al 1986; Comely y Ansell 1988; Soualili et al 1999; Agatsuma y Nakata 2004) y la EMR (Russell 1987; Lamare y Mladenov 2000; Morgan et al 2000; Rogers – Bennett et al 2003; Ebert y Southon 2003) han sido las que mejores resultados han brindado. Estas dos últimas metodologías han sido validadas. En el caso de la formación anual del anillo de crecimiento en los equinoideos dicha validación se ha dado por medio de experiencias de marcaje con tetraciclina (e.g. Ebert 1988, Gage 1992) o por su consistencia con análisis de frecuencia de tallas (e.g. Moore 1935, Birkeland y Chia 1971, Miller y Mann 1973, Kawamura 1974). La validación de marcaje (e.g. tetraciclina) a su vez se ha dado por medio de carbono 14 (Ebert y Southon 2003). Para el erizo rojo la LP y la EMR han sido aplicadas. Gebauer (1992) y Gebauer y Moreno (1995) resaltan que la lectura de placas genitales son útiles para la determinación de parámetros demográficos importantes validando sus resultados a través del análisis del incremento marginal para determinar el ciclo de formación de los anillos de crecimiento. Esto es confirmado por Barahona et al (2003) quienes también ponen a prueba el marcaje con tetraciclina. De acuerdo a esto, es recomendable la utilización de la LP debido a que se obtendrían resultados a un corto plazo en comparación con la EMR cuyos resultados se tendrían en un lapso mayor de tiempo y con los problemas propios de esta aproximación. Sin embargo esta última puede ser planteada con fines comparativos en relación a la metodología y para validar la formación anual de los anillos de crecimiento en un sitio específico. Modelos de Crecimiento Dos familias de modelos han sido históricamente empleadas para describir el crecimiento de erizos, las que suponen un crecimiento asintótico (e.g. von Bertalanffy 1938, 1957) y las de crecimiento no asintótico o indeterminado (e.g. Tanaka 1982). 5 Un sin número de modelos han sido utilizados para describir el crecimiento de erizos (ver Grosjean 2001, pags. 54 y 55). No obstante, son pocos los trabajos que han evaluado cuantitativamente la elección del modelo (e.g. Lamare y Mladenov 2000; Rogers – Bennett et al 2003), y aparentemente para los erizos en general no existe un único modelo adecuado (Ebert y Ruseell 1993). Para el erizo, el modelo más usado es la función de von Bertalanffy (1938). Sin embargo, Barahona et al (2003) sugieren que dicho modelo podría no ser adecuado, ya que el crecimiento sería lineal y por lo tanto estaría representado mejor por un modelo no asintótico. La identificación de un modelo apropiado para el caso del erizo rojo es un tema aún no resuelto. Escalas espaciales y posibles forzantes La variabilidad espacial en la dinámica poblacional de especies bentónicas ha recibido mucha atención debido a la existencia de gradientes a distintas escalas (e.g. Defeo 1993; Orensanz y Jamieson 1998; Roa y Tapia 1998; Fiori y Morsán 2003; Caddy y Defeo 2003; Ernst et al 2005). La jerarquía de escalas espaciales presentada por Orensanz y Jamieson (1998) es útil para evaluar posibles diferencias en los parámetros poblacionales: • Megaescala: En la cual hay una detectable diferencia geográfica genética entre las poblaciones. • Macroescala (escala larga): Metapoblaciones compuestas de subpoblaciones espacialmente disjuntas y conectadas a través de la dispersión de larvas pelágicas. • Mesoescala (escala intermedia): Subpoblaciones dentro de una metapoblación. Esta es típicamente la escala de bancos de pesca. • Microescala (escala pequeña): Vecindad de individuos, dentro del cual hay cierta interacción entre los individuos y su ambiente. En algunas especies de erizos se ha reportado la presencia de gradientes en el crecimiento a pequeña escala, en profundidad, y entre áreas y hábitats (White et al 1984; Nichols et al 6 1985; Sime y Cranmer 1985; Gage et al 1986; Russell 1987; Gage 1992; Vadas et al 1997, 2002). En otros casos no se han encontraron diferencias batimétricas (Rogers – Bennett et al 2003) ni geográficas (Russell 1987; Ebert et al 1999). El efecto espacial sobre el crecimiento del erizo rojo (L. albus) ha sido poco estudiado. Hay reportes de diferencias en el incremento en talla para la especie, encontrándose en el región norte del país incrementos mensuales de 2 mm, mientras que en la región central y sur incrementos de 1.1 mm/mes y 0.24 mm/mes respectivamente (Gutiérrez y Otsu 1975; Bückle et. al. 1977). Barahona et al (2003) encontraron diferencias en el crecimiento entre dos localidades de la zona sur, lo que hace suponer un marcado efecto de la escala espacial sobre el crecimiento y posiblemente sobre otras características de la historia de vida. Es poco lo que se sabe en relación a los factores que serían responsables de esta variabilidad. De estudios pasados se destacan tipo de alimento (González et al 1993) y la temperatura (Bückle et. al. 1977). Este último podría ser uno de los factores que de cuenta de variabilidad espacial a una escala grande o intermedia (e.g. latitudinal, longitudinal). Otras variables aún no consideradas podrían ser también importantes, tal como ha sido reportado para otras especies de erizos (Tabla 1). Problemática de Investigación La dimensión espacial de los procesos y patrones poblacionales ha recibido recientemente considerable atención en la ecología de invertebrados. En particular para los erizos, el crecimiento es uno de los aspectos de la historia de vida relevante en la dinámica poblacional, tanto desde el punto de vista ecológico como pesquero, al constituir éste un importante componente de la producción. Dado que la dinámica poblacional de los recursos bentónicos es muy sensible a las condiciones ambientales, incluso a distancias chicas (e.g. metros), es necesario investigar la posible existencia de gradientes espaciales en las tasas de crecimiento y otros parámetros como la mortalidad y el reclutamiento (Caddy y Defeo 2003). Ignorar la heterogeneidad espacial en estos parámetros puede conducir a una equivocada interpretación de varios aspectos de la biología de las especies (Booth 2000). De igual manera, el manejo pesquero debe tener en cuenta el componente espacial (Booth 2000). La identificación de factores que limitan el crecimiento (e.g. espacio) es también importante para el diseño de estrategias de recuperación de poblaciones a fin de evitar pérdidas económicas derivadas del crecimiento lento y altas mortalidades causadas por mecanismos denso – dependientes 7 (Caddy y Defeo 2003). Por lo tanto se proponen los siguientes objetivos e hipótesis en este proyecto con relación al crecimiento somático del erizo del sur (Loxechinus albus): Objetivo General • Describir el patrón de crecimiento somático del erizo rojo (Loxechinus albus) y su variabilidad espacial en las costas del sur de Chile. Objetivos Específicos • Caracterizar el crecimiento somático del erizo basado en la aplicación de modelos asintóticos y no asintóticos. • Comparar el crecimiento a distintas escalas espaciales (e.g. procedencias, grandes zonas geográficas y tipo de hábitat). Hipótesis Hipótesis 1 • El crecimiento del erizo (Loxechinus albus) presenta un patrón no asintótico. Hipótesis 2 • El crecimiento del erizo varía a distintas escalas espaciales, presentando diferencias a escalas mayores [(grados de latitud, longitud) moduladas posiblemente por variables abióticas (e.g. temperatura, salinidad)] y a escalas menores [(islas, bancos de pesca) por variables bióticas (e.g. tipo de alimento)], respectivamente. 8 Metodología Área de estudio La pesquería del erizo en la zona sur (X y XI región) opera sobre una extensión de cuatro grados de latitud (42°S – 46°S). Se definió como área de estudio la zona comprendida entre la latitud 41°S a 46°S, seleccionándose una serie de sitios de muestreo definidos como macrozonas centrados en los puntos listados en la Tabla 2 y Figura 4. Muestro de campo Las muestras se obtuvieron de los desembarques de pesca y de manera complementaria de visitas a los lugares de faena (muestreo in situ Enero 2007). Se colectó de cada zona 26 ejemplares por cada rango de talla de acuerdo a los siguientes intervalos: < 20 mm, de 20 a 130 mm con intervalos de clase de 10 mm y > 130 mm. Asociado a cada ejemplar se registró el diámetro máximo de testa (mm) de cada ejemplar sin púas con un calibrador a 0.05 mm de precisión. Finalmente se extrajo la corona de cada ejemplar y fue rotulada para su posterior tratamiento. Lectura de anillos de crecimiento en las placas genitales Las placas genitales se extrajeron de la corona de cada ejemplar, y fueron rotuladas y guardadas en tubos Eppendorf. El procesamiento de las placas estuvo basado en lo propuesto por Gebauer (1992) y ciertas modificaciones (Barahona et al 2003). El protocolo utilizado consistió en los siguientes pasos: 1. Pulido de las placas: el número de pasadas dependió del grosor de la placa. Primeramente se pulió la cara interna a fin de poder asentarla, y luego la cara externa, la cual fue leída. 2. Lectura de los anillos: para ello se empleó un microscopio estereoscópico y fondo oscuro. Los aumentos usuales fueron 25x y 50x (este fue utilizado para las tallas más 9 pequeñas). Las placas, en un inicio, fueron tratadas con xilol, pero después se cambió esa substancia por aceite para infante, el cual determinó el mismo desempeño en la observación. 3. Conteo de anillos: se comenzó ubicando el centro de la placa, para luego contar los anillos desde este hacia el borde de una de las alas. El anillo oscuro (o traslucido), el cual esta asociado con un período de crecimiento lento en invierno, fue usado para la asignación de la edad. Modelos de crecimiento y estimación de parámetros A partir de los datos talla a la edad derivados de la lectura de las placas genitales se estimaron los parámetros de funciones de crecimiento asintótico y no asintótico que fueron inicialmente seleccionados (Tabla 3). Problemas numéricos en el proceso de estimación (convergencia) determinó el uso de parametrizaciones alternativas para las funciones asintóticas (Tabla 3). La estimación de los parámetros se realizó de acuerdo al método de máxima verosimilitud basado en un modelo gausiano, donde los parámetros a ser estimados están representados por “ϕ” y : n L(L / ϕ, σ 2 ) = ∏ i =1 1 2πσ 2 e ⎡ −[L −f ( ϕ) ]2 ⎤ i ⎢ ⎥ ⎢⎣ ⎥⎦ 2 σ2 (1) Aplicando logaritmo a (1) y excluyendo constantes obtenemos: 2 n − log L(L i / ϕ) = ( ) n log σ 2 + 2 ∑ [L i − f (ϕ)] 1 2σ 2 (2) donde el parámetro de varianza es estimado por: 10 2 n σ2 = ∑ [L i − f (ϕ)] i =1 n (3) La estimación de estos parámetros se llevó a cabo mediante optimización no lineal utilizando el software ADMB (Automatic Differentiation Model Builder, Otter Research 2001). Selección de Modelos Para la selección del modelo que mejor explicó el crecimiento del erizo se implementó la función del criterio de información de Akaike (AIC) (Akaike 1973, Buckland et al 1993) definido como: AIC = −2 log(L) + 2p (4) donde log(L) es la log-verosimilitud evaluada para la estimación de máxima verosimilitud y p es el número de parámetros. Un solo valor del AIC no tiene interpretación por si mismo, pero la comparación entre diferentes valores del AIC permite evaluar el soporte relativo de los datos para dos o más modelos. De igual forma se implementó el criterio de información bayesiano (BIC) (Schwarz 1978): BIC = −2 log(L) + 2p log(n ) (5) El AIC y BIC penalizan la complejidad del modelo representado por el número de parámetros y el tamaño de la muestra (n), respectivamente; para alcanzar un óptimo entre exactitud y parsimonia del modelo, siendo el modelo más parsimonioso y más probable de ser correcto el que tenga el menor valor de AIC o BIC. Dada la subjetividad de lo que puede ser conceptualizado como “más probable” y basado en lo que reportan Buckland et al (1997) y Burnham y Anderson (2002), se calculó la diferencia (Δ) en ambos criterios (AIC y BIC) del valor de cada modelo con el de menor valor para posteriormente calcular los pesos 11 normalizados de cada modelo (w) (Ward 2008), el cual corresponde a la probabilidad de escoger el modelo correcto definido por: w= e − 1 ( Δ AIC 2 ∑e o BIC ) − 1 ( Δ AIC 2 ( 6) o BIC ) Comparación espacial Modelos lineales fueron implementados para caracterizar y cuantificar las variaciones espaciales en el crecimiento del erizo. La construcción de cada modelo considero variables de orden biológica (edad), factores ecológico (influencia oceánica y de influencia de canales y fiordos) y espacial (procedencia, zona). En el modelo 1 (M1) no hubo consideración del ambiente ecológico y escala espacial. En el modelo 2 (M2) hubo consideración del ambiente ecológico. En el modelo 3 (M3) y modelo 4 (M4) se hizo consideración de la escala espacial a nivel de zona y procedencia, respectivamente. Un test de razón de verosimilitud (TRV) fue empleado para evaluar las diferencias entre cada modelo. La comparación de cada modelo se la hizo con relación a M1, el modelo más sencillo. La comparación individual entre elementos a cada escala (ambiente ecológico, zona y procedencia) se realizó basada en el enfoque metodológico propuesto por Wang y Milton (2000), es decir las curvas de crecimiento (lineal) se compararon mediante las distancias promedio (estadístico D) en las tallas media a la edad predichas por cada modelo (integrando desde la edad 2 a la edad 10). Estos procedimientos fueron implementados en AD Model Builder (ADMB v 6.0.2, Otter Research Ltd) y la función MCMC, que permitió obtener una aproximación a la distribución posterior del estadístico “D”. El grado de significancia de las variaciones individuales a cada escala fue evaluado en función de la distribución posterior de la diferencia media y el nivel de referencia cero. 12 60000 55000 NORTE CENTRO SUR Desembarque (Tons) 50000 45000 40000 35000 30000 25000 20000 15000 10000 5000 0 1968 1971 1974 1977 1980 1983 1986 1989 1992 1995 1998 2001 2004 Años Figura 1.- Desembarques anuales totales (tons) históricos de erizo clasificados de acuerdo a la zona proveniente del país. Fuente: Anuarios de SERNAPESCA 35000 X XI XII Desembarque (Tons) 30000 25000 20000 15000 10000 5000 0 1968 1971 1974 1977 1980 1983 1986 1989 1992 1995 1998 2001 2004 Años Figura 2.- Desembarques anuales totales (tons) históricos de erizo en la zona sur y desagregado por región (X, XI y XII). Fuente: Anuarios de SERNAPESCA. 13 Isla Chiloé Archipiélago Chonos Isla Guafo Océano Pacifico Isla Guaitecas Figura 3.- Áreas de operación de la pesquería de erizo en la zona sur (región X y XI). 14 Tabla 1.- Factores que dan cuenta de variabilidad en el crecimiento de algunas especies de erizos reportado en la literatura. Factores forzantes del crecimiento Referencia Hábitat (zonas expuestas y protegidas; Fuji 1967, Ebert 1968, Crapp y Willis calidad, disponibilidad y tipo de 1975, Vadas 1977, Nichols et al 1985, Gage et al 1986, Raymond y Scheibling alimento) 1987, Guillou y Michel 1994, Beddingfield y McClintock 1998, Morgan et al 2000 Agua de mar (temperatura, calidad) Fuji 1967, Nichols et al 1985, Raymond y Scheibling 1987, Guillou y Michel 1994 Regimenes de luz, variables ambientales y Ebert 1968, Meidel y Scheibling 1998, climáticas Russell 1987 y 1998 Densidad de individuos Grabowski et al 2000 Carga proteica en la dieta Lowe y Lawrence 1976; Hammer 2005 15 Tabla 2.- Ubicación geográfica de las procedencias de las cuales se tomaron las muestras en la Región X y XI para esta tesis. Zona Canal Chacao Cailin Punta Inio Isla Amita Concoto Isla Jechica Isla Llanos Isla Tellez Isla May Isla Ipun Isla Stokes Isla Williams Isla Lemus Región X X X XI XI XI XI XI XI XI XI XI XI Latitud (S) 41º47´ 43º12´ 43º22´ 44º04´ 44º09´ 44º27´ 44º04´ 44º14´ 44º12´ 44º36´ 44º37´ 44º53´ 45º12´ Longitud (W) 73º41´ 73º35´ 74º07´ 73º50´ 73º48´ 73º47´ 74º05´ 74º11´ 74º19´ 74º43´ 74º31´ 74º18´ 74º28´ 16 Tabla 3.- Modelos de crecimiento que fueron evaluados para la representación de patrón de crecimiento en esta tesis. Expresión matemática Modelo de crecimiento 1.- Modelo de von Bertalanffy Dt = a + (b − a ) 2.- Modelo de Richards Dt = 3.- Modelo de Schnute y Richards 4.- Modelo de Tanaka 5- Modelo Lineal 1 − c t −τ 1 1 − cτ 2 −τ 1 a (1 + be −c ( t −d ) ) 1 c ⎛ 1 − e −d ( t − τ 1) D t = ⎜⎜ a c + (b c − a c ) −d ( τ − τ ) 1− e 2 1 ⎝ 1 ⎞c ⎟ ⎟ ⎠ ⎛ 1 ⎞ ⎛ D t = ⎜⎜ ⎟⎟ log⎜ 2 a ( t − b) + 2 a 2 ( t − b) 2 + a c ⎞⎟ + d ⎠ ⎝ a⎠ ⎝ Dt = a + b t 17 CAPITULO 2 Growth pattern of the sea urchin, Loxechinus albus (Molina, 1782) in southern Chile: evaluation of growth models.* Luis Flores, Billy Ernst and Ana M. Parma Luis Flores: Magíster en Ciencias Mención Pesquerías, Cabina 10, Departamento de Oceanografía, Universidad de Concepción, Concepción, P.O. Box 160 – C, Chile. Billy Ernst: Departamento de Oceanografía, Universidad de Concepción, P.O. Box 160 – C, Concepción, Chile and Centro de Investigación en Ecosistemas de la Patagonia (CIEP). Ana M. Parma: Centro Nacional Patagónico (CENPAT), 9120 Puerto Madryn, Argentina. Correspondence to L. Flores: e – mail: [email protected]; tel.: + 56-41-2207029; fax: + 56-41-2256571; *Articulo enviado al journal Marine Biology 18 Abstract The growth pattern of Loxechinus albus in southern Chile was studied using size-at-age data obtained by reading growth bands on the genital plates. The scatter plots of sizes at age for samples collected in three different locations indicated that growth is linear between ages 2 and 10. Five different growth models, including linear, asymptotic and non-asymptotic functions, were fitted to the data and model selection was conducted based on the Akaike information criteria (AIC) and the Bayesian information criteria (BIC). The AIC identified the Tanaka model as the most suitable for two of the three sites. However, the BIC led to the selection of the linear model for all zones. Our results show that the growth pattern of L. albus is different from the predominantly asymptotic pattern that has been reported for other sea urchin species. Keywords: growth models, model selection, AIC, BIC, sea urchin. 19 Introduction Marine invertebrates are being fished at an increasing rate worldwide (Keesing and Hall 1998) and some fisheries are experiencing serious declines. Sea urchin fisheries are a case in point. Although there is a long history of exploitation especially in the Atlantic coast of Europe, the Mediterranean, northern Asia, New Zealand and Chile; sea urchin fisheries have experienced significant declines in landings over the past decade almost in all regions (Williams 2002). As a result, the Chilean sea urchin (Loxechinus albus) fishery has become the most important in the world (Andrew et al. 2002), accounting for almost 65 % of the world’s landings in some years (Williams 2002; Moreno et al. 2007) and with an overall average landing of 43000 metric tons for the 2000-2008 period (Chilean Fisheries Service, www.sernapesca.cl). The Chilean sea urchin fishery operates along almost the entire coast of Chile, but the bulk of the catch comes from the southern region (Figures 1 and 2), where sea urchin beds are scattered in a maze of fjords and islands that span 15 degrees of latitude (42°57° S), posing a serious challenge to their assessment and fishery management (Moreno et al. 2007). The spatial pattern of exploitation has been highly dynamic, experiencing successive contractions and expansions (Orensanz et al. 2005). Its spatial complexity and the postulated sequential depletion of the grounds (Barahona and Jerez 1997; Andrew et al. 2002; Williams 2002) have led to suggestions that rotational harvesting strategies combined with permanent reserves may offer a suitable alternative to the regional-quota system currently in place (Barahona et al. 2003). To evaluate such policies, a spatially explicit simulation model of the fishery in regions X and XI (Figure 2) has been developed, which requires specification of fishery and biological parameters 20 at different scales. Growth is one of the key processes that need to be quantified, as optimal rotational strategies may be very sensitive to the assumed growth rates (Botsford et al. 1993; Quinn et al. 1993). The estimation of growth parameters in sea urchins has been based on analyses of length frequency distributions (Botsford et al. 1994; Smith et al. 1998; Vadas et al. 2002), size-increments from mark–recapture experiments (Russell 1987; Rowley 1990; Kenner 1992; Ebert and Russell 1992,1993; Ebert et al. 1999; Lamare and Mladenov 2000; Morgan et al. 2000; Rogers-Bennett et al. 2003; Ebert and Southon 2003) and size-at-age data obtained by reading annual growth bands on shell plates (Crapp and Willis 1975; Nichols et al. 1985; Sime and Cranmer 1985; Gage et al. 1986; Comely and Ansell 1988; Soualili et al. 1999; Agatsuma and Nakata 2004; Shelton et al. 2006; Blicher et al. 2007). In the case of L. albus, growth bands on genital plates (GP) have been used for ageing (Gebauer 1992; Gebauer and Moreno 1995; Duran et al. 1999; Barahona et al. 2003); their annual periodicity was validated through the analysis of marginal increments on plates sampled monthly (50 sea urchin/month) from an experimental cohort kept in tidepools over a twelve month period (Gebauer 1992; Gebauer and Moreno 1995). Different models have been used to represent growth in sea urchins (see Grosjean 2001; pags. 54 and 55); asymptotic models being the most common. However, Ebert and Russell (1993) questioned the assumption of asymptotic growth at least for large, longlived species such as Strongylocentrotus franciscanus, and to suggest the used of nonasymptotic models (e.g. Tanaka 1982). They noted that there is no universally best model to characterize sea urchin growth in general. Furthermore, model choice may 21 vary depending on location, as was observed in S. franciscanus (Shelton et al. 2006). Therefore, the selection of an appropriate model is an important first step in quantifying growth for management strategy evaluation. L. albus is a slow–growing species (Stotz et al. 1992; Gebauer 1992; Gebauer and Moreno 1995; Duran et al. 1999; Barahona et al. 2003). Barahona et al. (2003) suggested that its growth was linear based on size-at-age data, but the range of ages analyzed was too narrow to be conclusive. The aim of this paper is to characterize the growth pattern of L. albus and to examine if the choice of an appropriate model is invariant over space. To address this goal, we measured and aged a large collection of sea urchin shells sampled from three different locations in southern Chile, and compared the performance of asymptotic and non-asymptotic growth models using the Information Theoretic Approach [ITA (Burnham and Anderson 2002)] and Bayesian inference. Material and Methods Data sets Three sets of size-at-age data were obtained by reading growth bands on genital plates and taking measures of test size (at 0.1 mm) of sea urchins collected from three locations in southern Chile: Stokes Is., Amita Is. and Williams Is. (Figure 2). A stratified-by-size sampling scheme was used following Bromaghin (1993). The samples were collected from surveys (fishery-independent, January 2007) and from the commercial landings (September-October 2006/2007). Ageing methodology was based 22 on Gebauer (1992), and Gebauer and Moreno (1995). Mean sizes-at-age from Gebauer (1992) were also analyzed for comparative purposes. In addition sub-samples from Stokes Is. (n=196) and Amita Is. (n=162) were used to evaluate the uncertainty in the age estimation by comparing the ages obtained by three blind age readings done by the same reader (LF). Ageing errors were evaluated according to the average percent error (APE) and coefficient of variation (CV) (Campana 2001). The APE and CV were estimated according to the following equations: APE j = 100% × 1 R X ij − X j ∑ R i =1 X j (1) Where Xij is the ith age determination of the jth sea urchin, Xj is the mean age estimate of the jth sea urchin, and R is the number of times each sea urchin is aged. When APEj is averaged across many sea urchins, it becomes an index of average percent error. The CVj is the age precision estimate for the jth sea urchin, and also can be averaged across sea urchin to produce a mean CV: R ∑ CV j = 100% × i =1 (X ij − X j ) 2 R −1 Xj (2) Models Asymptotic and non-asymptotic models were applied to each data set. The asymptotic models were the Von Bertalanffy (1938) and Richards (1959); the re-parameterizations proposed by Schnute and Fournier (1980), and by Ohnishi and Akamine (2006), were 23 used respectively to avoid numerical problems encountered during parameter estimation. The non-asymptotic models proposed by Schnute (1981) and by Tanaka (1982) were also evaluated in addition to a linear model. The parameterizations used are shown in Table 1. Parameter estimation and model selection Parameters of the candidate models mi (i = 1-5) were estimated using nonlinear regression, implemented in AD Model Builder (ADMB v 6.0.2, Otter Research Ltd). Model selection was based on the ITA and bayesian inference. The Akaike information criteria [AIC (Akaike 1973)] and Bayesian or Schwarz information criteria [BIC (Schwarz 1978)] were used to assess model performance. The model with the smallest AIC and BIC value (AICmin and BICmin) was chosen as the model that “best” represented the growth pattern observed in the sea urchin data. In addition, we computed normalized weights of each model (Ward 2008) following Burnham and Anderson (2002) to quantify the plausibility of each model given the data and the set of models as follows: wi = e −1 2 ( ICm − ICmin) 5 ∑e −1 2 ( ICm − ICmin) (3) m =1 where IC corresponds to the AIC or BIC depending on which criterion was used. The weights range between 0 and 1, and are interpreted as the weight of evidence in favor of model i as the best model among the set of all candidate models examined (Burnham and Anderson 2004). Ideally, the ranking of performances, or at least for the choice of 24 best model, would be independent of the criteria or dataset used although this is not necessarily the case. Results Size at age pattern The size and age ranges of the sea urchins differed among the datasets. The sample from Stokes Is. had the widest size range (7.7 to 139.5 mm), followed by Amita Is. (13.2 to 126.2 mm), and then by Williams Is. (11.8 to 109.7 mm). As a reference, the minimum and maximum sizes sampled during the 1995-2004 fisheries monitoring program in the area were 31 mm and 145 mm, respectively and the sizes of sea urchins collected for this analysis extended well beyond the typical size structure of fisheries data of each site (Figure 3). However, not all the size classes were equally represented in our study. The widest age range was also registered in the sample from Stokes Is. (0-13 years); its age range was similar to that obtained in Williams Is. (1-12 years), while less old animals were registered in Amita Is. (1-10 years) (Figure 3). Ageing errors were generally small (CVs less than 6% and APEs < 5%) except in the smallest size classes (10-30 mm for Stokes Is. and 10-40 mm for Amita Is.) (Table 2). Age differences between repeated readings were size-dependent and variable. For example in Stokes Is. the size classes with the highest differences were 80-90 mm (7-10 years) and 100-110 mm (8-11 years) (Table 2). Aging errors were larger in Amita Is. than in Stokes Is. The size-at-age relationship was linear in Stokes Is., and almost linear in Amita Is. and Williams Is. When only the mean size-at-age was considered, the trend was clearly 25 linear in the three datasets (Figure 4). No departures from linearity were apparent in scatter plots of the residuals of the linear model fitted to the size-at-age data, plotted as a function of age in any of the three locations (Figure 5). Growth model selection The results of the model selection for the three locations are presented in Table 3, which includes maximum likelihood parameter estimates, negative log-likelihood values, AIC, AIC differences, BIC and normalized weights for AIC and BIC. The Tanaka model (m4) was the best in Amita Is. and Williams Is. according to the normalized weights based on both AIC and BIC. This model was supported by a weight of evidence of 47.20 and 43.00 % for Amita and 42.84 and 42.67 % for Williams, respectively. In Stokes Is. the ranking of models based on the AIC and BIC differed. The Schnute model (m3) had the highest AIC weight (30.89%) while the linear model (m5) was favored by the BIC weight (82.19%) (Table 3). In order to evaluate if model choice was affected by the different age ranges present in the three samples, the analysis was repeated using only the data in the age range between 2 and 10 years for the three samples (Table 4). In this case, the rankings differed between areas and also depending on the performance statistics used (AIC and BIC). The AIC still favored the Tanaka model for Amita (44.22% of Wi) and Williams (36.27% of Wi), and the Schnute model (m3) for Stokes (30.23% of Wi). On the other hand, the BIC showed that the linear model (m5) was the best among all candidates for Stokes (80.34 % of Wi), Amita (64.91 % of Wi) and Williams (61.87 % of Wi). 26 The comparison of the five models showed that von Bertalanffy model had the worst performance and its estimated rho parameter (c) was always near 1, which implies a linear growth pattern. This non asymptotic behavior was also observed in the Richard model, which showed a very large asymptotic parameter, much larger than the maximum historic observed size. These results support the use of non asymptotic growth models for L. albus. Discussion Observed pattern in the size-at-age relationship The size-at-age relationship found in this study for L. albus is similar to that reported by Barahona et al. (2003), but different from the relationships reported by Gebauer (1992), Gebauer and Moreno (1995) and Duran et al. (1999). The mean size-at-age of Gebauer (1992) and Gebauer and Moreno (1995) were slightly non-linear, but with a similar age range (0-11 years) of this study. On the other hand, a markedly nonlinear pattern was evident in the size-at-age plot reported by Duran et al. (1999). In general we found evidence of a linear pattern in the size-at-age relationship of the three analyzed data sets (at least in the age range between 2 and 10 years), even though there was evidence of a small curvature at young ages for the datasets from Amita Is. and Williams Is. These results differ also from the growth patterns described for many sea urchin species worldwide (Crapp and Willis 1975; Nichols et al. 1985; Gage and Tyler 1985; Gage et al. 1986; Gage 1987; Gage 1992; Brady and Scheibling 2006; Shelton et al. 2006; Blicher et al. 2007). Most sea urchin species are characterized by a nonlinear growth pattern with an asymptotic or sigmoidal shape. 27 The quality of parameter estimation depends on the quantity of the information (Chen et al. 2003). In this sense the sample size and the age range could affect the patterns observed in the size-at-age relationship reported for L. albus. This problem is apparent in the analysis presented by Duran et al. (1999) where some age groups are absent or under represented especially sea urchins of younger (< 3 years) and older ages (> 7 years). In our study we had few data points in the small and large sea urchin size classes (e.g. age 1). The same problems related to the sample size (some age groups poorly represented) also could had affected the studies conducted on other sea urchin species. The influence of both the sampling design and sample size in the characterization of a pattern in the size-at-age relationship has been emphasized for finfish (e.g. Chen 1996; Chen et al. 2003; Brouwer and Griffiths 2005) and should also be considered for sea urchin species. Another important factor is the variability in the size-at-age data. In Duran et al. (1999) and Barahona et al. (2003) this variability was considerably larger than in our study. This variability could be a consequence of ageing errors. An element of subjectivity is always retained in the interpretation of periodic features in the calcified structures used for ageing (e.g. genital plates), which tend to vary markedly in appearance and relative size (Campana et al. 1995). The level of variability is characteristic of each species. Therefore, validation of the ageing technique, such as was done by Gebauer (1992) and Gebauer and Moreno (1995) using L. albus, is an important first step. In other sea urchin species the growth lines in echinoid ossicles have been found to be unreliable indicators of age (e.g. Russell and Meredith 2000). 28 Uncertainty in the ageing, specifically in relation to the precision, reproducibility or ageing consistency, could have affected the size-at-age relationship observed in Amita Is. and Williams Is., and perhaps also the pattern reported by Duran et al. (1999). In this sense the degree of uncertainty (APE and CV) quantified in this study is an important auxiliary information. In all previous studies on sea urchins, no estimates of ageing precision were provided. Lai and Gunderson (1987) assessing the effect of ageing errors on some population parameters, observed that the magnitude of the changes in the under or over-estimation of the mean length-at-age increased when the CV of ageing error increased. In our study ageing error levels remained low; therefore we believe that a conspicuous departure from linearity in the data at larger ages seems rather unlikely. Growth model selection Several models have been used to estimate the individual growth of sea urchin species (Table 5), but the von Bertalanffy, Richards and Gompertz models have been the most common (Grosjean 2001). Also for L. albus the von Bertalanffy model in its traditional (Stotz et al. 1992; Gebauer 1992; Gebauer and Moreno 1995; Duran et al. 1999) and reparameterized (Barahona et al. 2003) formulation have been used. The choice of a growth model often remains arbitrary or is a question of personal preference (Fletcher 1974; Grosjean 2001). This tendency is well illustrated by the variety of models used to represent sea urchin individual growth (Table 5). The application of the information theory approach (Burnham and Anderson 2002) or bayesian methods provides a means for using objective criteria in model selection. These approaches encompass a set of basic steps, including an a priori specification of 29 a set of candidate models, the estimation of parameters and their precision and the model selection based on parsimonious approaches such as Akaike information criterion (Akaike 1973) or Bayesian information criterion (Schwarz 1978). The principle of parsimony implies the selection of a model with the smallest possible number of parameters for an adequate representation of the data, a bias versus variance tradeoff. The application of this approach in sea urchin growth studies has been limited and most often the model selection has been based on other statistical analysis (Table 5). The model selection approach revealed differences in the behavior of the AIC and BIC. The AIC always favored the Tanaka model in Amita Is. and Williams Is., and the Schnute model in Stokes Is., irrespective of whether the complete or restricted age ranges were used. The BIC yielded the same results only for Amita and Williams islands when all data were analyzed. This contrasted with the linear pattern favored for all locations when the age ranges were restricted (ages 2 to 10). According to Quinn and Deriso (1999), the AIC tends to favor models with more parameters (what we see in this study), while the BIC is more likely to result in a more parsimonious model, as it more heavily penalizes the inclusion of additional parameters. The differences among the size-at-age relationships observed and modeled could be an effect of the individual variability (process error) and related to the uncertainty in the age estimation (observation error). Katsanevakis and Maravelias (2008) emphasized that model selection is not only dependent on the species-specific growth pattern but also on the quality of the data and the amount of information, which may explain different results among different datasets for the same species. 30 The difficulty in the selection of a growth model for L. albus, and perhaps for other sea urchin species, is evident. In none of the samples was the best model a clear winner (wi > 0.9 or 90%), even if the asymptotic models were omitted. But the BIC supported values of wi > 72% in contrast to the AIC which resulted in values of wi < 61%. This supports the conclusion by Ebert and Russell (1993) that a unique growth model for sea urchins in general does not exist, but that some generalization of the Tanaka function seems promising. Other examples of this problem have been seen to Strongylocentrotus franciscanus where Ebert and Russell (1993) and Shelton et al. (2006) found that Tanaka (1982) model was the best option while Rogers-Bennett et al. (2003) reported a logistic dose-response model as the best one. Lamare and Mladenov (2000) suggested that the growth of Evechinus chloroticus was non-asymptotic but still selected the Richards model as the best candidate. The use of asymptotic models to represent the growth of long-lived species has been questioned (Ebert and Russell 1993). In this study a non-asymptotic model was clearly the best option, and the von Bertalanffy model was the least supported. Besides, although the Richards model was also supported by the data (Δi < 2), the asymptotic size estimated with this model was unrealistically large and should be interpreted as just a model parameter with no biological meaning. This justified the rejection of both the von Bertalanffy (1938) and the Richards (1959) models. Furthermore, the model-based size-at-age predictions made by the linear and von Bertalanffy models were almost identical (Figure 4). Based on our analysis, we believe that the choice of a model for L. albus should be conditioned on the goal of the model. While the Tanaka model was favored by the Information Approach, from a practical viewpoint, a linear model would 31 be perfectly adequate in fisheries applications, for example to estimate the age composition from length data. Implications for further analyses Further issues such as growth modeling based on repeated-age readings and assessment of the effect of ageing error on model selection based on simulations should be considered in future growth studies on this species. According to Cope and Punt (2007), the first topic considered is important, because they demonstrate a consistent bias in parameter estimates when only one age reading is used, regardless of sample size and method used to incorporate the information obtained from multiple readings. They recommend the use of a random-effect method using a gamma distribution in the estimation. The linear growth pattern reported in this study and its consistency over space is important for further studies, such as the analysis of spatial variability in growth. According to Turon et al. (1995) the use of a single model to fit all growth data is preferable for comparison purposes. In our case, a linear model approach (e.g. linear mixed-effect models) would provide a useful framework to assess simultaneously the effect of several factors and scales on sea urchin growth. It implies a simplification over the models commonly used in population dynamic and stock assessment. 32 Acknowledgements Luis Flores is thankful to CONICYT, Direccion de Postgrado (UDEC) and CREO grant. We thank Manira Matamala (Consultora Pupelde) and her staff in Quellon as well as Victor Acuña and his family from Melinka for their hospitality and collaboration during the fieldwork. LF is thankful to Paulina Gebauer who kindly provided initial training in genital plate reading. Finally, we want to thank Lobo Orensanz, Carlos Molinet and Victor Ruiz for activly participating in the 2007 scientific cruise to the Chonos archipelago in the LM Ayayay research boat. References Agatsuma Y, Nakatao A (2004) Age determination, reproduction and growth of the sea urchin Hemicentrotus pulcherrimus in Oshoro Bay, Hokkaido, Japan. J Mar Biol Assoc U K 84: 401-405 Akaike H (1973) Information theory and an extension of the maximum likelihood principle. In: Petran BN, Csaaki F (eds) International Symposium on Information Theory, 2nd ed., Acadeemiai Kiadi, Budapest, Hungary. pp 267-281 Andrew N, Agatsuma Y, Ballesteros E, Bazhin A, Creaser E, Barnes D, Botsford L, et al (2002) Status and Management of World Sea Urchin Fisheries. Oceanogr Mar Biol A Rev 40: 343–425 33 Barahona N, Jerez G (1997) La pesquería del erizo (Loxechinus albus) en las regiones X a XII de Chile: 13 años de historia (1985–1997). In: Resúmenes XII Congreso de Ciencias del Mar (Chile), 14 pages Barahona N, Orensanz JM, Parma A, Jerez G, Romero C, Miranda H, Zuleta A, Cataste V, Gálvez P (2003) Bases biológicas para rotación de áreas en el recurso erizo. Informe Final. Fondo de Investigación Pesquera, Proyecto FIP No. 2000 – 18, 197 pages, tables, figures, appendices. Instituto de Fomento Pesquero (IFOP), Valparaíso (Chile) Blicher ME, Rysgaard S, Sejr MK (2007) Growth and production of sea urchin Strongylocentrotus droebachiensis in a high-Arctic fjord, and growth along a climatic gradient (64 to 77°N). Mar Ecol Prog Ser 341:89-102 Botsford LW, Quinn JF, Wing SR, Brittnacher JG (1993) Rotating spatial harvest of a benthic invertebrate, the red sea urchin Strongylocentrotus franciscanus. In: Kruse G, Eggers DM, Marasco RJ, Pautzke C, Quinn TJ II (eds) Proceedings of the International Symposium on Management Strategies of Exploited Fish Population, University of Alaska, Fairbanks, Alaska. pp. 408-429 Botsford LW, Smith BD, Quinn JF (1994) Bimodality in size distribution: The red sea urchin Strongylocentrotus franciscanus as an example. Ecol Appl 4: 42–50 Brady SM, Scheibling RE (2006) Changes in growth and reproduction of green sea urchins, Strongylocentrotus droebachiensis (Muller), during repopulation of the shallow subtidal zone after mass mortality. J Exp Mar Biol Ecol 335: 277–291. 34 Bromaghin JF (1993) Sample size determination for interval estimation of multinomial probablities. The American Statistician. 47(3): 203–206 Brouwer SL, Griffiths MH (2005) Influence of sample design on estimate of growth and mortality in Argyrozona argyrozona (Pisces: Sparidae). Fish Res 74: 44–54. Burnham KP, Anderson DR (2002) Model selection and multimodel inference: a practical information – theoretic approach. 2nd Ed., Springer-Verlag, New York, NY Burnham KP, Anderson DR (2004) Multimodel Inference: Understanding AIC and BIC in Model Selection. Sociological Methods & Research 22(2): 261-304. Campana SE, Annand MC, McMillan JI (1995) Graphical and statistical methods for determining the consistency of age determinations. Trans Am Fish Soc 124: 131-138 Campana S (2001) Accuracy, precision and quality control in age determination, including a review of the use and abuse of age validation methods. J Fish Biol 59:197242 Cellario Ch, Fenauz L (1990) Paracentrotus lividus (Lamarck) in culture (larval and benthic phases): Parameters of growth observed during two years following metamorphosis. Aquaculture 84: 173-188 35 Chen Y (1996) A Monte Carlo study on impacts of the size of subsample catch on estimation of the fish stock parameters. Fish Res 26: 207-223 Chen Y, Chen L, Stergiou KI (2003) Impacts of data quantity on fisheries stock assessment. Aquat Sci 65: 92-98 Comely CA, Ansell AD (1988) Population density and growth of Echinus esculentus L. on the Scottish west coast. Estuarine, Coastal and Shelf Science, 29: 311-334 Cope JM, Punt AE (2007) Admitting ageing error when fitting growth curves: an example using the von Bertalanffy growth function with random effects. Can J Fish Aquat Sci 64: 205-218 Crapp GB, Willis ME (1975) Age determination in the sea urchin Paracentrotus lividus (Lamarck), with notes on the reproductive cycle. J Exp Mar Biol Ecol 20: 157-178 Duran L, Falcón C, Gálvez M, Godoy C, Melo C, Oliva D (1999) Elaboración de claves talla-edad para el recurso erizo. Proyecto FIP No. 1997-30, 197 pages, tables, figures, appendices. Instituto de Fomento Pesquero (IFOP), Valparaíso (Chile) Ebert TA, Russell MP (1992) Growth and mortality estimates for red sea urchin, Strongylocentrotus franciscanus, from San Nicolas Island, California. Mar Ecol Prog Ser 81:31-41 36 Ebert TA, Russell MP (1993) Growth and mortality of subtidal red sea urchin (Strongylocentrotus franciscanus) at San Nicolas Island, California, USA: problems with models. Mar Biol 117: 79-89 Ebert TA, Dixon JD, Schroeter SC, Kalvass PE, Richmond NT, Bradbury WA, Woodby DA (1999) Growth and mortality of red sea urchins (Storngylocentrotus franciscanus) across a latitudinal gradient. Mar Ecol Prog Ser 190:189-209 Ebert TA, Southon JR (2003) Red sea urchin (Strongylocentrotus franciscanus) can live over 100 years: confirmation with A-bomb 14carbon. Fishery Bulletin, 101(4): 915-922. Fletcher RI (1974) The quadratic law of damped exponential growth. Biometrics, 30: 111-124 Gage JD, Tyler PA (1985) Growth and recruitment of the deep-sea urchin Echinus affinis. Mar Biol 90: 41-53 Gage JD, Tyler PA, Nichols D (1986) Reproduction and growth of Echinus acutus var. norvegicus Duber & Koren and E. elegans Duber & Koren on the continental slope off Scotland. J Exp Mar Biol Ecol 101: 61-83 Gage JD (1987) Growth of the deep-sea irregular sea urchins Echinosigra phiale and Hemiaster expergitus in the Rockall Trough (N.E. Atlantic Ocean). Mar Biol 96: 19-30 37 Gage JD (1992) Natural growth bands and growth variability in the sea urchins Echinus esculentus: results from tetracycline tagging. Mar Biol 114: 607-616 Gebauer P (1992) Validación experimental de los anillos de crecimiento de Loxechinus albus (Molina, 1782) (Echinodermata: Echinoidea) en la reserve marina de Mehuin. Chile. Tesis, Esc. Biología Marina, Univ. Austral de Chile. 66 pp Gebauer P, Moreno CA (1995) Experimental validation of the growth rings of Loxechinus albus (Molina, 1782) in southern Chile (Echinodermata: Echinoidea). Fish Res 21: 423-435 Grosjean Ph (2001) Growth model of reared sea urchin Paracentrotus lividus (Lamarck, 1816). Ph.D. thesis, Universite Libre de Bruxelles, Bélgica. Grosjean Ph, Spirlet Ch, Jangoux M (2003) A functional growth model with intraspecific competition applied to a sea urchin, Paracentrotus lividus. Can J Fish Aquat Sci 60: 237-246 Katsanevakis S, Maravelias CD (2008) Modelling fish growth: multi-model inference as a better alternative to a priori using von Bertalanffy equation. Fish and Fisheries, 9: 178-187 Kenner MC (1992) Population dynamics of the sea urchin Strongylocentrotus purpuratus in a central California kelp forest: recruitment, mortality, growth, and diet. Mar Biol 112:107-118 38 Keesing JK, Hall KC (1998) Review of harvests and status of world’s sea urchin fisheries points to opportunities for aquaculture. J Shellfish Res, 17: 1597-1604 Lai HL, Gunderson DR (1987) Effects of ageing errors on estimates of growth, mortality and yield per recruit for walleye Pollock (Theragra chalcogramma). Fish Res 5: 287-302 Lamare MD, Mladenov PH (2000) Modelling somatic growth in the sea urchin Evechinus chloroticus (Echinoidea: Echinometridae). J Exp Mar Biol Ecol 243: 17-43 Morgan LE, Botsford LW, Wing SR, Smith BD (2000) Spatial variability in growth and mortality of the red sea urchin Strongylocentrotus franciscanus, in northern California. Can J Fish Aquat Sci 57: 980-992 Moreno CA, Barahona N, Molinet C, Orensanz JM, Parma A, Zuleta A (2007) From crisis to institutional sustainability in the Chilean Sea Urchin Fishery. Chapter 3. In: McClanahan TR, Castilla JC (eds) Fisheries Management: Progress towards sustainability, Blackwell Publishing, pp. 43-64 Nichols D, Sime AAT, Bishop GM (1985) Growth in populations of the sea urchin Echinus esculentus L. (Echinodermata: Echinoidea) from the English Channel and firth of Clyde. J Exp Mar Biol Ecol 86: 219-228 39 Ohnishi S, Akamine T (2006) Extension of von Bertalanffy growth model incorporating growth patterns of soft and hard tissues in bivalve mollusks. Fish Sci, 72: 787-795 Orensanz JM, Parma AM, Jerez G, Barahona N, Montecinos M, Elias I (2005) What are the key elements for the sustainability of “S-Fisheries”? Insights from South America. Bull Mar Sci 76: 527-556 Quinn JF, Wing SR, Botsford LW (1993) Harvest refugia in marine invertebrate fisheries: models and applications to red sea urchin Strongylocentrotus franciscanus. Amer Zool 33: 537-550 Quinn TJ, Deriso RB (1999) Quantitative fish dynamics. Oxford University Press, New York. Richards FJ (1959) A flexible growth function for empirical use. J Exp Bot 10: 290-300. Rowley RJ (1990) Newly settled sea urchins in a kelp bed and urchin barren ground: a comparison of growth and mortality. Mar Ecol Prog Ser 62: 229-240 Rogers-Bennett L, Rogers DW, Bennett WA, Ebert TA (2003) Modeling red sea urchin (Strongylocentrotus franciscanus) growth using six growth functions. Fish Bull 101(3): 614-626 Russell MP (1987) Life history traits and resource allocation in the purple sea urchin Strongylocentrotus purpuratus (Stimpson). J Exp Mar Biol Ecol 108: 199-216 40 Russell MP, Meredith RW (2000) Natural growth lines in echinoid ossicles are not reliable indicators of age: a test using (Strongylocentrotus droebachiensis). Invert Biol, 119: 410-420 Schnute J, Fournier D (1980) A new approach to length-frequency analysis: growth structure. Can J Fish Aquat Sci 37: 1337-1351 Schnute J (1981) A versatile growth model with statistically stable parameters. Can J Fish Aquat Sci 38: 1128-1140 Schwarz G (1978) Estimating the dimension of a model. The Annals of Statistics. 6, 461-464 Sime AAT, Cranmer GJ (1985) Age and growth of North Sea echinoids. J Mar Biol Assoc U K 65: 583-588 Shelton AO, Woodby DA, Hebert K, Witman JD (2006) Evaluating Age Determination and Spatial Patterns of Growth in Red Sea Urchins in Southeast Alaska. Trans Am Fish Soc 135:1670-1680 Smith BD, Botsford LW, Wing SR (1998) Estimation of growth and mortality parameters from size frequency distribution lacking age patterns: the read sea urchin (Strongylocentrotus franciscanus) as an example. Can J Fish Aquat Sci 55: 1236-1247 41 Soualili DL, Guillou M, Semroud R (1999) Age and Growth of the echinoid Sphaerechinus granularis from the Algerian coast. J Mar Biol Assoc U K 79: 1139- 1140 Stotz W, González S, López C (1992) Siembra experimental del erizo rojo Loxechinus albus (Molina) en la costa expuesta del centro-norte: efectos del erizo negro Tetrapygas Níger (Molina) sobre la permanencia y crecimiento de juveniles. Invest Pesq (Chile) 37: 107-117 Tanaka M (1982) A new growth curve with expresses infinite incresase. Publ. Amakusa Mar. Biol. Lab. 6: 167-177 Turon X, Giribet G, Lopez S, Palacin C (1995) Growth and population structure of Paracentrotus lividus (Echinodermata: Echinoidea) in two contrasting habitats. Mar Ecol Prog Ser 122:193-204 Vadas RL, Smith B, Beal B, Dowling T (2002) Sympatric growth morphs and size bimodality in the green sea urchin (Strongylocentrotus droebachiensis). Ecol Monogr 72: 113-132 Von Bertalanffy L (1938) A quantitative theory of organic growth. Human Biology 10: 181-213 Ward EJ (2008) A review and comparison of four commonly used Bayesian and maximum likelihood model selection tools. Ecol Model 211: 1-10 42 Williams H (2002) Sea Urchin Fisheries of the World: A Review of their status, management strategies and biology of the principal species 43 Table 1. – Alternative growth models fitted to size-at-age data of L. albus. Letters a-d represent model parameters, t is age, and τ1 and τ 2 correspond to a minimum and maximum age defined in the model. Model Equation m1 D t = a + (b − a) m2 Dt = m3 Model/Source Von Bertalanffy Schnute and Fournier (1980) 1 − c t−τ 1 1 − c τ2 −τ 1 a (1 + Richards Ohnishi and Akamine (2006) 1 be −c( t −d ) c ) −d ( t − τ 1) ⎛ c c c 1− e ⎜ D t = ⎜ a + (b − a ) −d ( τ − τ ) 1− e 2 1 ⎝ 1 ⎞c ⎟ ⎟ ⎠ Schnute Schnute (1981) m4 ⎛ 1 ⎞ ⎛ ⎟⎟ log⎜ 2 a ( t − b) + 2 a 2 ( t − b) 2 + a c ⎞⎟ + d D t = ⎜⎜ ⎠ ⎝ a⎠ ⎝ Tanaka Tanaka (1982) m5 Dt = a + b t Linear 44 Table 2. – Uncertainty in age estimation (three readings) based on average percent error (APE) and coefficient of variation (CV) estimated for subsamples from the collections of Stokes and Amita Islands. Stokes Size class (mm) Range of age 10 – 20 01 – 02 20 – 30 02 – 03 30 – 40 02 – 04 40 – 50 03 – 05 50 – 60 05 – 06 60 – 70 05 – 07 70 – 80 06 – 08 80 – 90 07 – 10 90 – 100 08 – 10 100 – 110 08 – 11 110 – 120 10 – 12 120 – 130 11 – 12 n 2 16 19 17 15 23 25 25 16 19 15 4 APE 0.133 0.034 0.019 0.027 0.032 0.025 0.024 0.016 0.021 0.012 0.017 0.010 CV 0.173 0.044 0.025 0.035 0.041 0.032 0.031 0.021 0.028 0.016 0.022 0.013 Amita Range of age n APE 00 – 02 5 0.253 01 – 03 18 0.062 02 – 04 17 0.079 03 – 05 18 0.028 04 – 07 20 0.030 05 – 07 20 0.022 05 – 09 18 0.039 07 – 10 17 0.042 07 – 10 18 0.025 09 – 11 11 0.004 CV 0.329 0.081 0.102 0.037 0.039 0.028 0.050 0.056 0.033 0.005 45 Table 3. – Parameter estimates and standard deviation (in parenthesis), and results of model selection for the respective age range in each zone: Amita Is. (1 to 10), Stokes Is. (0 to 13) and Williams Is. (1 to 12). Akaike’s information criterion (AIC), Akaike differences (Δi), normalized weights of AIC (Wi,1), Bayesian Information criterion (BIC) and normalized weights of BIC (Wi,2). Zones/Model Stokes m3 m2 m4 m5 m1 Amita m4 m3 m2 m5 m1 Williams m4 m3 m2 m5 m1 Parameters A b c d Negative log-likelihood AIC Δi Wi,1 (%) BIC Wi,2 (%) 8.52 (2.70) 136.14 (2.41) 0.75 (0.30) 0.02 (0.05) 891.757 1791.51 0.00 30.89 1807.70 4.87 720.70 (1288.80) 0.02 (0.05) -0,75 (0.30) 10.72 (10.18) 891.757 1791.51 0.00 30.89 1807.70 4.87 0.0000504 (1.44) 9.81 (4.79) 0.00904 (0.07) 1032.70 (819.87) 891.933 1791.87 0.36 25.80 1808.06 4.07 ------- ------- 894.979 1793.96 2.45 9.07 1802.05 82.19 13.38 (0.62) 3.30 (0.72) 124.15 (0.62) 10.07 (0.10) 1.00 (0.00) ------- 894.979 1795.96 4.45 3.34 1808.10 3.99 0.0003246 (0.48) 6.93 (0.58) 0.00971 (0.05) 989.770 1987.54 0.00 47.20 2004.16 43.00 384.24 (91.64) 19.21 (1.21) 101.05 (1.01) 0.03 (0.57) 0.14 (0.10) 990.356 1988.71 1.17 26.30 2005.33 23.96 197.59 (81.22) 0.14 (0.10) -0.03 (0.57) 6.97 (0.98) 990.356 1988.71 1.17 26.30 2005.33 23.96 5.53 (0.64) 9.45 (0.11) ------- ------- 997.528 1999.06 11.52 0.15 2007.36 8.68 14.99 (0.54) 118.99 (0.75) 1.00 (0.00) ------- 997.528 2001.06 13.52 0.05 2013.52 0.40 0.0005757 (0.27) 6.70 (0.22) 0.00774 (0.08) 298.63 (35.63) 738.576 1485.15 0.00 42.84 1500.11 42.67 20.06 (1.01) 118.83 (1.70) -1.04 (0.54) 0.32 (0.09) 738.978 1485.96 0.81 28.58 1500.91 28.60 139.91 (11.86) 0.32 (0.09) 1.04 (0.54) 6.67 (0.26) 738.978 1485.96 0.81 28.58 1500.91 28.60 6.00 (0.86) 9.70 (0.13) ------- ------- 750.268 1504.54 19.39 0.003 1512.01 0.111 15.70 (0.75) 122.43 (0.83) 0.99 (0.00) ------- 750.268 1506.54 21.39 0.001 1517.75 0.006 46 Tale 4. – Parameter estimates and standard deviation (in parenthesis), and results of the model selection using data for the age range between 2 and 10 years. Akaike’s information criterion (AIC), Akaike differences (Δi), normalized weights of AIC (Wi,1), Bayesian Information criterion (BIC) and normalized weights of BIC (Wi,2). Zones/Model Stokes m3 m2 m4 m5 m1 Amita m4 m3 m2 m5 m1 Williams m4 m3 m2 m5 m1 Parameters A b c d Negative log-likelihood AIC Δi Wi (%) BIC Wi (%) 16.25 (1.97) 105.16 (0.75) 0.83 (0.46) 0.005 (0.08) 864.789 1737.58 0.00 30.23 1753.64 5.35 3433.80 (20933.0) 0.0049 (0.03) -0.83 (0.18) 35.36 (171.67) 864.789 1737.58 0.00 30.23 1753.64 5.35 0.00000511 (8.69) 49.92 (194.88) 0.000041 (63.61) 6197.10 (56512.00) 864.853 1737.71 0.13 28.33 1753.77 5.01 ------- ------- 868.094 1740.19 2.61 8.20 1748.22 80.34 ------- 868.094 1742.19 4.61 3.02 1754.24 3.96 3.21 (0.76) 13.29 (0.65) 10.08 (0.11) 124.21 (0.68) 1.00 (0.00) 0.000329 (0.56) 6.92 (0.58) 0.009693 (0.05) 381.21 (106.30) 973.520 1955.04 0.00 44.22 1971.58 14.85 19.55 (1.66) 100.97 (1.06) -0.11 (0.77) 0.16 (0.13) 974.062 1956.12 1.08 25.77 1972.67 8.61 182.91 (77.86) 0.16 (0.13) 0.11 (0.77) 6.89 (0.82) 974.062 1956.12 1.08 25.77 1972.67 8.61 ------- 978.181 1960.36 5.32 3.09 1968.63 64.91 ------- 978.181 1962.36 7.32 1.14 1974.77 3.01 5.00 (0.68) 14.53 (0.57) 9.54 (0.11) ------- 119.45 (0.78) 1.00 (0.00) 0.000523 (0.51) 6.75 (0.39) 0.007841 (0.10) 312.24 (73.05) 644.422 1296.84 0.00 36.27 1311.18 13.26 20.87 (1.74) 104.21 (1.28) -1.79 (1.65) 0.45 (0.29) 644.654 1297.31 0.47 28.67 1311.64 10.53 6.71 (0.31) 125.87 (22.10) 0.45 (0.29) 3.64(1.10) 10.07 (0.17) 13.71 (0.95) 124.48 (1.10) 1.79 (1.65) ------1.00 (0.00) 644.654 1297.31 0.47 28.67 1311.64 10.53 ------- 648.468 1300.94 4.10 4.67 1308.10 61.87 ------- 648.468 1302.94 6.10 1.72 1313.69 3.78 47 Table 5. – Models used to fit sea urchin growth data in multi-model studies (in bold the model chosen). * Taken from Grosjean 2001 (pages 54-55); a: EC (experimental culture), PR (plate readings) and MR (mark-recapture); b: AIC (Akaike information criterion), BC (biological criterion), CV (coefficient of variation), PP (personal preference), R (correlation coefficient), RA (residual analysis), RRS (residual sum of square), SSE (square standard error). Growth estimate methoda Model selectionb Species Growth model Diadema sectosum* Von Bertalanffy in Length, Richards, Gompertz, Logistic Ebert, 1999 Tripneustes gratilla* Von Bertalanffy in Length, Gompertz, Logistic, Johnson Dafni, 1992 Echinus acutus Von Bertalanffy in Length, Gompertz, Logistic PR PP Gage et al, 1986 Echinus elegans Von Bertalanffy in Length, Gompertz, Logistic PR PP Gage et al, 1986 Echinus affiants Von Bertalanffy in Length, Gompertz, Logistic, Richards, Preece-Baines PR RSS Gage and Taylor, 1985 Paracentrotus lividus Von Bertalanffy in Length, Gompertz EC R Gompertz, Logistic, Richards PR RSS Von Bertalanffy in Length, Von Bertalanffy in weight, Gompertz, Logistic, 4pLogistic, Weibull, EC Strongylocentrotus intermedius* Von Bertalanffy in Length, Gompertz Strongylocentrotus franciscanus Richards, Tanaka, Jolicoeur Reference Cellario and Fenaux, 1990 Turon et al, 1995 Grosjean et al, 2003 Fuji, 1967 MR PP Ebert and Russell, 1993 48 Logistic, Gaussian, Tanaka, Ricker, Richards, Von Bertalanffy 1 MR RSS Roger-Bennett et al, 2003 Brody- Bertalanffy, Richards, Tanaka, Jolicoeur PR AIC Shelton et al, 2006 Evechinus chloroticus Von Bertalanffy in Length, Richards, Tanaka, Jolicoeur EC, MR CV, SSE, RA(D) Echinosigra phiale Von Bertalanffy in Length, Gompertz, Logistic PR BC Gage, 1987 PR BC, RSS Gage, 1987 Hemiaster expertigus Von Bertalanffy in Length, Gompertz, Logistic PR RSS Gage, 1987 PR RSS Gage, 1987 Spatangus purpureus Von Bertalanffy in Length, Gompertz, Logistic Echinocardium pennatifidum Von Bertalanffy 1, Gompertz, Logistic Lamare and Mladenov, 2000 49 Figure 1. - Annual landings of sea urchin fisheries in Chile by geographical zone from 1968 to 2008. Lines and dots correspond to overall landings. 50 Figure 2. - Location of the three sampling sites in southern Chile (Chonos Archipelago). 51 Figure 3. – Overall size structure by site obtained from 1995-2004 fisheries sampling program. Arrows represent minimum and maximum test sizes from sea urchin collected and aged in this study. 52 Figure 4. – Size-at-age data (dots) and fitted models (solid line: Von Bertalanffy; dashed line: Richards; dotted line: Schnute; dot dashed line: Tanaka; long dashed line: Linear). 53 Figure 5. – Residual values at age for the linear models fitted to the data from Amita Is. (a), Stokes Is. (b), and Williams Is. (c). 54 CAPÍTULO 3 Variabilidad espacial en el crecimiento somático del erizo, Loxechinus albus, en la costa sur de Chile: una aproximación lineal jerárquica. Resumen La variabilidad espacial del erizo Loxechinus albus fue estudiada en varios sitios de la costa sur de Chile, caracterizados por dos tipos de ambientes ecológicos, uno de influencia oceánica y otro de influencia de fiordos y canales. Además, se examinó el efecto de diferentes escalas espaciales mediante la construcción de modelos lineales de acuerdo a una estructura jerárquica. El crecimiento fue determinado por medio de la relación talla a la edad. Un patrón lineal de crecimiento fue observado en cada una de los sitios de estudio y dio cuenta de una baja tasa de crecimiento para el erizo L. albus. El modelo que consideró individualmente cada procedencia, se identificó como el modelo que mejor explica las variaciones en el crecimiento del erizo y las comparaciones entre cada procedencia mostraron diversos resultados, encontrándose procedencias que presentaban mayor talla promedio a la edad en comparación a otras. Por otro lado, los ambientes ecológicos no tuvieron mayor efecto en las variaciones encontradas, pero si se observo mayor talla promedio en los erizos de procedencias de mayor influencia oceánica. Además no se encontró un efecto de la escala latitudinal. Los resultados sugieren que las variaciones a escalas intermedias deben ser consideradas dentro de los esquemas de monitoreo y estrategias de manejo para la pesquería. Palabras claves: escalas espaciales, modelo lineal, erizo, crecimiento somático. 55 Introducción La importancia ecológica que tiene la variabilidad espacial en las características demográficas de las especies marinas, es ampliamente reconocida. Esto se debe a que tanto la dinámica de poblaciones locales así como agregadas están fuertemente influenciada por las diferencias que se dan a distintas escalas espaciales. A su vez, en conjunto con la variabilidad que se da también a distintas escalas temporales, tienen considerables repercusiones desde un punto de vista pesquero (Barnes y Crook, 2001). Sin embargo, la variabilidad espacial tiene una particular importancia en especies de comportamiento bentónico, y por lo tanto, ha recibido mayor atención (e.g. Defeo, 1993; Orensanz y Jamieson, 1998; Roa y Tapia, 1998; Fiori y Morsán, 2003; Caddy y Defeo 2003; Ernst et al., 2005). Los stocks costeros de especies sedentarias que son objetivo de pesquerías artesanales son muy sensibles a estas variaciones porque están espacialmente estructurados como metapoblaciones, es decir subpoblaciones que están interconectadas por la dispersión larval, donde los efectos de la pesca son focalizados. Como resultado de esto, tanto la dinámica de la población local explotada como el proceso de pesca son dependientes de la heterogeneidad espacial (Orensanz et al., 2005), la cual muchas veces difiere a distintas escalas. El entendimiento de la escala a la cual ocurren estas variaciones, es un paso previo para entender la dinámica poblacional y pesquera de un stock bentónico sedentario. Los erizos son actualmente una de las especies bentónicas de hábitos sedentarios más importantes en las pesquerías del mundo, debido a la comercialización de sus gónadas (conocidas como lenguas). Sus principales mercados son Japón y Estados Unidos de Norteamérica (USA) (Williams, 2002). La captura mundial esta compuesta principalmente 56 por 22 especies que son las que mayor volumen de captura aportan a la pesquería. Una de ellas es el erizo L. albus [uno de los más importantes pastoreantes bentónicos sobre los ambientes rocosos intermareales y submareales a lo largo de la costa Chilena (Vásquez, 2001)]. En los últimos años la pesquería del erizo chileno ha sostenido la producción mundial como consecuencia de la disminución en los desembarques que han ocurrido en la mayor parte de otras regiones (Williams, 2002; Andrew et al., 2002). Sin embargo, los cambios en las poblaciones de erizos podrían ser también explicados por fluctuaciones naturales (Elner y Vadas, 1990; Barnes y Crook, 2001) y no sólo como consecuencia de la pesca. Sea cual sea la razón de estos cambios, la dinámica poblacional depende de las variaciones que se produzcan en las características poblacionales consideradas los factores principales (asentamiento, mortalidad y crecimiento) que controlan la productividad de una población. El crecimiento en talla es uno de los más importantes componentes de la producción biológica, y el problema de la “sobrepesca por crecimiento” de acuerdo con Hilborn y Walters (1992) no debe ser ignorado en las pesquerías. Esto ha motivado a muchos investigadores de erizos a estudiar el crecimiento en distintos estados ontogenéticos, asentados-juveniles (e.g. Andrew y Choat, 1985; Rowley, 1992) o adultos (e.g. Ebert y Russell, 1992; Turon et al., 1995; Ebert et al., 1999; Wing et al., 2003; Pederson y Johnson, 2008), así como en diferentes especies. Además, desde que ha sido propuesto por Botsford et al. (1993) y Quinn et al. (1993) que las estrategias espacialmente explicitas (e.g estrategias de explotación espacial basada en la rotación de áreas o refugios permanentes de explotación) son sensitivas a los cambios en el crecimiento, la variabilidad espacial en el crecimiento de los erizos ha sido el centro de atención de los investigadores a varias escalas espaciales y usando diferentes enfoques de análisis. 57 A pesar de que el erizo L. albus es actualmente la especie de mayor importancia comercial, el estudio de su crecimiento ha sido escaso. Lo que se conoce acerca de la especie L. albus, es que tiene un lento crecimiento, una longevidad aproximada de 20 años y de acuerdo a reportes una talla máxima de diámetro de 130 mm (Stotz et al., 1992; Gebauer, 1992; Gebauer y Moreno, 1995) Recientemente, Flores et al (en revisión) confirmaron la proposición de Barahona et al. (2003) respecto de un patrón lineal que regiría el crecimiento somático del erizo. Flores et al (en revisión) observaron un patrón lineal de crecimiento para el rango de edades comprendido entre los 2 y 10 años. La variabilidad espacial en el crecimiento de L. albus es un tema prácticamente desconocido. Gutierrez y Otsu (1975) y Bückle et al. (1977) reportaron diferencias en los incrementos en talla a lo largo de la costa de Chile, encontrando crecimientos de 2 mm/mes en el norte, mientras que para la zona central y sur de 1.1 mm/mes y 0.24 mm/mes, respectivamente. Los factores que podrían explicar esas diferencias son el alimento (González et al., 1993) y la temperatura (Bückle et al., 1977). Por lo tanto, debido a la importancia de la variabilidad espacial en el crecimiento desde una perspectiva pesquera, especialmente para apoyar desarrollo de estrategias espacialmente explícitas, el principal objetivo de este estudio es evaluar los patrones de crecimiento del erizo a distintas escalas, cuantificando la variabilidad espacial del crecimiento en esta especie usando una aproximación lineal y jerárquica. 58 Materiales y Métodos Área de estudio y muestreo de campo Un total de ocho zonas fueron muestreadas en dos regiones del sur de Chile [X y XI (Figura 1)], a través de un gradiente latitudinal y longitudinal de acuerdo a dos diferentes ambientes ecológicos [uno de mayor influencia oceánica y otro de canales y fiordos (Figura 2)]. Algunas de las zonas estuvieron conformadas por un conjunto de procedencias (en algunos de los casos sitios relacionados con islas), particularmente en la XI Región. En total 13 procedencias fueron muestreadas (Figura 3). Las muestras de erizos fueron colectadas de acuerdo a un esquema de muestreo estratificado a la talla (≥ 26 erizos por rango de talla) basado en el esquema propuesto por Bromaghin (1993) para la definición del tamaño de muestra total. El muestreo fue independiente (Enero 2007) y dependiente de la pesquería (Septiembre-Octubre 2006/2007). La talla (diámetro de testa sin púas) y la corona de cada erizo fueron registradas y colectadas en terreno, respectivamente. Posteriormente, en laboratorio la corona fue congelada para facilitar el proceso de extracción de las placas genitales. Datos talla a la edad basada en las placas genitales La variabilidad espacial en el crecimiento fue evaluada mediante el uso de datos de talla a la edad. Wang y Milton (2000) han resaltado que esta clase de información es más útil como punto de referencia biológico en estudios comparativos más que el uso de alguno de los parámetros de crecimiento de un modelo. La estimación de la edad se basó en la metodología empleada por Gebauer (1992) y Gebauer y Moreno (1995) para leer e interpretar los anillos de crecimiento en las placas genitales. Las placas fueron extraídas de la corona, y antes de leer 59 los anillos de crecimiento, las placas fueron pulidas con una lija de agua fina y luego fueron inmersas en xilol, para ser luego observadas en un estereo-microscopio con luz reflejada. Una de las cinco placas genitales que tiene cada corona fue seleccionada al azar para examinar los anillos claros y oscuros. El anillo oscuro (o traslucido), el cual esta asociado con un período de crecimiento lento en invierno, fue usado para la asignación de la edad. Por lo tanto, la edad fue estimada hasta el tiempo de colección. Análisis espacial basado en un enfoque lineal Varios modelos lineales fueron implementados para caracterizar y cuantificar las variaciones espaciales en el crecimiento del erizo. La variable respuesta fue la talla media a la edad, modelada con una distribución de probabilidad gausiana. La construcción de cada modelo consideró variables de orden biológico (edad), ecológico (influencia oceánica y de influencia de canales y fiordos) y espacial (procedencia, zona). En el modelo 1 (M1) no hubo consideración del ambiente ecológico ni escala espacial, por lo tanto se realizó un ajuste combinando toda la información talla a la edad. En el modelo 2 (M2) hubo consideración del ambiente ecológico. En el modelo 3 (M3) y modelo 4 (M4) se hizo consideración de la escala espacial a nivel de zona y procedencia, respectivamente. La complejidad de cada uno de los modelos estuvo ligada al número de parámetros en estimación. Cada modelo fue implementado en AD Model Builder (ADMB v 6.0.2, Otter Research Ltd), el cual permite la estimación simultanea de los parámetros de varios modelos. Un test de razón de verosimilitud (TRV) fue empleado para evaluar las diferencias entre cada modelo. La comparación de cada modelo se hizo con respecto a M1, el modelo más sencillo. El desempeño del ajuste de cada modelo fue evaluado en términos del test de razón de verosimilitudes, dado que los modelos estaban anidados. 60 Para la comparación individual entre cada componente se siguió el enfoque metodológico propuesto por Wang y Milton (2000), es decir las curvas de crecimiento se compararon por medio de las distancias promedios (estadístico D) entre la talla media a la edad de cada modelo, integrando el rango de edades entre 2 y 10 años. Este procedimiento fue implementado también en ADMB y se utilizó el módulo MCMC para obtener una aproximación de la distribución posterior del estadístico de comparación (D). El grado de significancia fue evaluado en función de la distribución posterior y el valor de referencia cero. Resultados Crecimiento En este estudio el crecimiento fue representado por la relación talla a la edad para cada uno de los sitios de muestreos (procedencias) (Figura 4). Se determinó la edad a un total de 3008 erizos, donde un alto porcentaje de erizos analizados estuvo entre los 5 y 7 años (Figura 5). La relación talla a la edad en todas las islas mostró un patrón lineal de crecimiento, el cual es invariante a lo largo de su historia de vida (Figura 4). Este patrón también es observado si los datos de cada uno de las islas son agregados (Figure 6). Desafortunadamente no todos los grupos de edad quedaron igualmente representados en todas las localidades (e.g. Isla Llanos, Figura 4). De acuerdo a la Figura 7 hay un claro nivel de variabilidad en la talla a la edad que es dependiente de la isla muestreada. 61 Análisis espacial Los parámetros estimados de cada uno de los modelos (de acuerdo a la jerarquía establecida) son presentados en la Tabla 1. Las observaciones de talla-edad para cada caso son presentadas en las Figuras 4, 6, 8 y 9. La Tabla 1 muestra que las variaciones en el parámetro de posición (alfa) de cada uno de los modelos, sugieren que el efecto de las variaciones en las tasas de crecimiento se reflejaría más en los estados juveniles de los erizos. Estas variaciones son más notables en M3 y M4. El test de razón de verosimilitudes (TRV) confirmó lo anterior, teniendo M3 y M4 los valores más altos de TRV respecto de M1 (modelo base, Tabla 2). Sin embargo, en la comparación pareada entre cada uno de los modelos, M4 mostró una clara superioridad de acuerdo a sus valores de TRV obtenidos, siendo altamente significativos al compararlos con M1 (p < 0.05). Esto implica que las variaciones existentes en el crecimiento tiene un mayor efecto a la escala de procedencias (escala intermedia). Por el contrario, la escala a nivel de ambiente ecológico a pesar de ser significativa, fue la que menos explicó las diferencias en el crecimiento (Tabla 2). La distribución del parámetro beta [β (tomado como un proxy de la tasa de crecimiento)] versus la latitud (Figura 10) no mostró correlación alguna, indicando la ausencia de un patrón latitudinal en el crecimiento de Loxechinus albus. El análisis comparativo basado en el estadístico D, tanto a nivel de zona como procedencia (Tabla 3 y 4), reveló diferentes resultados. A nivel de zonas en general se observó que las más expuestas y de influencia oceánica (7 y 8), que se encuentran más al sur, tienen tallas promedio a la edad mayores en comparación a las otras zonas. Este patrón se mantiene a nivel de la comparación individual entre cada una de las procedencias, con la excepción de Cailín y Llanos, que presentaron mayor talla promedio a la edad respecto de la mayoría de las procedencias. De igual forma se presentaron distintos resultados en función de las 62 procedencias comparadas (Tabla 4). Sin embargo se observó que en general las tallas promedio fueron mayores en las procedencias de influencia oceánica (D <0.01). Discusión Crecimiento El crecimiento como tema de estudio en diversas especies de erizo ha sido abordado a través de diferentes metodologías (e.g. marcaje-recaptura, lectura de placas). En la última década el enfoque preferido ha sido el uso de la técnica de marcaje y recaptura (e.g. Lamare y Mladenov 2000; Morgan et al. 2000; Rogers-Bennett et al. 2003; Ebert and Southon 2003; Wing et al 2003; Grupe 2006; Pederson y Johnson 2008). Sin embargo, el método más antiguo para evaluar el crecimiento en equinoideos ha sido a través del conteo de las zonas de crecimiento que se forman en su esqueleto [e.g. placas de la testa (Pearse and Pearse, 1975)]. En el erizo L. albus, Gebauer (1992) y Gebauer y Moreno (1995) comprobaron experimentalmente la utilidad de las placas genitales como estructura confiable para generar información de edad y con ella realizar estimación de parámetros poblacionales. La relación talla a la edad (datos de entrada para estimar los parámetros de crecimiento en los modelos) que se observó en cada una de las zonas de estudio, reveló un consistente patrón lineal, ratificando lo reportado recientemente por Flores et al (en revisión) y Barahona et al 2003. Este patrón es totalmente diferente a lo reportado para esta especie por Gebauer (1992), Gebauer y Moreno (1995) y Duran et al. (1999), así como también para otras especies de erizo. Flores et al (en revisión) discuten algunos de los factores que pueden estar condicionando el patrón de crecimiento en el erizo L. albus y que deberían ser considerados 63 también para otras especies de erizo dada las diferencias que se han encontrado en la selección de un modelo para una misma especie [e.g. Strongylocentrotus franciscanus (Ebert y Russell, 1993; Shelton et al., 2006)]. Sin embargo, la existencia de un lento crecimiento para el erizo, concuerda con lo reportado en previos trabajos sobre el crecimiento de la especie L. albus (Stotz et al. 1992; Gebauer 1992; Gebauer y Moreno 1995; Duran et al. 1999; Barahona et al. 2003). En general los erizos son de crecimiento lento y muy longevos (e.g. ver Tabla 1 en Ebert y Southon 2003). Escalas espaciales y variaciones en el crecimiento Diferentes escalas espaciales han sido consideradas para el análisis de la variabilidad en el crecimiento de varias especies de erizos y en el presente estudio se tomaron en cuenta algunas de ellas. Estas pueden ser visualizadas ya sea en un plano horizontal (e.g. latitud longitud) como en un plano vertical (e.g. profundidad). Sin embargo, las variaciones espaciales en el crecimiento podrían estar o no presentes. Para el caso del erizo L. albus son prácticamente inexistentes los estudios donde se haya profundizado sobre este tema, exceptuando a Barahona et al (2003) y Molinet et al (2009), donde reportan resultados preliminares sobre la presencia de variaciones en el crecimiento para esta especie. Una de las escalas que ha sido analizada en algunas especies, pero en menor frecuencia es la macroescala y específicamente a lo largo de gradientes latitudinales. El rango en que actúa esta escala es entre los cientos y miles de kilómetros. Duineveld y Jenness (1984) y Russell (1987) reportan variaciones a través de un gradiente latitudinal para Echinocardium cordatum y Strongylocentrotus purpuratus, respectivamente. Mientras que, Ebert et al. (1999) y Linse et al (2006) no lo reportan para Strongylocentrotus franciscanus y Sterechinus neumayeri. Por 64 otro lado, Lamare y Mladenov (2000) sugieren una considerable variación geográfica en Evechinus chloroticus, pero dichas diferencias no respondían a un efecto de escala latitudinal propiamente como tal. Para L. albus, la falta de una asociación significativa en la relación entre la tasa de crecimiento (parámetro beta) y la latitud esta en concordancia con lo planteado por Ebert et al. (1999). Por lo tanto, las diferencias en el crecimiento para L. albus pueden ser significativas tanto en cortas como a largas distancias. Dentro del área comprendida en el presente estudio, es decir entre la X y XI región en el sur de Chile, no se identificaron efectos de patrones latitudinales. Las escalas que principalmente se han tomado en cuenta en los estudios de variabilidad en el crecimiento de erizos han sido la meso (escala intermedia) y microescala (pequeña escala). El rango en que actúan estas escalas es entre 1 a 100 Km. y 1 m a 1 Km., respectivamente. Estas escalas a su vez responden a una jerarquía de orden ecológico [ver Orensanz y Jamieson (1998)]. En las especies S. franciscanus (Morgan et al, 2000; Shelton et al, 2006), Paracentrotus lividus (Turon et al, 1995), E. chloroticus (Andrew y Choat, 1985) se han encontrado diferencias a escalas intermedias; pero en otras como Heliocidaris erythrograma (Pederson y Johnson, 2008) dichas diferencias no han sido significativas. En estas mismas especies se han reportado también variaciones a pequeña escala. Ebert y Russell (1992) las reportan para S. franciscanus y Brady y Scheibling (2006) para Strongylocentrotus droebachiensis. Sin embargo, Rogers-Bennett et al (2003) no reporta variaciones para S. franciscanus, mientras que Russell (2000) para S. droebachiensis. Quizás lo contradictorio de los resultados obtenidos por ambos grupos de investigadores pueda ser explicado por el gradiente batimétrico al cual se ejecutaron los análisis. Esto enfatiza la importancia de identificar la escala a la cual se pueden generar gradientes batimétricos dentro 65 de una misma área. Otra especie en la que se observaron variaciones en el crecimiento a escalas menores es E. chloroticus (Wing et al, 2003). Sin embargo, las diferencias entre micro-hábitats reportadas recientemente por Grupe (2006) en el crecimiento de Strongylocentrotus purpuratus, representa la escala más fina a la cual se ha evaluado el crecimiento de una especie de erizo (décimas de centímetros). Este último trabajo pone en evidencia el significativo rol ecológico que cumple la escala a nivel de organismo en la dinámica poblacional de los erizos (Grupe 2006), particularmente en aquellas especies que tiene un comportamiento parcial o completamente sésil como el erizo S. purpuratus. Los recientes resultados de Barahona et al (2003) y Molinet et al (2009) con relación al crecimiento de L. albus, indicarían que las variaciones ocurren a escalas intermedias. En este estudio dos de los modelos contruidos (M3 y M4) explicaron estas variaciones, pero en distinta magnitud geográfica. Las variaciones a nivel de procedencia (M4) fueron apoyadas en mayor magnitud por los resultados del test de razón de verosimilitud. Esto estaría acorde con la jerarquía propuesta por Orensanz y Jamieson (1998); ocurriendo variaciones más a nivel de bancos de pesca o sitios a la cual las especies de erizo responden [e.g Strongylocentrotus franciscanus (Ebert y Russell 1992, Ebert et al. 1999, Morgan et al. 2000; Shelton et al. 2006), Paracentrotus lividus (Turon et al 1995), Strongylocentrotus purpuratus (Grupe 2006)]. Las variaciones encontradas en el crecimiento de L. albus podrían deberse a cambios en el hábitat del erizo, ya sean estos de orden biótico o abiótico. El análisis comparativo entre cada procedencia apoya esta conclusión, al observarse valores promedios de talla a la edad superiores en ciertas procedencias en comparación con otras, especialmente aquellas con 66 mayor influencia oceánica. Esto sugiere que en futuros estudios, un modelo que considere la interacción entre el ambiente ecológico, la escala a la cual se evalúe el crecimiento (zona o procedencia) y otras covariables, puede ser útil para explicar las variaciones que se presenten en el crecimiento del erizo en el sur de Chile. De manera particular la disponibilidad y cantidad del alimento ha sido reportado como el factor que tiene el mayor impacto sobre el crecimiento de la gran parte de las especies de erizo (Ebert 1968, Andrew y Choat 1985, Rowley 1990, Edwards y Ebert 1991, Morris y Campbell 1996, McShane y Anderson 1997, Minor y Scheibling 1997, Beddingfield y McClintock 1998, Meidel y Scheibling 1997, Lyons y Scheibling 2007, Maciá y Robinson 2008) y de igual forma para L. albus (González et al. 1993). Enfoques de análisis aplicados Las variaciones reportadas en algunas especies han sido evaluadas mediante diversas aproximaciones. Enfoques como el uso del parámetro ω propuesto por Gallucci and Quinn (1979) aplicado por Duineveld y Jenness (1984), modelos log-lineales (Ebert et al. 1999) y razón de verosimilitud (Russell 1987), son algunos de las metodologías de análisis abordados a escalas mayores. Mientras que ANOVA (Turon et al. 1995; Brady y Scheibling 2006) o ANCOVA (Rogers-Bennett et al. 2003; Grupe 2006), así como análisis de suma de cuadrados residuales (Pederson y Johnson 2008) y comparación de modelos vía AIC (Morgan et al. 2000) fueron aplicados a micro y meso escala. Desafortunadamente, una de las problemáticas que se presenta es el hecho de que los anteriores trabajos no sean tan comparables como consecuencia de los distintos métodos empleados para estudiar el crecimiento (e.g. datos de incrementos en talla o talla a la edad). 67 Una de las ventajas que justamente presenta el erizo L. albus, es su patrón lineal de crecimiento. Esto permite el uso de distintas aproximaciones lineales para abordar su estudio. En este trabajo se construyeron modelos de distinta complejidad, tomando en cuenta dos niveles de escalas espaciales intermedias (zona y procedencia) y dos ambientes ecológicos. Sin embargo, la construcción de un enfoque más elegante como uno basado en modelos mixtos lineales quizás nos permita cuantificar propiamente el nivel de variabilidad que aporta covariables especificas en las variaciones del crecimiento en L. albus. Implicaciones en la pesquería La identificación de la escala intermedia como principal agente de variabilidad en el crecimiento del erizo L. albus y quizás de otros procesos biológicos, es una evidencia que sirve como punto de partida para los esquemas de manejo espacialmente explícitos que actualmente se están considerando en esta pesquería. Sin embargo, aún queda por esclarecer la escala a la cual el proceso de pesca actúa en conjunto con los procesos biológicos. Esto representa un complejo desafío, donde lo ideal es que se alcance lo sugerido por Prince (2005), es decir poder adecuar las escalas de monitoreo, evaluación y manejo con la escala a la cual actúan los stocks. La definición de estos aspectos relacionados con la pesquería son relevantes para la estrategia de explotación basada en cuotas de capturas por zonas que se estaría considerando aplicar. Agradecimientos Luis Flores agradece a CONICYT, Dirección de Postgrado (UDEC) y CREO por las becas otorgadas. Agradecemos a Manira Matamala (Consultora Pupelde) y a su staff en Quellón, así 68 como a Victor Acuña y su familia en Melinka por su hospitalidad y su colaboración en el trabajo de campo. LF agradece a Paulina Gebauer por el entrenamiento ofrecido para la lectura de las placas genitales. Finalmente, un especial agradecimiento al Dr. Lobo Orensanz y Victor Ruiz por su activa participación en el crucero científico realizado durante el año 2007 en el Archipiélago de los Chonos, en el bote LM Ayayay. Referencias ADMB v 6.0.2, Otter Research Ltd Andrew N., Agatsuma, Y., Ballesteros, E., Bazhin, A., Creaser, E., Barnes, D., Botsford, L., Bradbury, A., Campbell, A., Dixon, J., Einnarsson, S., Gerring, P., Hebert, K., Hunter, M., Hur, S.B., Johnson, C., Juinio–Meñez, M.A., Kalvass, P., Miller, R., Moreno, C., Palleiro, J., Rivas, D., Robinson, S., S. Schroeter, S., Steneck, R., Vadas, R., Woodby, D., Xiaoqi. Z. (2002) Status and Management of World Sea Urchin Fisheries. In: Gibson, R., Barnes, M., Atkinson R.J.A. (Eds). Oceanog. Mar. Biol. Annual. Rev. 40, 343–425. Andrew, N.L., Choat, J.H. (1985) Habitat related differences in the survivorship and growth of juvenile sea urchin. Mar. Ecol. Prog. Ser. 27, 155-161. Barahona, N., Orensanz, J.M., Parma, A., Jerez, G., Romero, C., Miranda, H., Zuleta, A., Cataste, V., Gálvez, P. (2003) Bases biológicas para rotación de áreas en el recurso erizo. Informe Final. Fondo de Investigación Pesquera, Proyecto FIP No. 2000 – 18, 197 pages, tables, figures, appendices. Instituto de Fomento Pesquero (IFOP), Valparaíso (Chile). 69 Barnes, D.K., Crook, A.C. (2001) Implications of temporal and spatial variability in Paracentrotus lividus population to the associated commercial coastal fishery. Hydrobiologia. 465, 95-102. Beddingfield SD, McClintock JB (1998) Differential survivorship, reproduction, growth and nutrient allocation in the regular echinoid Lytechinus variegatus (Lamarck) fed natural diets. J Exp Mar Biol Ecol 226:195-215 Botsford, L.W., Quinn, J.F., Wing, S.R., Brittnacher, J.G. (1993) Rotating spatial harvest of a benthic invertebrate, the red sea urchin Strongylocentrotus franciscanus. In: Kruse, G., Eggers, D.M., Marasco, R.J., Pautzke, C., Quinn II, T.J. (Eds.), Proceedings of the International Symposium on Management Strategies of Exploited Fish Population, University of Alaska, Fairbanks, Alaska. 408-429. Brady SM, Scheibling RE (2006) Changes in growth and reproduction of green sea urchins, Strongylocentrotus droebachiensis (Muller), during repopulation of the shallow subtidal zone after mass mortality. J Exp Mar Biol Ecol 335: 277–291. Bromaghin JF (1993) Sample size determination for interval estimation of multinomial probabilities. The American Statistician. 47(3): 203–206 Bückle, F., Guisado, C., Serrano, C., Córdova, L., Peña, L., Vásquez, E.W. (1977) Estudio del crecimiento en cautiverio del erizo Loxechinus albus (Molina) en las costas de Valparaíso y Chiloé. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México.4 (1): 141 – 152. 70 Caddy, J.F., Defeo, O. (2003) Enhancing or restoring the productivity of natural population of shellfish and other marine invertebrate resources. FAO Fisheries Technical Paper. No. 448. Rome, FAO.159 pp. Defeo, O. (1993) The effect of spatial scale in population dynamics and modeling of sedentary fisheries: the yellow clam Mesodesma mactroides of an Uruguayan exposed sandy beach. Doctoral Disertación. CINVESTAV-IPN. Unidad Merida (México), 308 pp. Duineveld, G.C.A., Jenness M.I. (1984) Differences in growth rates of the sea urchin Echinocardium cordatum as estimated by the parameter ω of the von Bertalanffy equation applied to skeletal rings. Mar. Ecol. Prog. Ser. 19, 65–72. Duran L, Falcón C, Gálvez M, Godoy C, Melo C, Oliva D. (1999) Elaboración de claves talla-edad para el recurso erizo. Proyecto FIP No. 1997-30, 197 pages, tables, figures, appendices. Instituto de Fomento Pesquero (IFOP), Valparaíso (Chile) Ebert TA. (1968) Growth rates of the sea urchin Strongylocentrotus purpuratus related to food availability and spine abrasion. Ecology 49:1075-1091 Ebert, T.A. (1983) Recruitment in echinoderms. In: Jangoux, M., Lawrence, A.A. (Eds), Echinoderm studies, Balkema Publishers, Netherlands, 169-203. 71 Ebert, T.A., Russell, M.P. (1992) Growth and mortality estimates for red sea urchin, Strongylocentrotus franciscanus, from San Nicolas Island, California. Mar. Ecol. Prog. Ser. 81, 31–41. Ebert TA, Russell MP, (1993) Growth and mortality of subtidal red sea urchin (Strongylocentrotus franciscanus) at San Nicolas Island, California, USA: problems with models. Mar Biol 117: 79-89 Ebert, T.A., Dixon, J.D., Schroeter, S.C., Kalvass, P.E., Richmond, N.T., Bradbury, W.A., Woodby, D.A., (1999) Growth and mortality of red sea urchins (Strongylocentrotus franciscanus) across a latitudinal gradient. Mar. Ecol. Prog. Ser. 190, 189–209. Ebert TA, Southon JR (2003) Red sea urchin (Strongylocentrotus franciscanus) can live over 100 years: confirmation with A-bomb 14carbon. Fishery Bulletin, 101(4): 915-922. Edwards PB, Ebert TA (1991) Plastic responses to limited food availability and spine damage in the sea urchin Strongylocentrotus purpuratus (Stimpson). J Exp Mar Biol Ecol 145:205220 Elner, R.W., Vadas, R.L. (1990) Inference in ecology: the sea urchin phenomenon in the Northwestern Atlantic. Am. Nat. 136, 108-125. Ernst, B., Orensanz, J.M., Armstrong, D.A. (2005) Spatial dynamics of female snow crab (Chionoecetes opilio) in the eastern Bering Sea. Can. J. Fish. Aquat. Sci. Vol. 62: 250 – 268. Fiori, S.M., Morsán, E.M. (2003) Age and individual growth of Mesodesma mactroides (Bivalvia) in the southernmost range of its distribution. ICES J. Mar. Sci. 61, 1253-1259. 72 Flores, L., Ernst, B., Parma, AM. (en revisión). Growth pattern of the sea urchin, Loxechinus albus (Molina, 1782) in southern Chile: evaluation of growth models. Gallucci VF, Quinn TJ II (1979) Reparameterizing, fitting and testing a simple growth model. Trans Am Fish Soc 108: 14-25 Gebauer, P. (1992) Validación experimental de los anillos de crecimiento de Loxechinus albus (Molina, 1782) (Echinodermata: Echinoidea) en la reserve marina de Mehuin. Chile. Tesis, Esc. Biología Marina, Univ. Austral de Chile. 66 pp. Gebauer, P., Moreno, C.A. (1995) Experimental validation of the growth rings of Loxechinus albus (Molina, 1782) in southern Chile (Echinodermata: Echinoidea). Fish. Res. 21, 423–435. González, M.L., Pérez, M.C., López, D.A., Pino, C.A. (1993) Effects of algal diet on the energy available for growth of juvenile sea urchin Loxechinus albus (Molina, 1782). Aquaculture. 115, 87 - 95 Grupe, B.M. (2006) Purple sea urchin (Strongylocentrotus purpuratus) in and out of pits: the effects of microhabitat on population structure, morphology, growth and mortality. MSc. Thesis. University of Oregon. 278 pp. Gutiérrez, J., Otsu, I. (1975) Periodicidad en las variaciones biométricas de Loxechinus albus (Molina). Rev. Biol. Mar. 15, 179–199. 73 Hilborn, R., Walter, C.J. (1992) Quantitative fisheries stock assessment: Choice, Dynamics, and Uncertainty. Chapman & Hall, London. Lamare MD, Mladenov PH (2000) Modelling somatic growth in the sea urchin Evechinus chloroticus (Echinoidea: Echinometridae). J. Exp. Mar. Biol. Ecol. 243, 17-43 Linse, K., Barnes, D., Enderlein, P. (2006) Body size and growth of benthic invertebrates along an Antarctic latitudinal gradient. Deep-Sea Res II. 53, 921-931. Lyons DA, Scheibling RE (2007) Differences in somatic and gonadic growth of the sea urchin (Strongylocentrotus droebachiensis) fed kelp (Laminaria longicruris) or the invasive alga Codium fragile ssp. tomentosoides are related to energy acquisition Macia S, Robinson MP. (1999) Habitat-dependent growth in a Caribbean sea urchin Tripneustes ventricosus: the importance of food type. Helgol Mar Res 62: 303-308 McShane PE, Anderson OF. (1997) Resource allocation and growth rates in the sea urchin Evechinus chloroticus (Echinoidea: Echinometridae). Mar Biol 128:657-663 Meidel SK, Scheibling RE. (1997) Effects of food type and ratio non reproductive maturation and growth of the sea urchin Strongylocentrotus droebachiensis. 134: 155-166 Minor MA, Scheibling RE (1997) Effects of food ration and feeding regime on growth and reproduction of the sea urchin Strongylocentrotus droebachiensis. Mar Biol 129:159-167 74 Morris TJ, Campbell A. (1996) Growth of juvenile red sea urchins (Strongylocentrotus franciscanus) fed Zostera marina or Nereocystis luetkeana. J Shellfish Res 15:777-780 Morgan LE, Botsford LW, Wing SR, Smith BD. (2000) Spatial variability in growth and mortality of the red sea urchin Strongylocentrotus franciscanus, in northern California. Can J Fish Aquat Sci 57: 980-992 Molinet et al (2009). Bases biologicas para la rotacion de areas del recurso erizo, Fase II. Informe final. Proyecto FIP N.- 2003 – 13. Orensanz, J.M., Jamieson, J. (1998) The assessment and management of spatially structured stocks. Can. Spec. Publ. Fish. Aquat. Sci. 92, 195-227. Orensanz, J.M., Parma, A.M., Jerez, G., Barahona, N., Montecinos, M., Elias, I. (2005) What are the key elements for the sustainability of “S-Fisheries”? Insights from South America. Bull. Mar. Sci. 76, 527–556. Pearse, J.S., Pearse, V.B. (1975) Growth zones in the echinoid skeleton. Am. Zoo. 15, 731753. Pederson, H.G., Johnson, C.R. (2008) Growth and age structure of sea urchins (Heliocidaris erythrogramma) in complex barrens and native macroalgal beds in eastern Tasmania. ICES J. Mar. Sci. 65, 1-11. 75 Prince, J. (2005) Combating the tyranny of scale for haliotids: micro-management for microstocks. Bull. Mar. Sci. 76, 557–577. Quinn, J.F., Wing, S.R., Botsford, L.W. (1993) Harvest refugia in marine invertebrate fisheries: models and applications to red sea urchin Strongylocentrotus franciscanus. Am. Zoo. 33, 537-550 Roa, R., Tapia. F. (1998) Spatial differences in growth and sexual maturity between branches of a large population of the squat lobster Pleurocondes monodon. Mar. Ecol. Prog. Ser. 167, 185-196. Rowley, R.J. (1990) Newly settled sea urchin in a kelp bed and urchin barren ground: a comparison of growth and mortality. Mar. Ecol. Prog. Ser. 62, 229-240. Rogers-Bennett L, Rogers DW, Bennett WA, Ebert TA (2003) Modeling red sea urchin (Strongylocentrotus franciscanus) growth using six growth functions. Fish Bull 101(3): 614626 Russell, M.P. (1987) Life history traits and resource allocation in the purple sea urchin Strongylocentrotus purpuratus (Stimpson). J. Exp. Mar. Biol. Ecol. 108:199-216. Russell, M.P. (2000) Spatial and temporal variation in growth of the green sea urchin, Strongylocentrotus droebachiensis, in the Gulf of Maine, USA. In: Echinoderm 2000 – Proceedings of the 10th International Echinoderm Conference. Pp. 533-538. Ed. M. Baker, A.A. Balkema. 76 Shelton AO, Woodby, DA, Hebert K, Witman JD (2006) Evaluating Age Determination and Spatial Patterns of Growth in Red Sea Urchins in Southeast Alaska. Trans Am Fish Soc 135:1670-1680 Stotz, W., González, S., López, C. (1992) Siembra experimental del erizo rojo Loxechinus albus (Molina) en la costa expuesta del centro – norte: efectos del erizo negro Tetrapygas Níger (Molina) sobre la permanencia y crecimiento de juveniles. Inv. Pesq. (Chile) 37, 107- 117 Turon, X., Giribet, G., López, S., Palacín, C. (1995) Growth and population structure of Paracentrotus lividus (Echinodermata: Echinoidea) in two contrasting habitats. Mar. Ecol. Prog. Ser. 122, 193-204. Vásquez, J.A. (2001) Ecology of Loxechinus albus. In: Lawrence, J.M. (Ed.), Edible Sea Urchins: Biology and Ecology. Elsevier Science Publ., pages 161 – 175. Wang, Y., Milton, D.A. (2000) On comparison of growth curves: How do we test whether growth rates differ? Fish. Bull. 98, 874-880. Williams, H. (2002) Sea Urchin Fisheries of the World: A Review of their status, management strategies and biology of the principal species. Wing, S.R., Gibbs, M.T., Lamare, M.D. (2003) Reproductive sources and sinks within a sea urchin, Evechinus chloroticus, population of a New Zealand fjord. Mar. Ecol. Prog. Ser. 248, 109-123. 77 Tabla 1.- Estimadores de máxima verosimilitud de los parámetros de crecimiento para cada uno de los modelos implementados para evaluar las escalas de variación espacial en la zona sur de Chile [M1: modelo que no considera jerarquías; M2: modelo donde sólo considera los ambientes ecológicos (1) de influencia oceánica y (2) de influencia de canales y fiordos; M3: modelo que considera cada zona y M4: modelo que considera cada una de las procedencias]. Modelo Jerarquía α Parámetros SD β SD M1 24.82 5.5511 0.2766 M2 M3 M4 Varianza Ambiente 1 2 Zona 1 2 3 4 5 6 7 8 Procedencia 1 2 3 4 5 6 7 8 9 10 11 12 13 9.6830 0.0424 24.69 5.4829 0.3359 6.2171 0.5018 9.7286 0.0498 9.5064 0.0818 24.21 7.4871 10.0170 4.6503 5.5944 8.3751 5.6711 4.9651 15.8040 0.9711 2.0167 1.0846 0.5680 1.2992 1.0334 0.4374 0.4374 9.3040 9.0189 9.7960 9.5943 9.1584 9.5913 9.8577 8.3794 0.2043 0.2860 0.1537 0.0961 0.2123 0.1596 0.0630 0.2542 23.66 7.4871 10.0170 4.6503 5.6054 6.4431 8.3751 14.6580 7.6936 8.6738 2.5791 3.7645 6.3673 15.8040 0.9601 9.3040 0.2020 1.9938 9.0189 0.2828 1.0724 9.7960 0.1519 0.6518 9.5541 0.1179 1.2289 9.5278 0.1847 1.2845 9.1584 0.2099 3.5298 8.6987 0.4776 1.3561 9.0563 0.2380 2.9731 9.1087 0.4123 1.3712 10.0320 0.1836 0.6868 9.9958 0.0996 0.6115 9.7702 0.0900 1.8801 8.3794 0.2513 78 Tabla 2.- Resultados del test de razón de verosimilitud para evaluar la escala de mayor aporte de variabilidad en el crecimiento de Loxechinus albus. Modelo Negativo Logverosimilitud Número de parámetros M1 6334.4 3 χ2 d.f. p M2 6326.7 5 χ2 d.f. p M3 6297.1 17 χ2 d.f. p M4 6262.9 27 M2 M3 M4 15.4 2 < 0.05 74.6 14 < 0.05 143 24 < 0.05 59.2 12 < 0.05 128 22 < 0.05 68.5 10 < 0.05 79 Tabla 3.- Significancia estadística a nivel de zonas del análisis comparativo de la distancia promedio entre tallas media a la edad (edades 2 a 10) en el erizo Loxechinus albus para la costa sur de Chile. Zonas: 1 (Canal de Chacao), 2 (Cailin), 3 (Punta Inio), 4 (Concoto y Amita), 5 (Jechica), 6 (Llanus, May y Tellez), 7 (Ipun, Stokes y Williams) y 8 (Lemu). El singo negativo (-) implica un promedio mayor en la fila, mientras que positivo (+) en la columna. NS equivale a no significativo. Zonas 2 3 4 5 6 7 8 1 -/0.10-0.05 NS NS NS NS -/0.10-0.05 -/<0.01 2 3 4 5 6 7 NS +/0.05-0.01 +/0.10-0.05 +/0.10-0.05 NS -/<0.01 NS NS NS -/0.05-0.01 -/<0.01 NS NS -/<0.01 -/<0.01 NS -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 80 Tabla 4.- Significancia estadística a nivel de procedencias del análisis comparativo de la distancia promedio entre tallas media a la edad (edades 2 a 10) en el erizo Loxechinus albus para la costa sur de Chile. Procedencias: 1 (Canal de Chacao), 2 (Cailin), 3 (Punta Inio), 4 (Amita), 5 (Concoto), 6 (Jechica), 7 (Llanus), 8 (Tellez), 9 (May), 10 (Ipun), 11(Stokes), 12 (Williams) y 13 (Lemu). El singo negativo (-) implica un promedio mayor en la fila, mientras que positivo (+) en la columna. NS equivale a no significativo. Procedencias 2 3 4 5 6 7 8 9 10 11 12 13 1 2 3 4 5 6 7 8 9 10 11 12 -/0.10-0.05 NS NS NS +/0.05-0.01 NS NS NS NS +/0.05-0.01 NS +/0.05-0.01 NS NS NS -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 +/0.05-0.01 +/<0.01 +/<0.01 +/0.05-0.01 +/<0.01 +/<0.01 +/<0.01 NS NS NS NS NS NS +/<0.01 -/0.05-0.01 NS +/0.05-0.01 NS NS +/0.05-0.01 NS +/<0.01 -/0.10-0.05 NS NS NS -/<0.01 NS NS +/<0.01 -/<0.01 NS NS -/0.05-0.01 -/<0.01 -/0.05-0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 +/0.05-0.01 -/<0.01 -/0.05-0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/<0.01 NS -/<0.01 -/<0.01 -/<0.01 -/<0.01 -/0.05-0.01 81 Figura 1.- Sitios que representan las zonas establecidas para los muestreos en el sur de Chile. 82 Figura 2.- Procedencias agrupadas por ambientes ecológicos [influencia oceánica (1, 3, 7 al 13) e influencia de canales y fiordos (2, 4 al 6)]. 83 Figura 3.- Distribución espacial de las procedencias muestreadas en la X y XI región del sur de Chile. 84 Figura 4.- Datos talla a la edad observada y modelo lineal ajustado para cada una de las procedencias. 85 Figura 5.- Estructura de edad observada de Loxechinus albus entra la X y XI región en la zona sur de Chile durante este estudio. 86 Figura 6.- Datos talla a la edad y modelo lineal ajustado de Loxechinus albus entre la X y XI región en la zona sur de Chile. 87 Figura 7.- Variabilidad en la talla a la edad (2 – 10) de Loxechinus albus entre la X y XI región en la zona sur de Chile. 88 Figura 8.- Datos talla a la edad observada y modelo lineal ajustado para cada una de las zonas de análisis. 89 Figura 9.- Datos talla a la edad observada y modelo lineal ajustado para cada una de los ambientes ecológicos de análisis (1) de influencia oceánica y (2) de influencia de canales y fiordos. 90 Figura 10.- Relación entre el parámetro beta y la latitud para el erizo Loxechinus albus en la zona sur de Chile. 91 CAPÍTULO 4 Discusión general Los resultados de esta tesis contribuyen a incrementar el conocimiento sobre la biología del erizo en la zona sur de Chile (X y XI región) y aporta información relevante para desarrollar metodologías espacialmente explicitas consideradas actualmente en el manejo. En el Capitulo 1 se hace una revisión sobre el estado del arte del crecimiento somático en erizos a nivel mundial y lo abordado hasta el momento para el erizo L. albus en Chile. A nivel mundial se observa el uso de varias metodologías para estimar el crecimiento somático de los erizos, destacando la lectura de anillos y marcaje y recaptura. Resalta además la ausencia de un único modelo de crecimiento para este grupo. Respecto del erizo L. albus se aprecia una incertidumbre del patrón de crecimiento y ausencia de información sobre la variabilidad espacial en las tasas de crecimiento en la zona sur de Chile. De esta forma en el presente trabajo se abordaron ambas problemáticas para L. albus. El patrón de crecimiento del erizo es estudiado en el Capitulo 2, donde se evaluó la hipótesis de un crecimiento no asintótico para el erizo L. albus. Para esto se usaron datos talla a la edad proveniente de tres procedencias distintas del Archipiélago de los Chonos y aplicando metodologías estadísticas basadas en la selección de modelos, se eligió el mejor candidato. Los resultados de dicha evaluación mostraron que esta especie se caracteriza por tener un patrón de crecimiento no asintótico, contrario a lo reportado para esta misma especie por Gebauer (1992), Gebauer y Moreno (1995) y Duran et al. (1999). En particular se reporta un patrón de crecimiento lineal, el cual fue identificado preliminarmente por Barahona et al. 92 (2003) y Molinet et al (2009). Este patrón es diferente al reportado para la mayoría de las especies de erizo alrededor del mundo (Crapp y Willis 1975; Nichols et al. 1985; Gage y Tyler 1985; Gage et al. 1986; Gage 1987; Gage 1992; Brady y Scheibling 2006; Shelton et al. 2006; Blicher et al. 2007), que comúnmente es asintótico o sigmoideo. En el Capitulo 3 se evaluó el efecto de las escalas espaciales (macro y meso) siguiendo un enfoque lineal de análisis en el crecimiento. La información talla a la edad provino de 13 procedencias localidades en dos regiones del sur de Chile. La elección de los sitios de muestreo consideró áreas influenciadas por dos ambientes ecológicos (influencia oceánica y canales y fiordos). Se encontró que la escala intermedia (mesoescala) es la que mejor explica las variaciones en el crecimiento de esta especie, siendo relevante lo que ocurre a nivel de procedencias. Esta respuesta es común en otras especies de erizos [e.g. Strongylocentrotus franciscanus (Ebert y Russell 1992, Ebert et al. 1999, Morgan et al. 2000; Shelton et al. 2006), Paracentrotus lividus (Turon et al 1995), Strongylocentrotus purpuratus (Grupe 2006)]. Efectos a macroescala (patrones latitudinales) no fueron observados en este estudio y concuerda con lo reportado por Ebert et al. (1999) para el caso S. franciscanus. Por lo tanto, esto sugiere que esta escala no es tan relevante en las variaciones que se dan para las especies de erizos. Más bien, estas variaciones responden a cambios que se dan a nivel local y que la mayoría de las veces están relacionadas con la disponibilidad y cantidad de alimento para los erizos. Estos resultados, un patrón de crecimiento lineal y un efecto de mesoescala como principal factor de variabilidad, representan un aporte importante para diseñar futuros modelos de manejo espacialmente explícitos. Por lo tanto, esto implicaría una disminución en la complejidad de la dinámica de crecimiento y por ende de los modelos poblacionales que sean 93 implementados para la evaluación de las estrategias de explotación y un aumento del realismo, dada la necesidad de implementar escalas espaciales en la modelación. 94 Literatura citada Agatsuma, Y., y A. Nakatao. (2004) Age determination, reproduction and growth of the sea urchin Hemicentrotus pulcherrimus in Oshoro Bay, Hokkaido, Japan. J. Mar. Biol. Ass. U.K. 84: 401 – 405. Allison, G. W., J. Lubchenco and M.H. Carr. (1998) Marine reserves are necessary but no sufficient for marine conservation. Ecol. Appl. 8: 579 – 592. Akaike, H. (1973) Information theory and an extension of the maximum likelihood principle. Pages 267 – 281 in (B.N. Petran and F. Csaaki, eds.) International Symposium on Information Theory, 2nd ed., Acadeemiai Kiadi, Budapest, Hungary. Andrew N., Y. Agatsuma, E. Ballesteros, A. Bazhin, E. Creaser, D. Barnes, L. Botsford, A. Bradbury, A. Campbell, J. Dixon, S. Einnarsson, P. Gerring, K. Hebert, M. Hunter, S.B. Hur, C. Johnson, M.A. Juinio –Meñez, P. Kalvass, R. Miller, C. Moreno, J. Palleiro, D. Rivas, S. Robinson, S. Schroeter, R. Steneck, R. Vadas, D. Woodby y Z. Xiaoqi. (2002) Status and Management of World Sea Urchin Fisheries. In: Gibson R, Barnes M and Atkinson R.J.A (Eds). Oceanog & Mar. Biol. Annual. Rev. 40:343 – 425 Aranda, E. y R. Gili. (1978a) Evaluación de recursos pesqueros XI Región. Zona “D” y “E”.Informe final. IFOP – CORFO XI Región. Abril, 1978. 44 p. Aranda, E. y R. Gili. (1978b) Prospección Almejas, Locos y Erizos. X Región. Informe final. IFOP – Intendencia X Región. 44 p. 95 Aranda, E., S. Lillo y R. Gimpel. (1979) Evaluación de los recursos pesqueros en la XI Región. Zona “H” e “I”. Informe final. IFOP – SERPLAC XI Región. Diciembre, 1979. 60 p. Aranda, E. y R. Gimpel. (1980) Situación y perspectiva de los recursos pesqueros de la XI Región. Zona “A” a la “I”. Informe final. IFOP – SERPLAC XI Región. Mayo, 1980. 62 p. Arias, E., N. Barahona, E. Lozada y G.Jerez. (1995) Monitoreo de la Pesquería del recurso erizo en la X y XI regiones, 1994. Informe final. 74 pp + Anexo. Tablas y Figuras. Arrau, L. (1958) Desarrollo de1 erizo comestible de Chile Loxechinus albus Mol. Rev. Biol. Mar., 7(2): 39-61. Bay – Schmith, E., C. Werlinger y J. Silva (1981) Ciclo anual de reproducción del recurso Loxechinus albus entre la X y XI región. Proyecto de Investigación. Subpesca. Informe final. Universidad de Concepción (Chile), 68 pages. Barahona, N. y G. Jerez. (1997) La pesquería del erizo (Loxechinus albus) en las regiones X a XII de Chile: 13 años de historia (1987 – 1997). XII Congreso de Ciencias del Mar (Chile), 14 pages Barahona, N., J.M. Orensanz, A. Parma, G.Jerez, C. Romero, H. Miranda, A. Zuleta, V. Cataste y P. Galvez. (2003) Bases biológicas para rotación de áreas en el recurso erizo. Informe Final. Fondo de Investigación Pesquera, Proyecto FIP No. 2000 – 18, 197 pages, tables, figures, appendices. Insitutto de Fomento Pesquero (IFOP), Valparaíso (Chile). 96 Beddingfield, S.D. y J.B. McClintock. (1998) Differential survivorship, growth and nutrient allocation in the regular echinoid Lytechinus variegates (Lamarck) fed natural diets. J. Exp. Mar. Biol. Ecol. 226: 195 – 215. Birkeland, C., y F.S. Chia. (1971) Recruitment risk, growth, age and predation in two populations of sand dollars, Dendraster excentricus (Eschscholtz). J. Exp Mar. Biol. Ecol. 6: 265 – 278. Booth, A.J. (2000) Incorporating the spatial component of fisheries data into stock assessment models. ICES Journal of Marine Science, 57: 858 – 865. Botsford, L.W., B.D. Smith y J.F. Quinn. (1994) Bimodality in size distribution: The red sea urchin Strongylocentrotus franciscanus as an example. Ecol. Appl. 4: 42 – 50. Bromaghin, J.F. (1993) Sample size determination for interval estimation of multinomial probablities. The American Statistician. 47(3): 203 – 206. Buckland, S.T., D.R. Anderson, K.P. Burnham y J.L. Laake. (1993) Distance sampling: estimating abundance of biological population. Chapman y Hall, London. Buckland, S.T., K.P. Burnham y N.H. Augustin. (1997) Model selection: An integral part of the inference: Biometrics: 53: 603 – 618. 97 Buckle, F., C. Guisado, C. Serrano, L. Córdova, L. Peña y E. W Vásquez. (1977) Estudio del crecimiento en cautiverio del erizo Loxechinus albus (Molina) en las costas de Valparaíso y Chiloé. Anales del Centro de Ciencias del Mar y Limnología, Universidad Nacional Autónoma de México.4 (1): 141 – 152. Burnham, K.P. y D.R. Anderson. (2002) Model selection and multimodel inference: a practical information – theoretic approach. 2nd Ed., Springer-Verlag, New York, NY Bustamante, R. y Castilla J.C. (1987). The shellfisheries in Chile: an analysis 0f 26 years of landings. Biol. Pesq. (Chile) 16, 79 – 97 Carr, M.H. y D.C. Reed. (1993) Conceptual issues relevant to marine harvest refuges: examples from temperate reef fishes. Can. J. Fish. Aquatic. Sci. 50: 2019 – 2028 Castilla, J.C. y O. Defeo (2001) Latin American benthic shellfisheries: emphasis on comanagement and experimental practices. Reviews in Fish Biology and Fisheries 11: 1 – 30. Caddy, J.F. (1975) Spatial model for an exploited shellfish population, and its application to the Georges Bank scallop fishery. J. Fish. Res. Bd. Can. 32, 1305 – 1328. Caddy, J.F. y O. Defeo (2003) Enhancing or restoring the productivity of natural population of shellfish and other marine invertebrate resources. FAO Fisheries Technical Paper. No. 448. Rome, FAO.159 pp. 98 Chen, Y., D.A. Jackson y H.H. Harvey (1992) A comparison for von Bertalanffy and polynomial functions in modeling fish growth data. Can. J. Fish. Aquat. Sci. 49: 1228 – 1235. Comely, C.A., y A.D. Ansell. (1988) Population density and growth of Echinus esculentus L. on the Scottish west coast. Estuar. Costl. Shelf Sci. 29: 311 – 334. Conan, G.Y. (1984) Do assumptions commonly used for modeling population of finfish apply to shellfish species? ICES, Shellfish Committee, C.M. 1984/K. 49: 21 pp. Crapp, G.B. y M.E. Willis. (1975) Age determination in the sea urchin Paracentrotus lividus (Lamarck), with notes on the reproductive cycle. J. Exp Mar. Biol. Ecol. 20: 157 – 178. Defeo, O. (1993) The effect of spatial scale in population dynamics and modeling of sedentary fisheries: the yellow clam Mesodesma mactroides of an Uruguayan exposed sandy beach. Doctoral Disertación. CINVESTAV-IPN. Unidad Merida (Mexico), 308 pp. Ebert, T.A. (1968) Growth rates of the sea urchin Strongylocentrotus purpuratus related to food availability and spine abrasion. Ecol. 49: 1075 – 1091. Ebert, T.A. (1988) Calibration of natural growth lines in ossicles of the two sea urchins Strongylocentrotus purpuratus and Echnometra mathaei, using tetracycline. In: Burke, R.D., Mladenov, P.D., Lambert, P., Parsley, R.L. (eds.) Echinoderm biology. Balkema, Rotterdam, p. 435 – 443. 99 Ebert, T.A. y M.P. Russell. (1993) Growth and mortality of subtidal red sea urchin (Strongylocentrotus franciscanus) at San Nicolas Island, California, USA: problems with models. Mar. Biol. 117: 79 – 89. Ebert, T.A., J.D. Dixon, S.C. Schroeter, S.C. Kalvas, P.E. Richmond, N.T. Bradbury, W.A y D.A. Woodby. (1999) Growth and mortality of red sea urchin Strongylocentrotus franciscanus across a latitudinal gradient. Mar. Ecol. Prog. Ser. 190: 189 – 209. Ebert, T.A. y J.R. Southon (2003) Red sea urchin (Strongylocentrotus franciscanus) can live over 100 years: confirmation with A-bomb 14carbon. Fish. Bull. 101(4): 915 – 922. Ernst, B., J.M. Orensanz y D.A. Armstrong. (2005) Spatial dynamics of female snow crab (Chionoecetes opilio) in the eastern Bering Sea. Can. J. Fish. Aquat. Sci. Vol. 62: 250 - 268 Fiori, S.M. y E.M. Morsán (2003) Age and individual growth of Mesodesma mactroides (Bivalvia) in the southernmost range of its distribution. ICES Journal of Marine Science. 61: 1253 – 1259. Francis, R. I. C. C. (1996) Do herring grow faster than orange roughy? Fish. Bull. 94:783–786. Fuji, A. (1967) Ecological studies on the growth and food consumption of Japanese common littoral sea urchin, Strongylocentrotus intermedius (A. Agassiz). Mem. Fac. Fish. Hokkaido Univ. 15 (2): 83 – 160. 100 Gage, J.D., P.A. Tyler y D. Nichols (1986) Reproduction and growth of Echinus acutus var. norvegicus Duber & Koren and E. elegans Duber & Koren on the continental slope off Scotland. J. Exp Mar. Biol. Ecol. 101: 61 – 83. Gage, J.D.(1992) Natural growth bands and growth variability in the sea urchin Echinus esculentus: results from tetracycline tagging. Mar. Biol. 114: 607 – 616. Gálvez, M. (1996) Evaluación indirecta del stock de erizo comestible (Loxechinus albus) al sur del estrecho de Magallanes (Chile), durante la temporada 1995. Estad. Doc., Univ. Católica Valparaíso, 23/96:254 – 286. Gebauer, P. (1992) Validación experimental de los anillos de crecimiento de Loxechinus albus (Molina, 1782) (Echinodermata: Echinoidea) en la reserve marina de Mehuin. Chile. Tesis, Esc. Biología Marina, Univ. Austral de Chile. 66 pp Gebauer, P. y C.A. Moreno (1995) Experimental validation of the growth rings of Loxechinus albus (Molina, 1782) in southern Chile (Echinodermata: Echinoidea). Fisheries Research. 21: 423 – 435 Guillou, M. y C. Michel. (1994) The influence of environmental factor son the growth of Sphaerechinus granularis (Lamarck) (Echinodermata: Echinoidea). J. Exp Mar. Biol. Ecol. 178: 97 – 111. 101 González, H.E., J.C. Castilla y C. Guisado. (1987) Effect of larval diet and rearing temperature on metamorphosis and juvenile survival of the sea urchin Loxechinus albus (Molina, 1872) (Echinodermata: Echinoidea). Journal of Shellfish Research. 6: 109 – 115. González, M.L., M.C. Pérez, D.A. López y C.A. Pino. (1993) Effects of algal diet on the energy available for growth of juvenile sea urchin Loxechinus albus (Molina, 1782). Aquaculture. 115: 87 - 95 Guisado, C. y J.C. Castilla. (1987) Historia de vida, reproducción y avances en el cultivo del erizo comestible chileno Loxechinus albus (Molina, 1782) (Echinoidea: Echinidae). In: Manejo y Desarrollo Pesquero”. P. Arana (Ed). Esc. Ciencias del Mar, UCV, Valparaiso, 59 – 68. Gutiérrez, J. y I. Otsu. (1975) Periodicidad en las variaciones biométricas de Loxechinus albus (Molina). Rev. Biol. Marina, Valparaíso, 15 (2): 179 – 199 Grabowski, R., R. Russell, Y. Chen y M. Hunter. (2000) Estimating the Maine green sea urchin stock biomass using a spatial statistics approach. Report submitted to the Maine Department of Marine Resources and Maine Sea Urchin Zone Council. pp. 45. Grosjean, Ph. (2001) Growth model of reared sea urchin Paracentrotus lividus (Lamarck, 1816). Ph.D. thesis, Universite Libre de Bruxelles, Bélgica. 102 Hammer H., S. Watts, A. Lawrence, J Lawrence y R. Desmond (2005) The effect of dietary protein on consumption, survival, growth and production of the sea urchin Lytechinus variegatus. Aquaculture. 00: 00 – 00. Hancok, D.A. (1973) The relationship between stock and recruitment in exploited invertebrates. Rapp. P.- v. Reun. Cons. Int. Explor. Mer. 164. 113 – 131 Hancok, D.A. (1979) Population dynamics and management of shellfish stock. Rapp. P.- v. Reun. Cons. Int. Explor. Mer. 175. 8 – 19. Hilborn, R. (1986) A comparison of alternatives harvest tactics for invertebrates fisheries. In North Pacific Workshop on Stock Assessment and Management of Invertebrate. Edited by G.S. Jamieson and N. Bourne. Can. Spec. Publ. Fish. Aquat. Sci. 92: 313 – 317. Inostroza, F., H. Robotham, R. Salas y I. Serey. (1983) Cartas de distribución de los recursos bento – demersales de las aguas interiores de la X, XI y XII Región. Zona “I”, “II”, “III” y “IV”. Informe final. IFOP – CORFO. Agosto. 1983. AP/83 – 40. 54 Cartas + Fotografías. Jerez, G. (1991) La pesquería del erizo (Loxechinus albus) en la X región. Diagnostico y evaluación de stock. Resumenes. IV Congreso Latinoamericano de Ciencias del Mar. 3 Sept – 4 Oct, 1991. Universidad Católica del Norto Sede Coquimbo. Conquimbo. P 83. Kawamura, K. (1974) Fishery biological studies on a sea urchin, Strongylocentrotus intemedius (A. Agassiz). Scient. Rep. Hokkaido Fish. Exp. Stn. 16: 1 – 54. 103 Lamare, M.D. y P.H. Mladenov. (2000) Modelling somatic growth in the sea urchin Evechinus chloroticus (Echinoidea: Echinometridae). J. Exp Mar. Biol. Ecol. 243: 17 – 43. Larraín A. (1975) Los equinoideos regulares fósiles y recientes de Chile. Gayana, Zool., 35: 1 – 189. Lowe, E.F. y J.M. Lawrence. (1976) Absorption efficiencies of Lytechinus variegatus (Lamarck) (Echinodermata: Echinoidea) for selected marine plants. J. Exp Mar. Biol. Ecol. 21: 61 – 83. Meidel, S.K y R.E. Scheibling. (1998) Size and age structure of the sea urchin Strongylocentrotus droebachiensis in different habitats. In Echinoderms (R. Mooi, M. Telford, eds.), p 737 – 742. Proceedings of the 9th International echinoderm conference; San Francisco, 5 – 9 August 1996. A.A. Balkema, Rotterdam, Netherlands. Miller, R.J., y K.H. Mann. (1973) Ecological energetics of the seaweed zone in a marine bay on the Atlantic coast of Canada. III. Energy transformations by sea urchin. Mar. Biol. 18: 99 – 114. Moore, H.B. (1935) A comparison of the biology of Echinus esculentus in different habitats. Part II. J. Mar. Biol. Ass. U.K. 20: 119 – 128. Moreno, C.A., N. Barahona, C. Molinet, J.M. Orensanz, A. Parma y A. Zuleta. (2008). From crisis to institucional sustainability in the Chilean Sea Urchin Fishery. Chapter 3. IN: T.R. 104 McClanahan and J.C. Castila (eds). Fisheries Management: Progress towards sustainability. Blackwell Publ. Morgan, L.E., Botsford, L.W., Wing S.R y Smith B.D. (2000) Spatial variability in growth and mortality of the red sea urchin Strongylocentrotus franciscanus, in northern California. Can. J. Fish. Aquat. Sci. 57: 980 – 992. Nichols, D., Sime, A.A.T. y Bishop, G.M. (1985) Growth in populations of the sea urchin Echinus esculentus L. (Echinodermata: Echinoidea) from the English Channel and firth of Clyde. J. Exp Mar. Biol. Ecol. 86: 219 – 228. Norambuena, R., L. González y L. Hirenacks. (1976) Evaluación de la población de erizos en el sur de la Isla de Chiloé (Lat. 42°50´5 y Lat 43°29´5). División de Prospección Pesquera IFOP. 50 p. Orensanz, J.M. (1986) Size, environment, and density: regulation of a scallop stock and its management implications. Can. Spec. Publ. Fish. Aquat. Sci. 92, 195 – 227 Orensanz, J.M., A. Parma y O. Iribarne. (1991) Population dynamics and management of natural stock. In S.E. Shumway, ed. Scallops: Biology, Ecology and Aquaculture. Developments in Aquaculture and Fisheries Science. 21: 625 – 713. Orensanz, J.M. y J. Jamieson. (1998) The assessment and management of spatially structured stocks. Can. Spec. Publ. Fish. Aquat. Sci. 92, 195 – 227 105 Orensanz, J.M., J. Armstrong, D. A. Armstron y R. Hilborn. (1998) Crustacean resources are vulnerable to serial depletion – The multifaceted decline of shrimp and crab fisheries in the greater Gulf of Alaska. Reviews in Fish Biology and Fisheries 8: 117 – 176. Orensanz, J.M., A. Parma, T. Turk y J. Valero. (2003) Dynamics, assessment and management of natural stock. In S.E. Shumway, ed. Scallops: Biology, Ecology and Aquculture. 2nd Edition. Amsterdan: in press. (Developments in Aquaculture and Fisheries Science. 21: 625 – 713.) Raymond B.G. y R.E. Scheibling (1987) Recruitment and growth of the sea urchin Strongylocentrotus droebachiensis (Muller) following mass mortalities off Nova Scotia, Canada. J. Exp Mar. Biol. Ecol. 108: 31 – 54. Roa, R. y F. Tapia. (1998) Spatial differences in growth and sexual maturity between branches of a large population of the squat lobster Pleurocondes monodon. Mar. Ecol. Prog. Ser. 167: 185 - 196 Rogers – Bennett, L., D.W. Rogers, W.A. Bennett y T.A. Ebert. (2003) Modeling red sea urchin (Strongylocentrotus franciscanus) growth using six growth functions. Fish. Bull. 101: 614 - 626 Russell, M.P. (1987) Life history traits and resource allocation in the purple sea urchin Strongylocentrotus purpuratus (Stimpson). J. Exp Mar. Biol. Ecol. 108: 199 – 216. 106 Russell, M.P. (1998) Resource allocation plasticity in the purple sea urchin: rapid diet induced, phenotypic changes in the green sea urchin, Strongylocentrotus droebachiensis (Muller). J. Exp Mar. Biol. Ecol. 220:1 – 14. Schipman, R. (1995) Bases biopesqueras para la administración del recurso erizo (Loxechinus albus, Molina 1782) en la XI Región, Chile. Tesis de Grado de Licenciado en Biologia Marina. Escuela de Biología Marina. Facultad de Ciencias. Universidad Austral de Chile. Valdivia, Chile. 38 p. Sime, A.A.T. (1982) Growth ring analysis in regular echinoids. Prog. Underwat. Sci. 7: 7 – 14. Sime, A.A.T. y Cranmer G.J. (1985) Age and growth of North Sea echinoids. J. Mar. Biol. Ass. U.K. 65: 583 – 588. Soualili, D.L., M. Guillou y R. Semroud. (1999) Age and Growth of the echinoid Sphaerechinus granularis from the Algerian coast. J. Mar. Biol. Ass. U.K. 79: 1139 – 1140. Stotz, W., S. González y C. López. (1992) Siembra experimental del erizo rojo Loxechinus albus (Molina) en la costa expuesta del centro – norte: efectos del erizo negro Tetrapygas Níger (Molina) sobre la permanencia y crecimiento de juveniles. Investigación Pesquera (Chile) 37: 107 - 117 Tanaka, M. (1982) A new growth curve with expresses infinite incresase. Publ. Amakusa Mar. Biol. Lab. 6: 167 – 177. 107 Vadas, R.L. (1977) Preferential feeding: an optimization strategy in sea urchin. Ecol. Monogr. 47: 337 - 371 Vadas, R. L., B. Beal, S. Dudgeon y W. Wright. (1997) Reproductive biology of green sea urchins along the coast of Maine: final report, 59 p. Maine Cooperative Extension Service and Maine Sea Grant Program, Orono, ME. Vadas, R.L., B. Smith, B. Beal y T. Dowling. (2002) Sympatric growth morphs and size bimodality in the green sea urchin (Strongylocentrotus droebachiensis). Ecol. Monogr. 72: 113 - 132 Vásquez, J.A. (2001) Ecology of Loxechinus albus. In J.M. Lawrence, ed., “Edible Sea Urchins: Biology and Ecology”. Elsevier Science Publ., pages 161 – 175. Venzon, D.J. y S.H. Moolgavkar. (1988) A method for computing profile likelihood – based confidence intervals. Applied Statistics. 37: 87 – 94. Von Bertalanffy, L (1938) A quantitative theory of organic growth (inquiries of growth law II). Hum. Biol. 10(2): 181 – 213. Von Bertalanffy, L. (1957) Quantitative law in metabolism and growth. Quart. Rev. Biol. 32(3): 217 – 231. Wang, Y. – G. y D.A. Milton. (2000) On comparison of growth curves: How do we test whether growth rates differ? Fish. Bull. 98: 874 - 880. 108 White, M., Keegan, B.F. y Leahy, Y. (1984) Growth retardation in the regular echinoid Echinus esculentus Linnaeus. In: B.F. Keegan, B.D.S.O’Connor (eds.) Proceedings of the Fifth International Echinoderm Conference, Galway 24 – 29 September 1984. Balkema, Rotterdam, p. 369 – 375. Williams H. (2002) Sea Urchin Fisheries of the World: A Review of their status, management strategies and biology of the principal species. Zuleta, A., C. Moreno y P. Rubilar. (1994) Evaluación de stocks y monitoreo pesquería erizo 1990. Informe final. Subpesca – Universidad Austral. 39 pp + Anexos. 109