PROTEÍNAS G
Anuncio

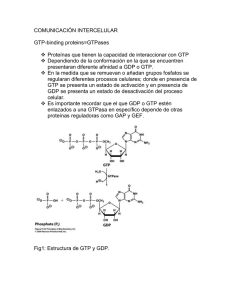
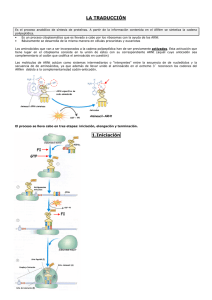
TRANSDUCCIÓN DE SEÑALES EN EUCARIOTAS TRANSDUCCIÓN DE LA SEÑAL INTRACELULAR PROTEÍNAS G Esta diapositiva la pusimos para introducir el tipo de modificaciones que se realizan en las moléculas que van a transducir la señal de forma intracelular. Además, teníamos dos formas de transducir la señal: por fosforilación y por unión de las proteínas G a nucleótidos de guanina. MOLÉCULAS DE LAS VÍAS DE TRANSDUCCIÓN INTRACELULARES DE SEÑALES: - proteína G - adaptadores - enzimas: → proteínas kinasas y fosfatasas → lipasas → ciclasas (adenilato ciclasa, guanilato ciclasa) - sistemas efectores - 2os mensajeros PROTEÍNAS G - 20 kD Proteínas G pequeñas Ej.: proteína Ras - 90 kD Proteínas G grandes Son heterotriméricas GTP-hidrolasas con función reguladora Núcleo central común – origen común Poseen un sitio de reconocimiento de nucleótidos de guanina Forman complejos estables con GTP y con GDP Unión e hidrólisis de GTP cambios conformacionales recíprocos en la(s) región(es) “switch” del dominio catalítico Poseen proteínas reguladoras Las proteínas G forman un grupo extenso de proteínas y se conoce bastante bien su estructura. Podemos dividirlas en dos grupos, fundamentalmente por su tamaño, tal y como se indica en la diapositiva, y tienen características diferentes. El hecho de que las proteínas G grandes sean heterotrimétricas, significa que están formadas por tres subunidades diferentes entre sí y que cada una tiene sus funciones características. En conjunto, todas las proteínas G, tienen las siguientes funciones/características: - Tienen capacidad hidrolasa del GTP. Son GTP-hidrolasas con función reguladora, es decir, que cuando tienen unido GTP van a ser capaces de hidrolizarlo y se desprende un grupo fosfato del GTP quedando en forma de GDP. - Todas ellas tienen un núcleo central común, lo cual indica que todas ellas proceden de una sola proteína que a lo largo de la evolución ha ido cambiando en su estructura. Parece ser que la proteína G pequeña Ras podría ser el origen del resto de las proteínas G por medio de la evolución. - Todas poseen un sitio de reconocimiento de los nucleótidos de guanina, tanto las proteínas G pequeñas como las grandes. - Van a formar complejos estables con GTP y con GDP. Estables pero no permanentes. - Pueden unir e hidrolizar GTP, lo cual da lugar a una serie de cambios conformacionales en estas proteínas y esos cambios conformacionales son recíprocos y se producen en unas determinadas regiones de la molécula que se denominan “switch” o cambio, que es lo que les va a permitir estar activas o inactivas, y que se encuentran en el dominio catalítico. - Poseen unas proteínas reguladoras, sobre todo las proteínas G pequeñas. Las proteínas G se denominan así porque son capaces de unir nucleótidos de guanina. Ahora, vamos a ir viendo características de las proteínas G pequeñas y de las proteínas G grandes. Ambos grupos de proteínas están implicados en la transducción de la señal, y veremos que las proteínas G grandes están al principio de las vías de transducción intracelulares, relacionadas con los receptores, mientras que las proteínas G pequeñas pueden aparecer más tarde en estas vías. En esta tabla aparecen los diferentes grupos de proteínas con los nombres de algunas de ellas y sus funciones. Estas proteínas, además de funcionar en la transducción de la señal como pone en la tabla, dependiendo del tipo de organismo, no siempre están funcionando en la transducción de la señal. Por ejemplo, pueden funcionar en las levaduras por ejemplo en algo que tiene que ver con la reproducción y con el trasiego de los nutrientes, no siempre están funcionando en la transducción de la señal. Pero estas proteínas han ido evolucionando a lo largo de los años pues también han tomado una serie de funciones diferentes. Incluso algunas actúan como factores de elongación. Proteínas G pequeñas (Pm ≈ 20 kD) - Relacionadas con Ras estructuralmente - En secuencia de aminoácidos - En modificaciones con lípidos - Ras: c-Ras y v-Ras (sarcoma de rata) de 21 kD - Forma dímeros y trímeros idénticos - Extremo carboxílico poliprenilado y palmitoilado - Extremo amino miristoilado - Función: - En levaduras activa adenilato ciclasa - En mamíferos activación de Raf-quinasa Importante regulador de la proliferación celular y componente esencial cascadas iniciadas por RTKs - Las proteínas G pequeñas, cuyo peso molecular está alrededor de los 20 kD, todas ellas están relacionadas con Ras desde el punto de vista estructural, tanto en su secuencia de aminoácidos como en las modificaciones con lípidos. - La proteína Ras se encuentra en dos modalidades: la c-Ras, que se encuentra en las células normales de mamíferos, y la v-Ras, que se encuentra en los virus. Estas dos moléculas son equivalentes pero que se encuentran bien en virus (v-Ras) o bien en las células eucariotas (c-Ras). La v-Ras es capaz de producir el sarcoma de rata, tiene 21 kD, y como ésta fue la primera que se descubrió, es por lo que se le puso ese nombre. - Se puede encontrar en forma de dímero y de trímero idénticos (misma proteína), no sólo como monómero. - En el extremo carboxilo tiene una modificación por restos alifáticos, pues tiene un grupo poliprenilado y palmitoilado. - En el extremo amino se encuentra un resto de ácido mirístico. - Función: en levaduras activa la adenilato ciclasa y en mamíferos activa la Rafquinasa que actúa como importante regulador de la proliferación celular porque esta proteína quinasa va a empezar una vía de transducción de señal que permita la división celular, y por tanto es un componente esencial en las cascadas iniciadas por los receptores tirosinquinasa. Por ejemplo, la insulina actúa sobre receptores tirosinquinasa, y los factores de crecimiento epidérmico también están relacionados con la división celular. Proteínas Ras - Conexión con receptores de membrana RTKs activados por GFs - Anclada a la membrana – interacciona con adaptadores (conectores) - Actividad de RAS regulada por: GEFs (guanine nucleotide Exchange factors) GAPs (GTPase – activating proteins) GNRPs (guanine nucleotide release proteins) - Principal controlador de la cascada de la MAP-kinasa (mitogen-activated protein kinase): activa a Raf-kinasa - Es muy versátil: puede interaccionar con muchos adaptadores - Estas proteínas Ras tienen conexión con los receptores tirosinquinasa que están activados por factores de crecimiento. - Están ancladas a la membrana, lo cual es interesante porque esta proteína queda anclada a la membrana por medio de su extremo carboxílico palmitoilado, y esto le permite estar anclada a la membrana situada en el lugar en el que después tendrá que actuar. - Su actividad está regulada por unas proteínas reguladoras (GEFs, GAPs, GNRPs). Estas proteínas reguladoras van a ser más importantes en las proteínas G pequeñas que en las proteínas G grandes. GEFs (factores de intercambio de nucleótidos de guanina). Estimulan a la proteína Ras para separar GDP y unir GTP. GAPs (proteínas activadoras de la actividad GTPasa). Van a estimular esa actividad GTPasa y por tanto pasarán de tener un GTP unido a un GDP. GNRPs (proteínas que liberan nucleótidos de guanina). Estimulan la separación de GDP para que pueda unir al GTP. - Una de sus funciones más importantes es activar la vía de las MAP-kinasas (mitogen-activated protein kinase): activa a Raf-kinasa. - Es muy versátil: puede interaccionar con muchos adaptadores. Esta es una propiedad muy importante en la proteína Ras porque va a ser como el punto de unión de diferentes cadenas de transducción intracelular en la misma célula, o la vamos a encontrar relacionada con diferentes vías de transducción intracelular en diferentes células, ya que puede unirse a muchos adaptadores pudiendo participar en vías de transducción distintas. En esta tabla aparecen subfamilias de la proteína Ras con otras que se parecen mucho a la proteína Ras. Estas proteínas reguladoras actúan en un ciclo de la siguiente manera. Por un lado tenemos una proteína inactiva que tiene unido GDP y va a pasar a una situación activa en la que tiene unido GTP. En el estado inactivo está dibujada como un cuadrado y en el estado activo con los bordes redondeados para indicar un cambio de conformación. Esta proteína, de estar en situación inactiva a estar en situación activa, se reestructura su molécula. El GDI es un regulador que actúa como un inhibidor de la proteína en cuestión y la mantiene en forma inactiva. Pero cuando se le une el GEF, que sería un factor de intercambio de nucleótidos de guanina, se le va a separar el GDP y en su lugar se le va a unir el GTP, de manera que así pasa a estar activa con GTP unido. A continuación, la proteína pasa a estar de nuevo en estado inactivo por medio de una proteína con actividad GTPasa, que hidroliza al GTP con separación de un grupo fosfato. La diferencia está en que no se intercambian cada vez GDP y GTP, sino que el GTP está unido a la misma proteína y el que sale es el GDP (lo ha dicho tal cual). Este ciclo lo tiene que estar realizando continuamente: cuando está en la posición activa, con GTP, transducirá la señal, y cuando está inactiva no va a transducir ninguna señal. Este esquema empieza con la forma activa que tiene GTP unido. Se produce la hidrólisis de GTP con separación de un grupo fosfato, da lugar a GDP y pasa a la situación inactiva. Después se mantiene en situación inactiva mientras que se puede separar o quedar unido el GDP (realmente suceden las dos cosas). Finalmente, se separa el GDP, entra GTP rápidamente y vuelve a estar activa. Modificaciones con lípidos de las proteínas G pequeñas - Ácido mirístico - Ácido palmítico - Grupo farnesilo - Geranilgeranilo En esta imagen estaríamos viendo la estructura básica de la proteína Ras. Vemos que tiene un extremo N-terminal y un extremo C-terminal y entre medias hay una serie de láminas plegadas βy alguna hélice α también. Es interesante la hélice α que denominan “switch” porque es donde radica el cambio de conformación de la proteína pues es la que va a cambiar de posición cuando tiene unido GDP o cuando se le une GTP. Estamos viendo la estructura de la proteína cuando está activa pues tiene unido GTP. En conjunto tiene una estructura globulosa. Vamos a ver unos esquemas donde se puede observar cómo cambia la estructura. Situación: Ras unido a GDP. Vemos la molécula de GDP y en azul y en verde las partes de la molécula Ras que van a modificarse. Situación: Ras unido a GTP. Las zonas de Switch de la molécula están modificadas en su posición porque tienen unido GTP. Esta sería la posición activa. A su vez se va a unir a una proteína que se denomina SOS (aquí está representada parte de esta proteína). Aquí podemos ver en conjunto cómo sucede el proceso. En este esquema vemos un receptor de factor de crecimiento epidérmico (EGF) ya dimerizado que es un receptor de tipo tirosinquinasa (se indica que parte de la molécula tiene actividad quinasa y que tiene una serie de restos de tirosina fosforilados). En esta situación, el receptor EGF puede transducir la señal y lo hace a través de una serie de moléculas, de las cuales aquí se representan el Grb-2 y el Sos. Estos conectores o adaptadores tienen unas partes de la molécula que van a ser capaces de unirse a otras. El Grb-2 es capaz de unirse a un resto de fosfotirosina por una parte de su molécula, y por otra parte se puede unir a la proteína Sos. Sos es un factor de intercambio de nucleótidos de guanina para Ras, es decir, que tiene la capacidad de inducir a Ras a perder el GDP y a unir GTP. En ese punto (círculo rojo) vemos que Ras con GDP que está inactiva, pasa a Ras con GTP activa. La unión entre estas moléculas es importante, se conoce en qué punto se produce y cómo se activa. Aquí vemos parte de la molécula de Sos y parte de la molécula de Ras y lo que se quiere indicar es: - Los Switch de Ras que se van a modificar (activación/desactivación). - Existe una unión física entre ambas moléculas, de manera que se conocen qué partes de la molécula de Ras interaccionan con qué partes de la molécula de Sos. Proteínas G grandes (Pm ≈ 90 kD) - Tamaño molecular ≈ 90 kD - Se conocen desde 1971 (Rodbell y cols.) - Interaccionan directamente con los receptores de membrana - La unión del ligando activa las proteínas G grandes - Ciclo de activación – desactivación: unen GTP (activa) y GDP (inactiva) - Poseen estructura heterotrimérica: subunidades α, β, γ - Las subunidades tienen diferente estructura y funciones - Interaccionan con diferentes efectores intracelulares - Diferentes cascadas de señalización intracelular - Diferentes respuestas celulares Las proteínas G grandes son proteínas heterotriméricas que se conocen desde los años 70’s y tienen una serie de características que están en la diapositiva. El hecho de que interaccionen directamente con los receptores de membrana es lo que da lugar a los receptores de 7 hélices transmembrana que se acoplan a proteínas G. Existe un ciclo de activación y desactivación exactamente igual que en las proteínas G pequeñas: cuando se le une GTP están activas y cuando se le une GDP están inactivas. Las proteínas G grandes están formadas por tres subunidades distintas, las cuales poseen distinta estructura y distintas funciones, por lo que en este sentido están especializadas. Van a interaccionar con diferentes efectores intracelulares, por lo tanto vamos a ver que a partir de la intervención de estas proteínas G grandes tenemos diferentes cascadas de señalización y por tanto diferentes respuestas celulares. Hay muchos receptores, como los de siete hélices transmembrana, que van a interaccionar con las proteínas G grandes. Tenemos otra vez un ciclo donde podemos ver la proteína G grande (están representadas las tres subunidades) en estado inactivo con GDP unido. También en este caso, se representa con un cuadro la subunidad α inactiva y cuando se activa, cuando tiene unido GTP, se representa con los bordes del cuadro redondeados para indicar el cambio conformacional que se ha producido. Tiene la característica de que cuando se une el ligando a su receptor, se separa GDP y se le une GTP a la subunidad α, y la subunidad α con GTP unido se separa de β y de γ de manera que cada una va a hacer su función por separado. La subunidad α con GTP unido, va a actuar sobre una serie de efectores (adenilatociclasa, fosfolipasa C, fosfolipasa A2, canales iónicos, fosfodiesterasa cGMP). Estos efectores son proteínas con actividad enzimática o bien canales iónicos que van a ser activados por las proteínas G grandes, y como al ser activados van a producir unos segundos mensajeros, por eso se denominan efectores (son un conjunto de proteínas que reciben la acción desde las proteínas G y que son capaces de producir los segundos mensajeros). De igual manera que en las proteínas G pequeñas, la subunidad α va a tener la capacidad