Bol. 2: Convección Atmosférica y Nubes
Anuncio

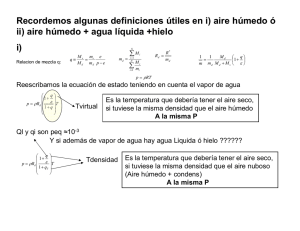
Bol. 2: Convección Atmosférica y Nubes Por equilibrio radiativo no podemos explicar el perfil observado de temperatura en troposfera La troposfera es calentada en gran parte por convección lo que realiza un transporte de calor hacia arriba. CONVECCION Termodinámica • El link entre la circulación y la transferencia de calor latente, sensible y radiación entre la superficie y la atmósfera es termodinámica. • Termodinámica trata las transformaciones internas de la energía de un sistema y el intercambio de energía del mismo con el entorno. TERMODINAMICA CLASICA Estudio macroscópico de los sistemas y sus interacciones bajo condiciones de estados estables (independientes del tiempo). • SISTEMA TERMODINAMICO: región del espacio que contiene materia con ciertas propiedades internas uniformes (P, T, etc). (No existe Grad. de T ni Grad P). • ESTADO DE EQUILIBRIO: es independiente del tiempo y además es estable bajo pequeñas perturbaciones. • Definición “ENTORNO”: todo lo que se encuentra fuera del sistema. • Sistema CERRADO: No hay intercambio de masa con el entorno • Sistema ABIERTO: hay intercambio de masa con el medio • • Si un sistema finito entra en contacto con el entorno (paredes diatérmicas) el sistema + pequeño ajustará sus valores (P, T, V, etc) a nuevos valores, mientras que el entorno NO cambia apreciablemente su estado. PROCESOS Cuasi-ESTATICOS-Reversibles: Secuencia de estados de equilibrio infinitesimal. Si a cada paso infinitesimal se puede revertir la dirección volviendo al estado inicial=reversible. • Procesos Irreversibles: El sistema pasa de 1 estado a otro por un camino que no es secuencia de estados termodinámicos. • Procesos reversibles NO ocurren en la naturaleza, entonces para que estudiarlos?: 1) Los irreversibles son casi imposibles de tratar teóricamente, 2) La experiencia muestra que realizando aproximaciones a procesos cuasi-estáticos (que si ocurren) funciona razonablemente bien. Equilibrio hidrostático P( z ) = ∞ ∫ z ρ gdz Ecuación de Estado del Aire Seco pV = nRT R= constante universal de los gases= 8,314 J/mol ºK R*= R / M* M*=m* / 1000 md= 28.96 g/ mol mv= 18.05 g/mol masas moleculares Definición de Aire Seco: mezcla gaseosa formada unicamente por los gases permanentes del aire, N2, O2 y Ar. Suponemos que el aire seco se comporta como gas ideal pdα d = RdT Rd = constante de los gases para el aire seco= 287 J/ºK kg ECUACIÓN DE ESTADO PARA EL VAPOR DE AGUA eα v = RvT Ecuación de estado para el vapor de agua e = presión de vapor αv = volumen específico del vapor de agua Rv = constante de los gases para el vapor de agua= 461.5 J/kg K Rd / Rv = Mv/Md= ε = 0.622 El peso del aire hùmedo • Masa molecular media del aire seco: gas m % mass of the gas mixture -------------------------------------------N2 28 78% 28x78/100+32x21/100=28.6 O2 32 21% • Masa molecular media del aire hùmedo: gas m % mass of the gas mixture --------------------------------------------Dry air 28.6 90% 28.6x90/100+18x10/100=27.5 H2O 18 10% • Aire hùmedo es màs liviano y menos denso que el aire seco a igual T. • Aire hùmedo se eleva màs ràpido. Evaporacion aumenta la convecciòn en la atmosfera. Primera Ley Termodinámica • El calor es una forma más de energía • En el universo, la energía se transfiere o se transforma de un tipo a otro de energía. dU=dQ-dW dW=pdV , dQ=mcdT dq= dU+pdV Calor Específico • Cv = (dq/dT)v Cp = (dq/dt)p Cp > Cv • Para un gas su calor específico no es constante, ya que su valor depende del trabajo intercambiado entre el sistema y el entorno. Si consideramos un proceso a volumen constante (dW=0): Cv calor específico a volumen constante • Si consideramos un proceso a P=cte, parte de la energía suministrada se utiliza para realizar trabajo y el resto para aumentar la T: Aire Seco: Cp calor específico a presión Cp= 1004.78 J/kg K constante Cv= 717.67 J/kg K RELACION DE MAYER: Cp – Cv = Rd Energía interna • dU = cv dT • • La suma de la energía que poseen todas y cada una de las partículas que lo constituyen. La energía interna de un sistema no se mide sino únicamente sus variaciones. Joule demostró empiricamente (mediados S XIX) que la U de un gas ideal solo depende de la T y de la masa del sistema. La 1ra. Ley de la Termodinámica la podemos escribir como: dq= cv dT + p dV dq = Cp dT - VdP En atmósfera esta forma no es muy Útil ya que V no es una vble que se Pueda medir. Procesos adiabáticos • Proceso Adiabático: El sistema cambia su estado físico, sin intercambiar calor con el medio (dq = 0) Parcela de aire • Se considera una parcela de aire de dimensiones infinitesimales en la que se asume que: • Aislada térmicamente de su entorno, entonces su T cambia adiabaticamente cuando asciende o desciende, encontrándose siempre a igual P que su entorno, el que se encuentra en equilibrio hidrostático. • Se mueve lo suficientemente lento , de tal manera que su energía cinética macroscópica es una fracción despreciable de su energía total. Temperatura Potencial (Ɵ) La temperatura potencial Theta (θ) representa la temperatura que una parcela de aire seco a una presión p y temperatura T tendría si fuera comprimida o expandida adiabáticamente hasta una presión de referencia po, normalmente 1000 hPa. 1000 θ = T p R cp Donde R≈Rd = 287 J/kg ºK, cp≈cpd = 1004 J/kg ºK entonces R/cp = 0.286 La temperatura potencial es una cantidad conservativa para una parcela de aire que Se mueve en una atmósfera bajo condiciones adiabáticas. Dado que los procesos Atmosféricos son casi siempre muy cercanos a los adiabáticos, la Ɵ es un parametro Muy útil in la termodinámica atmosférica.