109 Núcleo atómico de Rutherford, un vistazo a lo invisible
Anuncio

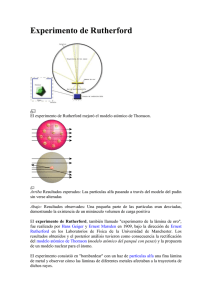
NÚCLEO ATÓMICO DE RUTHERFORD, UN VISTAZO A LO INVISIBLE Centro Universitario México Autor: Javier Eduardo Pascasio Chávez Luis Enrique Torres Fernández Asesor: Jesús Flores Téllez Enrique Zeferino Barrera Vargas INTRODUCCIÓN RESÚMEN El experimento de dispersión del Rutherford consiste en una lámina muy delgada de oro que es bombardeada con partículas alfa. Las observaciones esperadas, era que las partículas alfa que atravesarán la lámina de oro fueran desviadas en diferentes ángulos delante de esta. Pero las observaciones reales mostraron que algunas de las partículas alfa eran rebotadas de regreso por la lámina de oro, lo cual le hizo suponer que las partículas alfa habían chocado con partículas positivas de gran masa. Para simular el experimento de Rutherford se diseño una caja de acrílico que representa la placa de oro y en el interior se colocaron tubos de acrílico o cilindros que simularan núcleos atómicos. Se dejarán caer desde cierta altura y cubriendo la superficie de la caja, un conjunto de balines que representaran a las partículas alfa. Utilizando la probabilidad y estadística determinaremos el área de los tubos, como lo llegó ha realizar Rutherford con el tamaño del núcleo atómico del oro. Esto mostrará como se puede ver aquello que se escapa de nuestros sentidos y aparatos de medición, utilizando las matemáticas que nos permiten ver y medir indirectamente la naturaleza de las cosas. PLANTEAMIENTO DEL PROBLEMA Una novedad en el camino hacia la resolución de nuestras preguntas ha sido la observación de cuerpos invisibles al cuerpo humano. En el principio la humanidad se dedicó a explicar fenómenos resultantes de objetos macro cósmicos, no imaginaban el existir de este mundo invisible, el universo micro cósmico. Ahora sabemos que hay mucho más en el universo, que lo que podemos observar, y esto nos ha abierto las puertas a una nueva forma de explicar el universo, dándonos cuenta, así, que de lo pequeño se hace lo grande y que los fenómenos micro cósmicas dan lugar a las leyes que rigen el universo que observamos. No obstante nos encontramos con una situación muy curiosa, pues debido a que este universo es invisible al ojo humano, no se puede ver directamente, solo puede estudiarse de manera indirecta con mediciones que requieren de un experimento elaborado para conducirlas. Por ello el ingenio humano, que se dedica a intentar estudiar este peculiar universo, debe de ingeniar un experimento que permita el estudio numérico y estadístico de este conjunto de cuerpos. Este experimento, precisamente, tomo el experimento elaborado por Ernest Rutherford en 1909, y lo llevamos a un nivel macroscópico. Consiste en utilizar objetos comunes que son percibidos por el ojo humano, para intentar recrear lo que aconteció en aquel experimento. Pues nosotros creemos que cuerpos de grande o pequeño tamaño con mismas propiedades han de comportarse de la misma forma. De esta forma creamos un lazo entre estos dos universos uno invisible para nosotros y otro en el que nosotros mismo estamos incluidos. Este lazo causa gran controversia pues algunos más experimentos descartan la posibilidad de que los dos tipos de cuerpo se comporten bajo las mismas condiciones y hemos sido testigos de fenómenos inexplicables que tienen su origen en este universo, sin embargo al obtener los mismos resultados que Ruthenford en aquel tiempo, esta vez utilizando esta vez cuerpos de tamaño visible al ojo humano podemos concluir que no podemos descartar ninguna posibilidad y solo queda seguir probando e innovando para pronto resolver nuestras preguntas. ANTECEDENTES En la época de los griegos, la idea del átomo era tan sólo una creación de la razón, un producto de la lógica humana no provisto de evidencia experimental. En esos tiempos no todos creían en la existencia de los átomos. Entre los incrédulos, Aristóteles se cuenta como el más famoso, como famosa fue su propuesta de los cuatro elementos que forman la materia: agua, aire, fuego y tierra. La historia revela a Epicuro (341-270 a. de. n. e.), como gran exponente griego del atomismo. Cuyas enseñanzas fueron muy populares. Aproximadamente en el año 390 de. n. e. prenden fuego a la biblioteca monumental de Alejandría y con ello el atomismo desaparece por cerca de 1000 años. Ahora creemos tener pruebas más que suficientes de su existencia. Los avances tecnológicos jugaron un papel muy importante para escudriñar la naturaleza y estructura del átomo de Dalton, supuestamente indivisible. EXPERIMENTO RUTHERFORD Después de tener éxito con sus trabajos sobre radiactividad, por los cuales recibió el Premio Nobel de Química en 1908, Rutherford reconoció que las partículas alfa podían utilizarse para saber más acerca del átomo. En 1909, con sus alumnos Geiger y Marsden, llevaron a cabo un experimento para poner a prueba el modelo atómico de los Thomson. El experimento de Rutherford utilizó partículas alfa. La fuente de partículas alfa era radio o polonio, colocado dentro de una caja de concreto. Con esto las partículas alfa solamente podrían salir por un pequeño orificio de la caja, en forma de un haz. Alrededor de la placa metálica colocaron una pantalla fluorescente, para detectar las partículas alfa después de que éstas hubieran interactuado con la lámina metálica. Lo que Rutherford esperaba observar, basándose en el modelo atómico de Thomson, era que las partículas alfa, positivamente cargadas, fueran uniformemente repelidas por las cargas positivas uniformemente distribuidas del átomo. Esto implicaba que el haz de partículas alfa pasaría por la lámina metálica con una pequeña desviación. Lo que Rutherford encontró fue que la mayoría de las partículas alfa pasaban a través de la lámina y pegaban en la pantalla fluorescente en el punto en línea recta (O). Algunas partículas alfa se desviaban en pequeños ángulos, marcado por el ejemplo en A, pero ligeramente desviados de la trayectoria rectilínea. El resultado sorprendente fue que algunas pocas partículas alfa se desviaban con grandes ángulos, golpeando la pantalla en puntos. Rutherford, asustado y sorprendido por los resultados, describió su sorpresa con las siguientes palabras: Es tan increíble como si al disparar una granada de 15 pulgadas sobre una hoja de papel higiénico, ésta rebotara y le golpeara a uno mismo. MÉTODO Fórmula de Dispersión de Rutherford 1 NÚCLEO ATÓMICO DE RUTHERFORD, UN VISTAZO A LO INVISIBLE Centro Universitario México Autor: Javier Eduardo Pascasio Chávez Luis Enrique Torres Fernández Asesor: Jesús Flores Téllez Enrique Zeferino Barrera Vargas No existe forma de comprobar la ecuación contra los resultados experimentales, porque es imposible medir directamente el parámetro de impacto. En un experimento real, lo que se mide es el número de partículas dN con ángulos de dispersión entre y + d o dentro de un ángulo sólido d= d S/r2. Entonces se muestra que dS= 2π r2 sen d es el área de la pantalla sobre la que chocan las partículas α. Por lo tanto, el ángulo sólido en el que quedan encerradas estas d/N partículas es d= 2π sen d. Todas las partículas α que se aproximan al núcleo con un parámetro de impacto b serán dispersadas a través de un ángulo . El área alrededor de cada núcleo con un radio igual al parámetro de impacto b es llamada sección transversal integral. Esta área es = πb2 Se muestra una porción agrandada de una hoja de oro con un área superficial a y un espesor t tan delgado (t= 6.0 x 10 -7 m) que las secciones transversales e individuales de los diferentes núcleos no se superponen. Cuando un No de partículas α se dirige perpendicularmente hacia, aquellas que interactúan con núcleos diferentes (todos con la misma sección transversal) experimentarán una dispersión única. Si n es el No de núcleos por unidad de volumen, la hoja de oro contendrá n(At) núcleos, y por lo tanto el área de blanco T presentada por estos núcleos con el fin de tener ángulos de dispersión mayores que y parámetros de impacto menores que b será T= n(At) Ya que A es el área del blanco total, la fracción de partículas α que sufren dispersiones mayores que las dadas por será ƒ= área blanco ofrecida por los núcleos en la hoja área blanco total f = n(At) A ƒ= nt = n πb2t Esta razón también es dada ƒ= N/No, donde N es el número de partículas que experimental la dispersión y No es el número total dirigido contra el blanco. La combinación de las ecuaciones resulta en: ƒ= N = n π tD2 cot2 Esta ecuación aún no es una fórmula práctica que puede ser verificada experimentalmente. Para calcular el número de partículas por ángulo sólido unitario, dΩ = 2π sen Φ dΦ, diferenciamos la ecuación con respecto a Φ y dividimos por dΩ para obtener dƒ = dN = - n πt D2 cot(Φ/2) csc2 (Φ/2) dΦ 8 π senΦ dΦ dΩ No dΩ El signo menso implica que df y dΦ tienen signos opuestos. Tomando sólo el valor absoluto de dƒ/dΩ y, ya que sen Φ = 2 sen (Φ/2) cos (Φ/2), tenemos df = dN dΩ = n D2t No dΩ 16 sen4 Φ/2 Ya que dΩ = dS/r2, podemos escribir dN = dN No dΩ No dS/r2 dN = No nD2t dS 16r2sen4 Φ/2 El cuál es el número de partículas α por unidad de área que golpean la pantalla dentro de un anillo de área dS= 2πr2 senΦ dΦ. La fórmula de dispersión de Rutherford, fue verificada experimentalmente, y por esto debe acreditarse a Rutherford, como el descubridor del núcleo. La verificación experimental de la fórmula de dispersión de Rutherford muestra que si 106 de las partículas incidentes tienen ángulos de dispersión 10o, entonces sólo cerca de 230 son desviadas a través de un ángulo Φ 90o. 2 NÚCLEO ATÓMICO DE RUTHERFORD, UN VISTAZO A LO INVISIBLE Centro Universitario México Autor: Javier Eduardo Pascasio Chávez Luis Enrique Torres Fernández Asesor: Jesús Flores Téllez El número de núcleos por unidad de volumen puede calcularse de: Enrique Zeferino Barrera Vargas n= ρNA M PROCEDIMIENTO Construcción 1. 2. 3. 4. 5. 6. 7. Construimos una caja de acrílico cuyas dimensiones son 71 cm x 51 cm x 19 cm. Se utilizan tubos de 1.5 in de diámetro que se cortaron con una altura de 10 cm. Se dibujo en la base de la caja una red que representa un plano atómico de la red cristalina del oro. En cada punto de intersección de la red se pegó uno de los cilindros. Colocamos un electroimán a cierta altura por encima de la caja para atraer los balines que serán soltados posteriormente sobre la caja para simular el bombardeo de las partículas alfa. Los balines cubrirán un área conocida de un cuadrado de 50 cm por cada lado. Al dejar caer los balines supondremos que los que quedaran dentro del tubo representan a las partículas alfa que fueron rebotadas hacia atrás, las cuales serán contadas para posteriormente determinar el tamaño del diámetro de los tubos a partir de un cálculo de probabilidad y estadística. RESULTADOS Balines Lanzados Balines dentro del tubo El numero de balines 378 34 que se dejaron caer 878 61 sobre la caja se fue 1378 141 incrementando para 2378 160 varios lanzamientos, buscando observar como la proporción de numero de balines que quedan dentro de los tubos y el total de balines lanzados tiende a un valor constante que permitirá determinar el área De cada tubo que representa a los núcleos de oro. Estos resultados se muestran en la tabla 1. Análisis de Resultados: Considerando los resultados de la tabla utilizaremos las siguientes ecuaciones La probabilidad de que un balín pueda caer dentro de un tubo se puede expresar como la fracción del total de balines que entran en los tubos entre el total de balines que se dejan caer y también se puede determinar como la relación de las áreas de los tubos y de la caja: ƒ= N de balines dentro de tubos = área blanco de los tubos en la caja N de balines lanzados área blanco total de la caja Despejando el área de los tubos Balines Lanzados Área de los tubos = f (área total de la caja) DISCUSIÓN: 378 Balines dentro del tubo 34 Área de los tubos(cm2) 325.69 878 61 251.57 1878 141 271.86 El área total de los tubos era 342 cm 2 y 2378 160 243.63 podemos observar que los resultados obtenidos se aproximan demasiado, lo cual confirma que el procedimiento usado por Rutherford fue correctamente. BIBLIOGRAFÍA G. Gamow. El Breviario del Señor Tompkins En el País de las Maravillas la Investigación del Atomo. (1985). México D.F. Fondo de Cultura Económica. p. 107-146 Acosta, Cowan, Graham. Física Moderna. (1980). Michigan, EUA. Harla. p. 121-154 P.G. Hewitt Física Conceptual. (2001). Pearson. Robert March. Física para poetas. (1998). México D.F. Siglo XXI. p. 224-280 Olalla Linares, C. Planck: La Fuerza del Deber. (2006). Madrid, España. Nivola Libros. p. 80-145 3