MODELO DE REPULSIN DE PARES
Anuncio

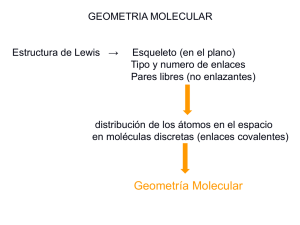
MODELO DE REPULSIÓN DE PARES 1.- ¿Cómo se define la geometría de una molécula y por qué es importante el estudio de la geometría molecular? 2.- ¿Cuál es el postulado básico de la teoría de repulsión de los pares electrónicos de la capa de valencia (T.R.P.E.C.V.)? Explica por qué la magnitud de la repulsión disminuye en el siguiente orden: par libre - par libre > par libre – par enlazante > par enlazante - par enlazante. ¿Cómo afecta este hecho la geometría de la molécula? 3.- ¿Las capas internas contribuyen al enlace químico? Justifica tu respuesta. 4.- Qué geometría molecular esperarías si en la capa de valencia del átomo central se encuentran: a) 3 enlaces y un par libre. b) 4 enlaces y dos pares libres. c) 2 enlaces y dos pares libres. 5.- Con los criterios de T.R.P.E.C.V. indica la geometría molecular para: a) GaI3. b) SbCl5. c) TeCl6. d) H2S. e) NH3. f) CF4. g) NH4+. h) IF5. i) ICl4-. j) SiF4. k) BF4-. l) TeCl4. m) I3-. n) PF6-. o) SO3. p) CHCl3. 6.- Considera las moléculas CS2, ClO2- y S32-. ¿Cuál presenta una geometría lineal y a cuál corresponde una geometría angular? 7.- Utilizando la teoría de repulsión de los pares electrónicos de la capa de valencia, determina la estructura de las moléculas siguientes: a) CH4. b) NH3. c) H2O. Compara los valores de los ángulos de enlace y discute la tendencia observada. 8.- El ángulo de enlace observado para los hidruros PH3, AsH3 y SbH3 tiene un valor de 94°, 92° y 91°, respectivamente. ¿A qué atribuyes que los ángulos de enlace tengan valores diferentes? 9.- Describe la geometría molecular alrededor de cada uno de los tres átomos centrales (marcados con los números 1, 2 y 3) en la molécula H 1 2 3 H―C―C―O―H H O .





![Tema 1_IQ [Modo de compatibilidad]](http://s2.studylib.es/store/data/005480464_1-1517e6a40c959dd0b68f9a26923c5830-300x300.png)