REPASO- ESPECTROFOTOMETRÍA. 1) ¿Cuál es la concentración
Anuncio

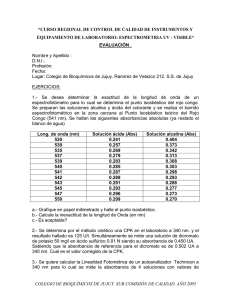
CÁTEDRA: BIOQUÍMICA Carreras: Farmacia Profesorado en Química Licenciatura en Química Licenciatura en Alimentos REPASO- ESPECTROFOTOMETRÍA. 1) ¿Cuál es la concentración de una solución de NADH (coeficiente de absorción molar a 340 nm igual a 6220 M-1 cm-1), 1 mL de la cual tiene una absorbancia de 0,16 en una cubeta de 1 cm de paso óptico? 2) Una solución de NADH tiene una absorbancia a 340 nm de 1,24. ¿Cuántos mL de esta solución se deberán tomar para preparar 10 ml de una solución 1 M? 3) ¿Cuántos µmoles de NADH hay en 10 mL de una solución que tiene una absorbancia de 0,31 a 340 nm? 4) La citosina posee un coeficiente de absorción molar de 6 103 M-1 cm-1 a 270 nm a pH 7. Calcule la absorbancia y el porcentaje de transmitancia de soluciones 10 nM y 1 mM en cubetas de 1 cm y 1 mm. 5) Una solución que se encuentra en una cubeta de 1 cm de espesor contiene 2 g/L de una sustancia que transmite sólo el 75 % de la luz incidente a una determinada longitud de onda. Calcular la absorbancia de una solución que contenga a) 4 g/L b) 1g/L c) 6 g/L y d) 5,4 g/L. Si el peso molecular del compuesto es 250, calcule el coeficiente de absorción molar. 6) El nicotinamida adenín dinucleótido puede hallarse en forma oxidada (NAD+) o reducida (NADH), siendo los coeficientes de absorción para el NAD+ de 18000 M-1 cm-1 (260 nm) y para el NADH de 14500 M-1 cm-1 (260 nm) y de 6220 M-1 cm-1 (340 nm). Se prepara una solución 10 mM de NADH. A la semana, a fin de determinar si el compuesto se ha oxidado, se mide en una cubeta de 1 cm de camino óptico la absorbancia a 340 nm de una dilución 1/100 de la solución. Si esta absorbancia fue de 0,36 determinar cuál es la relación NADH/NAD+. ¿Qué absorbancia daría esa misma solución a 260 nm? (considerar la misma dilución). 7) Calcular las concentraciones de los compuestos A y B en una solución dada si la absorbancia de esta solución en una cubeta de 3 cm de espesor es 0,62 a 450 nm y 0,54 a 485 nm. El compuesto A tiene un coeficiente de absorción molar de 12000 M-1 cm-1 a 450 nm y 4000 M-1 cm-1 a 485 nm. El compuesto B tiene un coeficiente de absorción molar igual a 5000 M-1 cm-1 a 450 nm y 11600 M-1 cm-1 a 485 nm. 8) A 0,3 mL de una muestra de proteína de concentración desconocida se le agregaron 0,7 mL de agua y 4,0 mL de reactivo de Biuret y se esperó hasta desarrollo de color. La absorbancia a 540 nm fue de 0,221 en un tubo de 1 cm de diámetro. A 0,3 mL de una solución standard (5 mg de proteína/mL), se le 1 agregaron 0,7 mL de agua y 4,0 mL de reactivo de Biuret. Esta mezcla dio como resultado una absorbancia de 0,161 en un tubo de iguales características. El blanco de reactivo fue 0,041. a) Calcular la concentración de proteína en la solución desconocida. b) Si empleara 0,5 mL de la misma muestra, ¿qué volumen de agua y de reactivo de Biuret debería agregar? ¿Qué absorbancia obtendría? 9) El ácido pirúvico puede determinarse colorimétricamente por conversión en su 2,4 dinitrofenilhidrazona. Se realizó una curva de calibración con diversas cantidades de ácido pirúvico, obteniéndose los siguientes resultados: Acido pirúvico (g) 20 40 60 80 100 125 150 Lecturas 0,175 0,302 0,435 0,560 0,673 0,795 0,900 Fue analizado un blanco de reactivo por triplicado dando respectivamente: 0,040, 0,050 y 0,045. Se analizaron tres soluciones desconocidas de ácido pirúvico que dieron las siguientes lecturas de absorbancia: a) 0,280; b) 0,555 y c) 0,919. ¿Qué concentración de ácido pirúvico tienen dichas soluciones si el volumen de muestra empleado fue 3 mL? 10) Diseñe un protocolo de laboratorio para realizar una curva de calibración para determinar concentración de proteína empleando la técnica del Biuret descripta en el problema 9 teniendo en cuenta que este método posee un rango de sensibilidad entre 0,05 y 0,5 mg mL-1 RESPUESTAS 1) 0,026 mM 2) 0,05 mL 3) 0,5 moles 4) 0,06 10-3, T 99,99 % 0,006 10-3, T 99,99 % 6, T 0,0001% 0,6, T 25 % 5) a) 0,25 b) 0,0625 c) 0,375 d) 0,3375 15,6 M-1 cm-1 6) 1,375- 1,597 7) A 0,013 mM, B 0,011 mM 8) a) 7,5 mg/mL b) 0,5 mL de H2O, 4 mL de rvo de Biuret, A= 0,341 9) a) 12,2 g/mL b) 26,7 g/mL c) fuera de la curva de calibración; no se cumple ley de Beer 2 MATERIAL SUPLEMENTARIO El espectrofotómetro convencional Un espectrofotómetro convencional enfoca la luz policromática de la fuente en un monocromador. Este tiene como componentes principales una ranura de entrada, un elemento que dispersa la luz en sus longitudes de onda componentes (en general una red de difracción), y una ranura de salida que permite seleccionar la longitud de onda deseada. Esa luz “monocromática” atraviesa la muestra, y llega al detector. Las mediciones fotométricas se hacen en base a la relación entre la potencia de luz que alcanza al detector cuando está interpuesta la muestra (P) y cuando no lo está (P0) o cuando está interpuesto un “blanco”. La transmitancia se define como T = P / P0 y la absorbancia como A = - log T = - log P / P0 La base de la espectrometría de absorción y su uso para el análisis cuantitativo está dada por la relación conocida como ley de Beer: A = a . b. C Donde a es la absortividad, un coeficiente característico de la sustancia absorbente a cada longitud de onda, b es la longitud del camino óptico (distancia que atraviesa la luz dentro de la muestra), y C es la concentración de la sustancia absorbente. En realidad el monocromador no selecciona una única longitud de onda, sino un rango, cuya amplitud depende de la calidad (resolución) del mismo. Esta resolución depende fundamentalmente del diseño (montaje) del monocromador, de su distancia focal y de las dimensiones y densidad de líneas en la red de difracción. Para cambiar la longitud de onda de medición, o para hacer un barrido espectral, se mueve el elemento dispersor o algún espejo por medio de un motor por pasos. 3 Algunos espectros de absorción 4