Tablas y gráficas para las unidades iii y iv
Anuncio
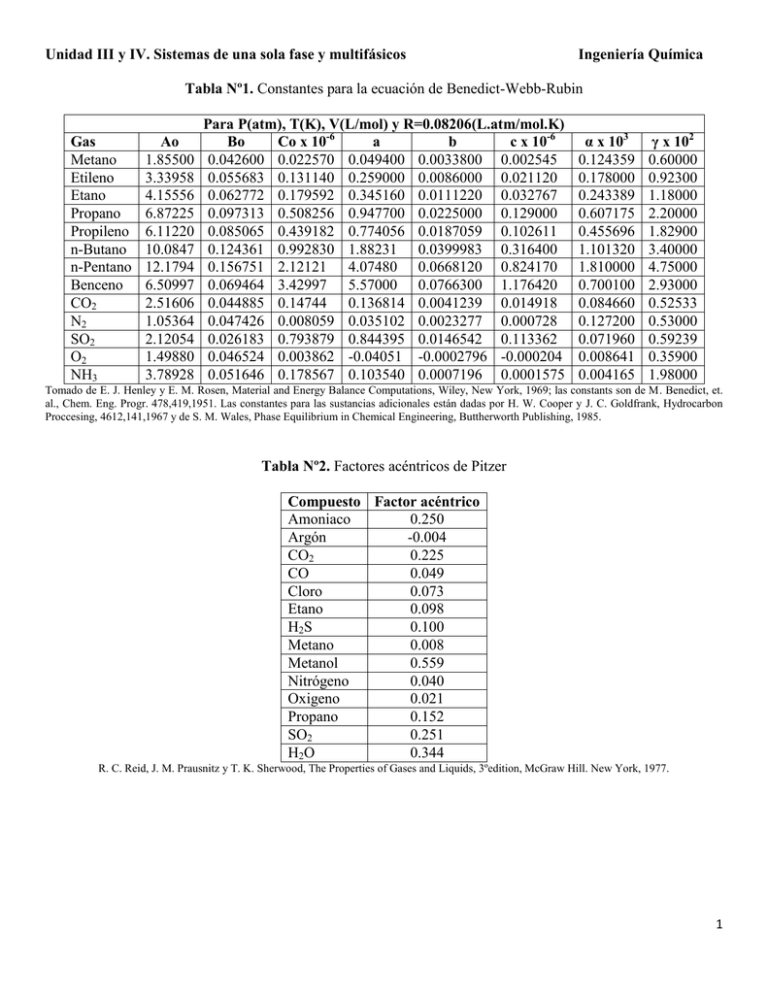
Unidad III y IV. Sistemas de una sola fase y multifásicos Ingeniería Química Tabla Nº1. Constantes para la ecuación de Benedict-Webb-Rubin Gas Metano Etileno Etano Propano Propileno n-Butano n-Pentano Benceno CO2 N2 SO2 O2 NH3 Ao 1.85500 3.33958 4.15556 6.87225 6.11220 10.0847 12.1794 6.50997 2.51606 1.05364 2.12054 1.49880 3.78928 Para P(atm), T(K), V(L/mol) y R=0.08206(L.atm/mol.K) Bo Co x 10-6 a b c x 10-6 0.042600 0.022570 0.049400 0.0033800 0.002545 0.055683 0.131140 0.259000 0.0086000 0.021120 0.062772 0.179592 0.345160 0.0111220 0.032767 0.097313 0.508256 0.947700 0.0225000 0.129000 0.085065 0.439182 0.774056 0.0187059 0.102611 0.124361 0.992830 1.88231 0.0399983 0.316400 0.156751 2.12121 4.07480 0.0668120 0.824170 0.069464 3.42997 5.57000 0.0766300 1.176420 0.044885 0.14744 0.136814 0.0041239 0.014918 0.047426 0.008059 0.035102 0.0023277 0.000728 0.026183 0.793879 0.844395 0.0146542 0.113362 0.046524 0.003862 -0.04051 -0.0002796 -0.000204 0.051646 0.178567 0.103540 0.0007196 0.0001575 α x 103 0.124359 0.178000 0.243389 0.607175 0.455696 1.101320 1.810000 0.700100 0.084660 0.127200 0.071960 0.008641 0.004165 γ x 102 0.60000 0.92300 1.18000 2.20000 1.82900 3.40000 4.75000 2.93000 0.52533 0.53000 0.59239 0.35900 1.98000 Tomado de E. J. Henley y E. M. Rosen, Material and Energy Balance Computations, Wiley, New York, 1969; las constants son de M. Benedict, et. al., Chem. Eng. Progr. 478,419,1951. Las constantes para las sustancias adicionales están dadas por H. W. Cooper y J. C. Goldfrank, Hydrocarbon Proccesing, 4612,141,1967 y de S. M. Wales, Phase Equilibrium in Chemical Engineering, Buttherworth Publishing, 1985. Tabla Nº2. Factores acéntricos de Pitzer Compuesto Factor acéntrico Amoniaco 0.250 Argón -0.004 CO2 0.225 CO 0.049 Cloro 0.073 Etano 0.098 H2S 0.100 Metano 0.008 Metanol 0.559 Nitrógeno 0.040 Oxigeno 0.021 Propano 0.152 SO2 0.251 H2O 0.344 R. C. Reid, J. M. Prausnitz y T. K. Sherwood, The Properties of Gases and Liquids, 3ºedition, McGraw Hill. New York, 1977. 1 Figura Nº1. Graficas de Cox para la presión de vapor (Tomado del A. S. Foust et. al., Principles of Unit Operations, Wiley, New York, 1960, p.550) 2 Figura Nº2. Carta de compresibilidad generalizada, presión reducida muy baja Tomado de D.M. Himmelblau, Basic Principles and Calculations in Chemical Engineering, 6ª edición.1997, p.285. 3 Figura Nº3. Carta de compresibilidad generalizada, baja presión. Tomado de D.M. Himmelblau, Basic Principles and Calculations in Chemical Engineering, 6ª edición.1997, p.286. 4 Figura Nº4. Carta de compresibilidad generalizada, para presión intermedias. Tomado de D.M. Himmelblau, Basic Principles and Calculations in Chemical Engineering, 6ª edición.1997, p.286. 5 Figura Nº5. Carta de compresibilidad generalizada, para presiones altas. Tomado de D.M. Himmelblau, Basic Principles and Calculations in Chemical Engineering, 6ª edición.1997, p.287. 6 Figura Nº6. Carta de compresibilidad generalizada, carta de Nelson y Obert. Tomado de D.M. Himmelblau, Basic Principles and Calculations in Chemical Engineering, 6ª edición.1997, p.287. 7 8 9 10 11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 Figura Nº6. Carta Psicrométrica a Temperatura normales S.I al nivel del mar 31 Figura Nº7. Carta Psicrométrica a Altas Temperaturas S.I al nivel del mar 32 Figura Nº8. Carta Psicrométrica a Temperatura Normales a 5000 pies sobre el nivel del mar 33 Figura Nº9. Carta Psicrométrica a Temperatura Normales a 7500 pies sobre el nivel del mar 34 Figura Nº10. Diagrama ternario 35 36 37