Inoculación con Azospirillum spp. en cultivo de algodón (Gossypium
Anuncio

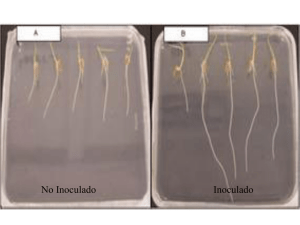
Inoculación con Azospirillum spp. en cultivo de algodón (Gossypium hirsitum)* Avila Poletti, Hugo - Iglesias, María C. - Díaz, Irma - Sager, Danilo1 Cátedra de Microbiología Agrícola - Facultad de Cs. Agrarias - UNNE. Sargento Cabral 2131 - (3400) Corrientes - Argentina. Tel./Fax: +54 (03783) 427131 E-mail: [email protected] - [email protected] 1. TIPOITI SATIC. INTRODUCCION Y ANTECEDENTES En los últimos años, la fijación del nitrógeno por especies del género Azospirillum spp. ha recibido considerable atención, por la capacidad de estos microorganismos de formar una estrecha relación con numerosas especies de planta, especialmente gramíneas. Las primeras observaciones de infección por Azospirillum sp. fueron realizados por Dobereiner y Day (1974) en Digitaria decumbens. (Citaddos por Frioni 1999, Bellone et al. 1999) Posteriormente Patriquin y Dobereiner confirmaron la infección en el tejido cortical central del maíz y a partir de entonces gran cantidad de estudios se realizaron y se hacen en relación con esta interacción planta-bacteria. Se sabe que la bacteria puede colonizar el interior de la raíz, siendo controvertida la forma de penetración y localización dentro del tejido de la planta. (Bellone et al 1999). Las rizobacterias benéficas que promueven el desarrollo vegetal se designaron como promotoras del crecimiento vegetal (PGPR ; Plant Growing Promoting Rhizobacteria) y son extensamente estudiadas por sus efectos benéficos en rendimientos de importantes cultivos ( Frioni L. 1999). En trigo si bien se ha detectado actividad nitrogenasa en inoculación con Azospirillum sp, se ha puesto en duda el hecho de que la bacteria aporte cantidades apreciables de nitrógeno a la planta y se ah informado efectos benéficos sobre el crecimiento. Reflejados en distintos parámetros (Iglesias et al. 2000), atribuidos a la producción de factores de crecimiento, especialmente giberelinas. En maíz (Zea mays) en cultivo de secano se inoculo con cepas de tres microorganismos fijadores de nitrógeno (Azotobacter; Biejerinkia y Azospirillum), resultando la asociación maíz-Azospirillum la más efectiva dentro de los tratamientos probados, (Jaime M. et al. 1999). También en un cultivo de maíz (Zea mays) inoculado con Azospirillum spp., se realizó con fertilización de base (Fosfato diamónico) y a la sexta hoja (Urea) ; se obtuvieron mayores rendimientos con los tratamientos : Fertilizado con fósforo + urea y inoculado +fósforo y el tratamiento inoculado + fertilizado superaron al testigo en peso de espigas pero no se reflejó diferencias en el peso de los granos. (Zanier et al. 2001). La presencia de Azotobacter, Beijerinckia y Azospirillum en la rizosfera de Allenrolfera Vaginata en suelos de alta salinidad de la llanura deprimida de Tucumán, permitiría la selección resistente para su posterior inoculación a otras especies vegetales, en particular esto seria más factible con bacterias del genero Azospirillum, cuya cantidad por gramo de raíz, denote una mejor adaptación al medio que las otras especies de microorganismos evaluados ( Jaime et al. 1999). Iglesias et al. 2000 realizaron en algodón la co-inoculación con Azospirillum y Saccharomyces manifestando un mayor incremento en altura y número de pimpollos por plantas. De lo expuesto surgió el objetivo de éste trabajo de: Evaluar la efectividad de la inoculación con microorganismos fijadores de nitrógeno (MFN); Azospirillum en el cultivo de algodón en suelos de la Pcia. de Formosa. MATERIALES Y METODOS El ensayo se realizó en el establecimiento Itatí ; Ubicado en la provincia de Formosa, Departamento Patiño; Localidad Villa Gral. Güemes, distante a unos 200 Km de la Ciudad Capital que lleva el mismo nombre de la provincia (Formosa). Las características climáticas de la zona donde se realizó la experiencia corresponde a una zona subhúmeda seca, comprendida dentro de la región (III); (1) La participación en la producción del cultivo del algodón en la Provincia de Formosa se encuentra concentrada en los Departamentos (Pirané y Patiño) que aportan un 62,5 % del total de la producción de esta Provincia. (2) El Lote destinado al ensayo tiene una superficie de 6 Ha. En el mismo se realiza agricultura, aplicando sistemas de labranza convencional desde la Campaña 1977/78 hasta 2001/02; fecha de realización de la experiencia, sumando un total de 24 años de agricultura. Las rotaciones que alternaron en esos años fueron de cultivos de algodón, sorgo, girasol, soja, maíz, sandía, zapallo, etc. La preparación de suelos se hizo mediante roturación de suelo, realizando la técnica de barbecho limpio, usando herramientas para la labor primaria de semi - incorporación de rastrojo rastra pesada de doble acción de tiro excéntrico (Rome), para las labores complementarias rastra liviana de doble acción de tiro excéntrico, rastra de dientes. La siembra se realizó con una sembradora convencional de cuatro surcos, se inoculó la semilla con Azospirillum brasilense Az 39 INTA a razón de 300 ml de inoculante líquido por cada 10 Kg de semilla, usando para la dosificación un asperjador de capacidad de un litro. La variedad de semilla usada corresponde Guazuncho II INTA, segunda multiplicación, usando semilla no deslintada. La densidad de siembra fue de 20 - 25 Kg Ha-1 logrando una emergencia de 20 plantas por m lineal, posteriormente con la primer carpida se raleó dejando una densidad de 12 plantas por m lineal cuando las plantas presentaron 4 hojas verdaderas. El control de malezas se realizó por métodos mecánicos (escardilladas) y a través de carpidas. En el ensayo se trabajó en un diseño en franjas siendo las mismas de 10 m de ancho cada una por 500 m de largo, los tratamientos fueron: I - Testigo II – Inoculado Se realizó un muestreo al azar sistemático una planta cada 20 pasos, en total 10 plantas en los surcos centrales a lo 40 días (1º muestreo), a los 60 días (2º muestreo) y a los 130 días (3º muestreo). En el 1º muestreo: Se determinó peso seco de la planta ( parte aérea y radical), altura y Nº de hojas. En el 2º muestreo: Altura, ramificaciones, flores, pimpollos y cápsulas cerradas (bochas). En el 3º muestreo : Flores, cápsulas abiertas (capullos) y cápsulas cerradas (bochas). El análisis de los datos se realizó mediante la determinación de los distintos parámetros de posición y dispersión y el análisis de la variancia mediante Linear Models General AOV / AOCV y la diferencia lï mite de significación (DLS) mediante prueba de T. RESULTADOS Y DISCUSION En el primer muestreo dio como resultados un mayor incremento en altura y en el peso de las plantas para el tratamiento inoculado. (Figura 1) Primer Muestreo 12 Altura cm 10 P Aerea-g 8 P Raíz -g 6 4 2 0 Testigo Inoculado Figura 1: Primer muestreo. En el segundo muestreo el número de ramificaciones; no marcó mayores diferencias, pero el numero de pimpollos fue favorable para el T2 inoculado, (Figura 2) sin embargo los valores obtenidos en la medición de pimpollos y cápsulas (bochas), son levemente superiores para el tratamiento I con respecto al tratamiento II Segundo Muestreo 45 Nº Ramific. 40 Nº Flores 35 30 NªPimpollos 25 Nº Bochas 20 15 10 5 0 Testigo Inoculado Figura 2: Segundo muestreo. En el tercer y último muestreo la mayoría de las mediciones marcaron tendencias a favor de la inoculación, de igual manera ocurre con los análisis de rendimiento en fibra, semilla y calidad de fibra ( Figura 3 y tabla 1); Durante el ensayo se registró periodo de sequía que sufrió el cultivo, de unos 20 días aproximadamente entre el 2ª y 3ª o último muestreo efectuado. Tercer Muestreo Nº Ramific. 40 35 Nº Bochas cerr. 30 25 Nº Bochas abiert. 20 15 10 peso fibra -g 5 0 Testigo Peso semillas-g Inoculado Figura 3: Tercer muestreo Se puede inferir que el tratamiento con Azospirillum influyó en el aumento en cantidad de bochas abiertas (capullos), por un mejor aprovechamiento del agua, producción de fitohormonas y el grado de fertilidad del suelo expresado por Dobereiner. 1992, Ruschel y Pontes. 1992; Arshad y Frankenberger. 1992; Rodríguez Cáceres et al. 1996; Perotti y Pidello 1999, Todos citados por Iglesias et al. 2000; Resultados T1 testigo Calidad de fibra Largo Uniformidad Resistencia Microner Color Tipificación 29.8 46.3 21.8 4.5 31-3 “C” T2 inoculado 28.9 47.7 20.9 4.6 31-1 “B 3/4 En el análisis realizado sobre la calidad de fibras, en la desmotadora e hilandería TIPOITI SATIC, se obtuvo una leve tendencia a una mejor calidad de fibras en el Tratamiento II, con una clasificación de (B 3/4), con respecto al tratamiento I , con una clasificación de (C ). CONCLUSION En este ensayo se observó una leve tendencia favorable a la inoculación en la mayoría de los parámetros considerados. BIBLIOGRAFIA Ø (1) Atlas del suelo de la República Argentina Provincia de Formosa Escala 1:500000, INTA Proyecto PNUD, Argentina. Área de Edafología, Base Departamental: Dirección de Catastro Provincial Ø (2) Boletín INTA;EERA ; P.R.S. Peña; 1982. Ø Bellone, C. H.; Carrizo de Bellone, S.; Monzón de Asconegui, M. A. 1999. Azospirillum en el Interior de las Raíces de Caña de Azúcar (Saccharum sp. L.). IIº Reunión Científica Técnica - Biología del suelo - Fijación Biológica del Nitrógeno. Universidad Nacional de Catamarca. F C A. Pág. 263-265. Ø Frioni, L. 1999. Procesos microbianos. Tomo I y II. Edición de la fundación de la Universidad Nacional de Río Cuarto, Córdoba. Pág. 177. Ø ----------, 1999. Microorganismos promotores del crecimiento vegetal. IIº Reunión Científica Técnica Biología del suelo - Fijación Biológica del Nitrógeno. Universidad Nacional de Catamarca. F C A. Pág. 1-4. Ø Jaime, M. Martin, G.O.(h) ;Fernandez, R.R. ;Nasif, A. Maretinez Pulido, L. 1999. Llanura Deprimida Salina de Tucumán: Presencia de Fijadores Libres de Nitrogeno en Raices de Allenrolfea Vaginata (Grseb) Kuntze (chenopodiaceae). IIº Reunión Científica Técnica - Biología del suelo - Fijación Biológica del Nitrogeno. Universidad Nacional de Catamarca. F C A. Pág. 209-211. Ø Zanier, F. D.; Francescutti, F. V.; Veron, R; Iglesias, M C. 2001. Ensayo de Inoculación de maíz (Zea mays) con Azospirillum sp. XIIº Reunión de Comunicaciones Científicas y Técnicas. Universidad Nacional del Nordeste (UNNE). Pág. 158. * Trabajo realizado en el marco del convenio Cátedra de Microbiología Agrícola – BPF Arg. S.A. Agradecimiento al Establecimiento del Sr. Avila Poletti. Formosa y al Sr. Daniel Rotela .