1314 piladaniell
Anuncio

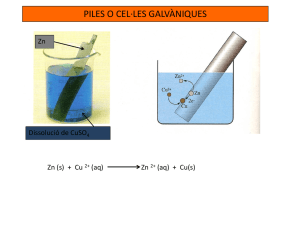
Science and Technology Department Nom i cognoms_________________________________________________ Data ________________ Curs _______________ Qualificació ___________ PRÀCTIQUES QUÍMICA 2 PRÀCTICA 5. APLICACIONS DE LES REACCIONS REDOX EXPERIMENT 1. DETERMINACIÓ DE LA fem D’UNA PILA DANIELL Objectiu Muntatge d’una pila Daniell i mesura de la seva fem. Material - Voltímetre. - Cables de connexió amb pinces de cocodril. - Vasos de precipitats de 100 cm3. - Dissolució de CuSO4 1 M. - Dissolució de ZnSO4 1 M. - Dissolució saturada de NaCl. - Làmina de Zinc. - Làmina de Coure. - Tub de plàstic- Cotó o llana de vidre. Procediment Preparació de dissolucions - Prepareu 100 cm3 d’una dissolució 1 M de CuSO4. - Prepareu 100 cm3 d’una dissolució 1 M de ZnSO4. - Prepareu una dissolució saturada de NaCl. (solubilitat del NaCl a 25 ºC 35,9 g NaCl/100 mL d’aigua). Muntatge de la pila - Netegeu les làmines de coure i zinc amb alcohol per tal que no hi quedin rastres de greix. - Aboqueu la dissolució de CuSO4 en un vas de precipitats i submergiu-hi la làmina de coure. Això constitueix la semipila de coure. - Aboqueu la dissolució de ZnSO4 en un vas de precipitats i submergiu-hi la làmina de zinc. Això constitueix la semipila de zinc. - Per preparar el pont salí: Agafeu un tub de plàstic i tapeu-lo amb cotó fluix per un extrem. Science and Technology Department Amb ajuda d’una pipeta, ompliu el tub amb la dissolució saturada de NaCl i tapeu-ne l’altre extrem també amb cotó fluix. - Col·loqueu el pont salí entre els dos vasos de precipitats de manera que cada extrem estigui submergit en una dissolució diferent. - Connecteu els cables conductors amb la làmina de zinc i la de coure. - connecteu els fils conductors a la terminal del voltímetre, tenint en compte que el zinc és l’ànode (-) i el coure, el càtode (+). Anàlisi de resultats - Escriviu les semiequacions corresponents al procés. - Escriviu la notació d’aquesta pila. - Calculeu la fem teòrica d’aquesta pila i compareu-la amb l’experimental. - Dibuixeu el muntatge experimental que heu realitzat. - Anoteu els càlculs realitzats per la preparació de les dues dissolucions 1 M de CuSO4 i ZnSO4 i expliqueu el procediment emprat al laboratori tot subratllant el material emprat. - Anoteu els càlculs realitzats per la preparació de la dissolució saturada de NaCl i el procediment de laboratori emprat. EXPERIMENT 2. LA BATERIA D’HIDROGEN Objectiu: - Construir una senzilla pila de combustible. - Evidenciar que es tracta d’un generador d’electricitat. Material: - Vas de plàstic. - Paper de filtre. - Dos fregalls d’acer inoxidable. - Cables de connexió. - Bombeta de 2,5 V. - Motor DC 0,5 V. - Sulfat de sodi. - Pila de 4,5 V. Introducció. Primer realitzarem l’electròlisi de l’aigua (procés no espontani) utilitzant un generador de corrent (pila de 4,5 V) per obtenir H 2 i O2 que quedaran adsorbits en els filaments dels fregalls. A continuació deixarem que H2 i O2 reaccionin espontàniament produint electricitat, com ho fan a les piles de combustible. Per evidenciar-ho encendrem una bombeta o farem funcionar un petit motoret. Procediment Posarem dins d’un vas de plàstic dos fregalls d’acer inoxidable separats per un paper de filtre.(al menys unes quatre làmines). Cal evitar que es toquin Science and Technology Department els dos fregalls. Damunt dels fregalls hi posarem una cullerada de sulfat de sodi. Afegirem aigua fins que gairebé cobreixi els fregalls. Amb els cables connectarem a la pila i esperarem. S’està produint l’electròlisi de l’aigua. El sulfat de sodi només serveix com a electrolit però no intervé per res en la reacció. Es tracta d’un procés completament forçat pels electrons que surten de la pila. Procés no espontani. En el born negatiu es forma gas hidrogen que queda parcialment adsorbit en el fregall d’acer. En el born positiu es forma oxigen gas que també queda adsorbit en part en l’altre fregall d’acer. Escriu la reacció que ocorre al born negatiu i la reacció que ocorre al born positiu: * * Deixarem que es faci aquest procés durant aproximadament un o dos minuts. A continuació desconnectarem la pila i connectarem en el seu lloc la bombeta: veurem que s’encén una mica. Retirarem la bombeta i connectarem el motor. El motor funciona. S’ha produït una reacció espontània de transferència d’electrons. L’aparell s’ha convertit en una pila. És l’anomenada “pila de combustible”. Ara les reaccions que ocorren al procés espontani seran diferents. Ara al born negatiu l’hidrogen molecular dóna electrons. Ara al born positiu l’oxigen capta aquests electrons. Escriu la reacció que ocorre al born negatiu. Escriu la reacció que ocorre al born positiu. El resultat final és l’obtenció d’aigua (H2O). * * Questions - Fes un dibuix esquemàtic del funcionament d’una pila de combustible. Science and Technology Department EXPERIMENT 3. ELECTRÒLISI D’UNA DISSOLUCIÓ DE NaCl Fes un dibuix del muntatge experimental emprat, escriu les reaccions que ocorren a cada elèctrode, anomena els electrodes i llurs polaritats. 1. Per què no és possible obtenir Na a partir de l’electròlisi d’una dissolució de salmorra? 2. Com es produeix el lleixiu a partir d’una dissolució de salmorra? Escriu les reaccions que tenen lloc en aquest procés. Science and Technology Department EXPERIMENT 4. ELECTRÒLISI DE L’AIGUA Dibuixa el Voltàmetre de Hofmann i escriu les reaccions que ocorren a cada un dels elèctrodes i la seva polaritat. Anota el volum recollit de cada un dels gasos obtinguts i explica el per què d’aquest resultat.