prueba-articulo4470.pdf
Anuncio

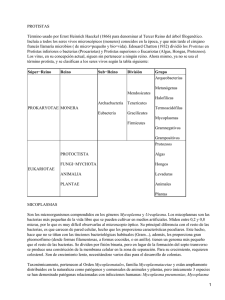
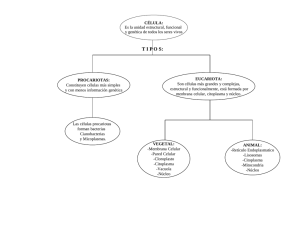
Artículos originales de investigación 111217 - Validación del método de cultivo microbiológico para su utilización en el diagnóstico de micoplasmas en sueros, cultivos celulares y productos biofarmacéuticos (Validation of microbiological culture method for use in diagnosis of mycoplasma in se sentido sensibles caso Europea, diagnóstico ensayo, resulta técnica NC objetivo micoplasmas biomédica microbiológico 17025:2006.Para diferentes de validación específico con rápido, una estos ISO/IEC del imprescindible bajo es establecer alta pero cultivo 2007 yparámetros para del confiables microorganismos. para de imprescindible en un precisión, 17025:2006. para como especificidad en micoplasmas, Sistema CM microbiológico validado yla MYCOLAB menos esto un productos detección demostrar técnica para de lograr diagnóstico lo se de comprobó costoso. desempeño que yladisponer Por Gestión validó aydetección la capaz emplear acreditado tiene de permite (CM), MYCOLAB medianteel precisión. lavalidación biofarmacéuticos lo estos confiabilidad confiable el tanto, de implementado que aprobada de como para (CM) brindar detectar de la agentes técnicas el Como Calidad estas por nos yel (Laboratorio fueron ensayo para teniendo ensayo acreditación diagnóstico un por propusimos hasta de la especies, resultados que diagnóstico la (SGC) robustez, de un la de los NC detección Farmacopea incluye 1 es de sistema diagnóstico en resultados UFC/mL aplicación según de para ISO/IEC robusto, de tal cuenta cultivo En de rutina como límite es este esta más de tal el la y Losdetección, celulares, del necesario contaminaciones, micoplasmas para desarrollo micoplasmas laconfiable fabricación sueros ,micoplasmas) de como controlar yse específicamente infectan yla productos liberación parte biotecnología frecuentemente de biofarmecéuticos. de estrictamente los estos sistemas las en productos. Cuba, producidas los de se A cultivos calidad estas partir hace por Introducción. La validación no es más que la confirmación mediante la aportación de evidencia objetiva de datos que respaldan la existencia o veracidad de algo, estos pueden obtenerse por medio de la observación, medición, en Para validar los métodos se hace referencia a los parámetros a comprobar de acuerdo con las características de los ensayos cuantitativos o cualitativos de analitos mayoritarios o minoritarios en la muestra evaluada según lo refiere la REGULACIÓN No. 41-2007 del CECMED (Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos), durante este proceso es posible identificar si la metodología nueva o modificada se acepta para su uso, en tanto demuestre equivalencia con el método de referencia, entendiéndose ésta como una diferencia no significativa en los resultados emitidos por ambos métodos, o se determine que el nuevo ensayo demuestra un comportamiento superior. Si en el proceso de validación el nuevo ensayo demuestra un recuento significativamente más bajo que el de referencia, se debe rechazar (Barrell et al., 2002). Teniendo presentes urogenital los et aquellos materias al., productos 2010) métodos primas en yenlas ycuenta un biotecnológicos por articulaciones derivados gran otra validados lonúmero parteél anterior biológicos que tanto de gran y garanticen conociendo aplicación enfermedades desarrollo del como hombre cultivos biomédica laelpapel de seguridad como infecciosas, la biotecnología, de patogénico de (Chaudhry células, de los productos, animales, pudiéndose sueros de et surge los al.,fetales, además los micoplasmas 2004; laencontrar cuales necesidad Ferrer, enzimas, dedentro infectar colonizando que de 2005; entre establecer de de las su Rivera-Tapia manera otros plantas, obtención los tractos (Hernández, sistemas indiscutible losutilizan et cultivos respiratorios, al., de2010;Arismendi calidad están 2007). como celulares paray Dentro de los sistemas de calidad la detección de contaminaciones biológicas juega un importante rol, de modo que las agencias reguladoras han establecido normas relacionadas con la detección de estas contaminaciones y entre ellas, específicamente, la detección de micoplasmas como prueba determinante para la liberación o no de productos biotecnológicos (Farmacopea Británica, 2004; Regulación 16:2006 CECMED; Farmacopea Europea, 2007), debido a los efectos indeseables que producen estos microorganismos en el individuo que recibe los productos contaminados, el error en la interpretación de un diagnóstico y en las alteraciones que inducen los micoplasmas en la actividad y funciones de la célula, relacionadas con la producción de severos eventos citopáticos, la inhibición de síntesis de carbohidratos, proteínas, ácidos nucleicos (Lobo y Vega, 2004; Rivera-Tapia et al.,2010). El Laboratorio de Diagnóstico de Micoplasmas, del CENSA (Centro Nacional de Sanidad Agropecuaria), cuenta entre los procedimientos utilizados para el diagnóstico de micoplasmas con el método de cultivo microbiológico el cual es utilizado por centros de referencias internacionales además de ser reconocida como la técnica de referencia en los documentos normativos relacionados con diagnóstico de micoplasmas en animales, cultivos celulares y productos biofarmacéuticos. En tal sentido la validación de este procedimiento en nuestro laboratorio nos pone al mismo nivel de los estos centros de referencias internacionales, además, de ser el único laboratorio del país que brinda el servicio de detección de micoplasmas a los diferentes productos o materias primas utilizadas tanto para investigaciones, producciones como componentes de diagnosticadores desarrollados por los diferentes centros del polo científico. Para el desarrollo del protocolo de validación se tuvo en cuenta lo referido en la REGULACIÓN No. 41-2007 del CECMED bajo un sistema de calidad regido por la norma NC ISO /IEC 17025:2006. MATERIALES Y MÉTODOS. Materialde Referencia Certificado (MRC), utilizado como controles positivos en elensayo Cultivo Microbiológico. Cepa de Mycoplasma arginini (M. arginini) NCTC 10129 1 : esta cepa se presenta como el contaminante más frecuente de cultivos celulares, sueros y productos biofarmacéuticos. Es la cepa tipo a emplear en los ensayos de cultivo microbiológico y PCR según lo recomendado por la Farmacopea Británica, 2004; Farmacopea Europea, 2007. Cepa de Mycoplasma orale(M. orale) NCTC 101121 Cepa de 101161 Acholeplasma laidlawii(A. laidlawii ) NCTC Cepa de Mycoplasma hyorhinis (M. hyorhinis) NCTC 101301 Cepa de Mycoplasma fermentans,(M. fermentans)NCTC 101171 Cepa de Mycoplasma mycoides subsp. mycoides small colony biotype (MmmSC). ATCC 279481 Cepa de Mycoplasma mycoides subsp. mycoides large colony biotype (MmmLC). NCTC 101371 Cepa de Mycoplasma spp. Material de colección del laboratorio de Microbiología del Instituto Zooprofiláctico de Teramo, Italia. (Laboratoriode referencia de la OIE para el diagnóstico de la Pleuroneumonía contagiosa bovina). Desarrollo de la validación del método de cultivo microbiológico para el género Mycoplasma. Siembra de las cepas. La siembra de las cepas se realizó según lo descrito por Hayflick, 1965. Las cepas liofilizadas se resuspendieron en 1 mL de medio Micoplasma Hayflick líquido. Posteriormente se tomó 0.2 mL de cada una de las cepas y se sembró en medio Micoplasma Hayflick Agar. Se incubó a 370C en incubadora (Thermolyne) durante 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998. Estudio morfológico Las colonias fueron observadas a las 48 horas de incubación usando un microscopio óptico (Opton) de luz ordinaria bajo una magnificación de - 35 x. Se siguió como criterio de caracterización la formación de colonias pequeñas, entre 50 a 500 mm de diámetro y en forma de “huevo frito”,según lo descrito por Poveda, 1998. Cultivos de las cepas. El cultivo se realizó según lo descrito en el Manual de Obtención de Antígeno del Instituto de Investigaciones de la Universidad de Georgia, 2002. Se cortó un bloque de 1 cm2 de las placas crecidas y se sembraron en 5 mL de medio Hayflick líquido. Posteriormente se incubaron a 370C por 48 horas hasta que alcanzaron la fase exponencial de crecimiento con un pH entre 7.4-7.5 y una densidad óptica (DO 540nm) entre 0.2-0.4, medida en espectrofotómetro (Pharmacia). Se sembraron estos 5 mL de cultivo en 20 mL de medio Hayflick líquido, para un volumen final de 25 mL y se incubaron a 370C por 48 horas, hasta que alcanzó la DO y pH requeridos. Se realizó otro pase sembrando 10 mL de estos precultivos en 40 mL de medio, para un volumen final de 50 mL manteniendo las mismas condiciones de crecimiento. Por último, se tomaron 20 mL de los cultivos crecidos y se sembraron en 80 mL del medio en las mismas condiciones de crecimiento, para un volumen final de 100 mL. En cada pase, el cultivo de las cepas fue sembrado en Agar sangre para el control bacteriológico. Metodología de Validación. Teniendo en cuenta que este ensayo pertenece a la categoría de ensayo cualitativo, según la clasificación realizada por la Organización Internacional de Sanidad Animal (OIE) 2008 y la REGULACIÓN No. 41-2007 del CECMED , se tuvo presente la demostración de los siguientes parámetros: estudio de robustez, límite de detección, especificidad y precisión. ESTUDIOS DE ROBUSTEZ, LÍMITE DE DETECCIÓN, ESPECIFICIDAD Y PRECISIÓN DEL CULTIVO MICROBIOLÓGICO. Robustez En el estudio de robustez se evaluaron las siguientes variantes: - Diferentes rangos de temperaturas (330C, 350C; 370C y 390C) manteniendo una atmosfera de 5% CO2, - Diferentes seisy 12 meses). tiempos de conservación del suero equino para ser empleado como suplemento del medio de cultivo (tres meses, - Diferentes medios de micoplasma base Biopreparados, Cuba). PPLO-OXOID y Micoplasma Base Caldo- BIOCEN (Centro Nacional de Límite de detección. Se partió de un cultivo inicial de Mycoplasma arginini (NCTC 10129), con una concentración de 2x10 8 UFC/mL. S e realizaron diluciones seriadas en base a diez,desde 10 -1 hasta 10 -10 UFC/mL, las mismas fueron sembradas en placas con medio Hayflick e incubadas a 37 0 C por 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998. Todas las diluciones se trabajaron por triplicado. Especificidad. Para la determinación de este parámetro se utilizaron los siguientes cultivos de los MRC mencionadas anteriormente: - M. arginini,con una concentración de 2x108 UFC/mL - M. hyorhinis; con una concentración de 1.4 x108 UFC/mL - M. fermentans;con una concentración de 3,2x108 UFC/mL - M. orale con una concentración de 2.2x108UFC/mL - A. laidlawii, con una concentración de 1.7x108 UFC/mL -Staphylococcus aureus con una concentración de 2x108 UFC/mL,(ATCC 6538), donada gentilmente por Laboratorio de Microbiología, Dirección de Aseguramiento de la Calidad, CENSA. Los cultivos fueron sembrados en placas con medio Hayflick e incubadas a 370C por 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998.Todos los cultivos de las cepas se trabajaron por triplicado. Precisión La determinación de la precisión se realizó en dos niveles: intraensayo e interensayo relacionado con la elaboración del medio de cultivo, comprobando para cada caso la esterilidad y promoción delcrecimiento. - intraensayo(repetibilidad): elaboración del Medio de cultivo Hayflick por un mismo analista y bajo las mismas condiciones de trabajo en diferentes días, hastallegar a un total de 20 lotes con 15 placas cada uno. De ellas el 100% fueron sometidas a prueba de esterilidad y el 20% apromoción del crecimiento. - interensayo (precisión intermedia): realizado por dos (2) analistas, con las mismas condiciones, endías diferentes. En este estudio se mantuvo las mismas condiciones del análisis anterior para cada analista. Para el análisis estadístico de los resultados se utilizó la prueba t de student para comprobar la homogeneidad de varianza. RESULTADOS Y DISCUSIÓN. ENSAYOS RELACIONADOS CON EL CULTIVO PARA MICOPLASMAS. A pesar de los avances tecnológicos en el diagnóstico de los micoplasmas, el método de cultivo continúa siendo la técnica de referencia aprobada por las diferentes famacopeas (Farmacopeia Europea, acápite 2.6.7 y 2.6.16,2007 y 2010 y organismos reguladores como la OIE (Manual de la OIE, 2008), Organización Mundial de la Salud (OMS, 2000 y 2010) y la Organización Panamericana de la Salud (OPS, 2000). En la Figura 1 se observan los resultados obtenidos como parte del estudio morfológico utilizados en este ensayo. En todos los casos se puedo apreciar la conocida forma de “huevo frito” reportada como característica distintiva de los micoplasmas consistente en una región central granular oscura embebida en el agar y una zona traslúcida periférica alrededor de esta, lo cual coincide con lo reportado por Poveda, 1998 y aparece descrito en el Manual Bergey, del 2010. Los cultivos de estas cepaspresentaron el pH y DO requeridos según se refiere en el Manual de Obtención de Antígeno del Instituto de Investigaciones de la Universidad de Georgia, 2002, donde se señala que valores de pHentre 7.2 y 7.5 y una absorbancia entre 0.2 y 0.4 nm es lo recomendadoen un cultivo para ser utilizado en los ensayos de validación. Valores similares fueron obtenidos por Hernández, 2005 y Zamora, 2006 quienes señalan, además, que cuando un cultivo mantienesus propiedades morfológicas y bioquímicas estables y homogéneos, pueden ser utilizados en estudios de caracterización y posibilita la extracción de ADN de buena calidad. El análisis bacteriológico de estos cultivos resultó negativo, lo que demuestra que no presentaba contaminación bacteriana y que el crecimiento evidenciado se corresponde con las especies de micoplasmas y no con las conocidas formas L bacterianas ya que en subcultivos realizados todas las cepas de micoplasmas crecieron. Lo anterior tiene su explicación ya que en condiciones de incubación favorables o en las fases tempranas del cultivo (24 y 72 horas (hrs), las formas celulares esféricas de 0,3 µm de diámetro son las predominantes. Cuando las condiciones de incubación no son las óptimas o el cultivo ha envejecido, comienzan a aparecer formas cilíndricas (100 µm de largo yentre 0,3-0,4 µm de ancho), que contienen varios nucleoides similares a las formas L bacterianas. Estas estructuras fibrilares se fragmentan y dan origen a estructuras esféricas de 0,1 a 0,25 µm, denominadas “cuerpos elementales”, que carecen de viabilidad, según lo descrito por Razin y Concenza, 1966. Cuando estas estructuras son re-inoculadas en un medio fresco, no son capaces de crecer ni de multiplicarse criterios que sustentan los resultados obtenidos por nosotros. ESTUDIOS DE ROBUSTEZ, LIMITE DE DETECCIÓN, ESPECIFICIDAD Y PRECISIÓN DEL CULTIVO MICROBIOLÓGICO. Según lo establecido en la Farmacopeia Británica Veterinaria, 2004; Manual OIE, 2008 y Farmacopeia Europea, 2007 es necesario emplear material de referencia certificado en los estudios devalidación de cualquierensayo,ya que los mismos poseen todas sus propiedades bioquímicas y enzimáticas estables. El empleo de este material garantiza obtener resultados confiables y permite demostrar que realmente el ensayo empleado es útil para detectar el microorganismo deseado. De acuerdo a lo establecido en la Regulación 41/2007 del CECMED y la NC ISO/IEC 17025:2006, los métodos normalizados y estandarizados no requieren validación sino una evaluación de su desempeño. No obstante, para la introducción de los mismos cada laboratorio definirá sus criterios de evaluación caso a caso, tomando en consideración las características del método y la experiencia que se tenga en la caracterización del producto en cuestión. ROBUSTEZ Los resultados obtenidos en relación a las condiciones de incubación empleando diferentes rangos de temperaturas evidenciaron que en el caso de las variables de 330C, 350C y 390C no hubo crecimiento en ninguno de los medios utilizados, por el contrario si se observó crecimiento a 37ºC ±0,5 de temperatura. Esto se debe a que los micoplasmas son microorganismos mesófilos y necesitan este rango de temperatura para propiciar su crecimiento Poveda, 1998. Este resultadotambién coincide con lo reportado porBaseman et al., 2004,quienes obtuvieronde la región del cuello uterino y de la vagina 21 aislados de M. genitalium durante una investigación a 31 mujeres que presentaban uretritis no gonocócica al sembrar estos exudados en el medio SP-4 a 37ºC durante 21 días evidenciándose el cambio de pH. Se conoce que los micoplasmas carecen de las vías biosintéticas necesarias para la síntesis de ácidos grasos y precursores de los ácidos nucleicos ( Manual Bergey, 2002) , además de ser incapaces de sintetizar esteroles, es por ello que en su mayoría se presentan como parásitos de organismos eucarióticos, asociados a la membrana tanto de la célula como a la de los orgánulos citoplasmáticos ( Willby et al., 2000 ). Teniendo en cuenta estas características y para favorecer el crecimiento de estos microorganismos en medios artificiales se utiliza el suero equino como uno de los requerimientos nutricionales más relevante. En el estudio de los tiempos de conservación de tres, seis y doce meses del suero equino utilizado como suplemento, no se observó diferencia significativa entre los tres tiempos evaluados (Tabla 1), esto puede debersea que la conservación a-20ºCdel suero equino en estos intervalos de tiempo no afecta la calidad del colesterol favoreciendo el crecimiento de los micoplasmas. Estudios similares fueron llevados a cabo por Hernández et al., 2005 quienes confirman estadísticamente, la factibilidad que tiene el empleo del suero equino con respecto al empleo del suero humano para realizar la prueba de la coagulasa en tubo para la detección de Staphylococcus aureus por parte de los laboratorios microbiológicos y de poderobtener grandes volúmenes para su distribución a diferentes laboratorios, al mostrar ser muy estable a - 20 ºC por un período de 12 meses. El tercer parámetro evaluado en la robustez fue el empleo de dos tipos de medios de Micoplasma base procedente de dos casas comerciales, OXOID yBIOCEN. Además del suero equino utilizado como suplemento en el medio de cultivo y las condiciones de incubación, es importante conocer que a veces los componentes pueden ser tóxicos para los micoplasmas, según lo refiere Manual Bergey, 2002 recomienda el uso del Agar purificado o Agar Noble, que garantiza las condiciones óptimas de crecimiento en el medio de cultivo. Como resultado de este estudio se pudo evidenciar queno hubo diferencias en cuanto a los parámetros de control de esterilidad y promoción del crecimiento entre los medios analizados, comportándose de manera satisfactoria ambos medios de cultivo, estos resultados coinciden con los obtenidos por Pérez et al., 2001quienes aplicaron un diseño compuesto central para estudiar el medio de cultivo Mycoplasma base (Oxoid), enriquecido con extracto de levadura, suero equino y glucosa, para el crecimiento deM. gallisepticum en el cual demostró que una disminución de un 40% del medio Micoplasma base no influye negativamente en el rendimiento celular. Resultados similares a los nuestros fueron obtenidos por Lobo, 2000 quien utilizando un medio de cultivo que contenía PPLO y suero equino en condiciones de agitación favoreció el crecimiento de M. pullorum obteniéndose un mejor comportamiento en cuanto a la velocidad de crecimiento y rendimientos de la biomasa, aspectos que se deben tener en cuenta a la hora de trabajar en el laboratorio con estos microorganismos. LIMITE DE DETECCIÓN Como resultado del límite de detección del ensayo, el mismo, fue capaz de detectarhasta 1 UFC/mL, resultados similares se describen por Poveda, 1998; Pérez, et al.,2009 y Asarnow et al., 2010 quienes señalan que los micoplasmas son microorganismos muy exigentes desde el punto de vista nutricional y sus requerimientos culturales son muy altos por tanto, en la medida que le sean suplementados o garantizadas estas condiciones en los medios de cultivos artificiales se podrán obtener resultados favorables en cuanto a la promoción de crecimiento de estos microorganismos ya que la célula tendrá todos los cofactores enzimáticos necesarios para el desarrollo de las funciones metabólicas básicas. En nuestro caso el medio de cultivo utilizado contiene como suplemento dextrosala cuales utilizada, según refiere Poveda, 1998, como fuente de energía mediante la vía glicolítica Embden-Meyerhof-Parnas para la de obtención de trifosfato de adenosina (ATP), que garantiza el crecimiento de micoplasmas, por otra parte se mantuvieron lascondicionesde atmósfera propia para su desarrollo en condiciones de cultivo in vitro relacionadacon5 - 10 % de CO2 y 90 - 95% de N2 en microaerofilia y pH entre 7,0 – 7,4 que favorecieron el crecimiento, permitiendo obtener los resultados antes mencionados y de esta forma ofrecer una seguridad en el diagnóstico de estos microorganismos. ESPECIFICIDAD Todas las cepas de micoplamas empleadas en este ensayo crecieron entre las 24 y 48 horas a 37 0C con atmósfera de microaerofilia (Gráfico 1), lo que se describe como característico para estas especies según Razin, 1999. Los resultados obtenidosratificaron la especificidad del medio Hayflick para micoplasmascoincidiendo con lo reportado en la Farmacopea Europea, 2007 y el Manual Bergey 2002,quienes recomiendan este medio parael cultivo de los micoplasmas que afectan los cultivos celulares, sueros y productos biofarmacéuticos puesto que propicia condicionesfisiológicas y pH adecuado para el crecimiento de estas especie. En relación al comportamiento de Staphylococcus aureus no se evidenció crecimiento en el medio. Este resultado se explica si tenemos en cuenta que el medio Hayflick posee dentro de sus componentes la penicilina, antibiótico que actúa sobre la síntesis de la pared celular lo que evita que crezcan bacterias Gram positivas, esto propicia condiciones favorables para el crecimiento de los micoplasmas ya que al carecer de pared celular no tiene efecto sobre el crecimiento de los mismos. Por otra parte el medio de cultivo fue suplementado, además, con acetato de talium que inhibe el crecimiento de bacterias Gram negativas (según lo refiere la Farmacopea Española, 2005), de esta manera se garantiza el crecimiento de los micoplasmas y se evitan contaminaciones bacterianas. Independiente de estos resultados debemos señalar que dentro del Sistema de Gestión de la Calidad (SGC), de MYCOLAB esta implementado un procedimiento normativo operacional, relacionado con el protocolo para el diagnóstico de micoplamas.En el mismo se hace referencia a que todas las muestra que entre al laboratorio antes de proceder a las técnicas de cultivo y la PCR para la detección de micoplasmas se le deberá realizar el procedimiento para el control bacteriológico, aquellas muestras que resulten positivas saldrán del sistema de diagnóstico de micoplasmas, contribuyendo con esto aun mejor desempeño del ensayo. PRECISIÓN La continua manipulación del medio durante la preparación, incrementa la probabilidad de contaminación y en algunos casos puede interferir en el crecimiento de los microorganismos. Teniendo en cuenta este criterio basamos los estudios repetibilidad y precisión intermedia en la evaluación del control de esterilidad y promoción del crecimiento. En nuestro estudio ninguno de los medios preparados bajo estos criterios presentó contaminación alguna. Estos medios funcionaron de manera óptima, y permitieron el crecimiento de la cepa control en un tiempo aproximado de 48 horas, lo cual está dentro del rango descrito por Pérez et al., 2009. Los estudios para comprobar la homogeneidad de varianza demostraron que no hubo diferencias significativas para una p?0.05 en el coeficiente de variación. Esto sugiere que cuando se cuenta con un SGC, que de soporte al sistema de diagnóstico y se toman las medidas necesarias, se puede reducir al mínimo la posibilidad de contaminación y lograr resultados reproducibles entre los analistas ya sea en el mismo día o en condiciones diferentes(día y operario). Conclusiones. A partir de los resultados obtenidos se debe utilizar como proveedor, para nuestro laboratorio, el medio Micoplasma base de la firma BIOCEN, el cualcuenta con una patente que avala sucomposición y calidad, otro parámetro evaluado fue la robustez el cual demostró que el métodode cultivo microbiológico para micoplasmas es robusto, pudiéndose aplicar cualquiera de las variantes del tiempo de conservación del suero equino, atemperatura de incubación de 370C±0,5conel medio de cultivo recomendado. Teniendo en cuenta estos resultados proponemos el empleo del medio Micoplasma Hayflick modificado (penicilina/acetato de talium) para el diagnóstico de micoplasmas en cultivos celulares, sueros y productos biotecnológico como parte del sistema de mejora de MYCOLAB. El método de cultivo microbiológico evaluado en este estudio cumple con los indicadores requeridos de desempeño en cuanto a robustez, límite de detección, especificidad y precisión por lo que posibilita brindar resultados confiables para los fines previstos a partir de la técnica validada. Por otra parte se recomienda ampliar estudios de validación de la PCR incorporando un control interno para detectar inhibidores del ensayo en diferentes matrices e incorporar en el sistema diagnóstico del laboratorio MYCOLAB el empleo de PCR múltiples para la identificación de especies de micoplasmas contaminantes. Agradecimientos. A Evelyn Lobo por ser mi compañera y guía durante toda la investigación, gracias una y mil veces por su apoyo infinito y ayuda incondicional, la admiro y le estaré eternamente agradecido, ya que no solo es una gran amiga, también es como una madre llegando en muchas ocasiones a llamarme Roxano, el hijo macho. A Arsenio y a Alejandrapor asesorarme todo el tiempo con tanta paciencia. A mis padres por ser mi ejemplo y guía, enseñándome día a día los grandes valores de la vida,sepan quevivo orgulloso de ustedes, por eso los QUIERO y los llevo siempre en mi CORAZÓN. A mi gran amor, Dailis por todo el cariño, comprensión, dedicación y confianza que me brinda cada día, ayudándome en los momentos más difíciles, estando siempre a mi lado, a mis padres que sin ellos este trabajo no fuese posible, a mi tía Migdo y Noe que siempre me brindaron su apoyo y a mi abuela Juana, que siempre me está dando su amor. Bibliografía. •Arismendi, S. N.;Carrillo, L. R.yAndrade,S. N. (2010): Mollicutes fitopatógenos transmitidos por insectos: interacciones y efectos en sus vectores.Agro Sur Vol. 38(2) 55-67. •Asarnow, D.;Warford,A.;Fernandez,L.;Hom, J.;Sandhu,G.; Candichoy,Z.; Luna,G.;Goldman,M.; Rarich,R. (2010): Validation and international regulatory experience for a mycoplasma touchdown PCR assay. Biologicals. 38; 224–231. • Barrell, R. C.; Benton, D. B.; Boyd, P. and Cole, S. (2002): The microbiology of drinking water-Part 3-Practices and procedures for laboratories in methods for the examination of waters and associated materials. Environment Agency, Washington DC, EEUU. •Baseman, J. B.; Cagle, M. K.;Herrera, J. E.;Rasmussen,C.;Baseman, J. G.; Shain, R. and Piper, J. M. (2004): Diagnostic Assessment of Mycoplasma genitalium inCulture-Positive Women. JOURNAL OF CLINICAL MICROBIOLOGY. Vol. 42, No. 1. p. 203–211. · British Pharmacopoeia Veterinary. (2004): Test for Absence of Mycoplasmas. Appendix XVI. B (Vet) 3. pp A17- A19. Chaudhry, R .; Tabassum, I.; Nisar, N.; Dhawan, B.; Broor, S. and Khare, S. (2004): Mycoplasma contamination in cell culture. En: Abstract Book of 15 th International Congress of the International Organization of Mycoplasmology (IOM). July 11-16, Georgia, Athens. pp: 88. · •Europpean Pharmacopeia 5.8 (2007): Mycoplasmas. Appendix 2.6.7. ·Europpean Pharmacopeia 5.8 (2010): Mycoplasmas. Appendix 2.6.7. ·Farmacopeia Española 5.8 (2005): Mycoplasmas. Appendix 2.6.7. ·Ferrer, M. (2005): Análisis de los proteomas de dos micoplasmas: Mycoplasma penetrans y Mycoplasma genitalium. Instituto de Biotecnología y Biomedicina, Universidad autónoma de Barcelona. http://www.tesisenxarxa.net/TESIS_UAB/AVAILABLE/TDX-1121106- 133429//mfn1de1.pdf . ·Hernández, O. B.;Méndez, D. del R.; Santana, B. R. G.;Falcón, Y. A.;Casado, I. H. yGaldós María del C. (2005):Plasma equino como sustituto del plasma humano en la identificación del Staphylococcus aureus en los laboratorios de microbiología.Rev Cubana Invest Biomed. Vol. 24(2): pp- 1-12. •Hernández, Yenney. (2005): Desarrollo de un Sistema de Diagnóstico para la detección de micoplasmas en cultivos celulares y productos biofarmacéuticos. Tesis de Diploma. CENSA. •Hernández, Yenney. (2007): Desarrollo de un Ensayo de PCRpara la detección de micoplasmas en cultivos celulares, suero s y productos biofarmacéuticos. Tesis en opción al grado de Máster en Microbiología Veterinaria. CENSA. · Lobo, Evelyn. y Martinez, A. (2000): Crecimiento de Mycoplasma pullorum en cultivos estáticos y en agitación. Rev. Salud Animal. Vol 22 (2):86-88. · Lobo, Evelyn. (2002): Presencia y patogenicidad de Mycoplasma pullorum en Cuba. Tesis en Opción al grado de Doctor en Ciencias Veterinarias. CENSA. ·Lobo, Evelyn. and Vega, A. (2004): Mycoplasmas in cell cultures. Rev.Salud Anim.; Vol. 26 No. 1: 3-6. ·Manual de obtención del antígeno (2002): Protocolos para la producción y estandarización de antígeno. Departamento de agricultura. Universidad de Georgia, Atlanta, USA. ·Manual of Systematic Bacteriology Bergey. (2002): http://www.bergeys.org. •Manual of Systematic Bacteriology Bergey. (2010)The Bacteroidetes , Spirochaetes, Tenericutes ( Mollicutes ), Acidobacteria , Fibrobacteres , Fusobacteria ,Dictyoglomi, Gemmatimonadetes, Lentisphaerae, Verrucomicrobia, Chlamydiae, and Planctomycetes. Brown, D.R., M. May, J.M. Bradbury, K.-E. Johansson and H. Neimark. 2nd edn, vol. 4, (edited by Krieg, Staley, Brown, Hedlund, Paster, Ward, Ludwig and Whitman). Springer, New York, pp. 574–644. • NC-ISO/IEC 9000:2005 . Sistemas de gestión de la calidad: Conceptos y vocabulario. Traducción certificada. •NC-ISO/IEC 17025: 2006. Requisitos generales para la competencia de los laboratorios de ensayo y de calibración. Mundial de Sanidad Animal (OIE) (2008a): Office International Des. Epizooties, 6 ta edi. Vol 1 pp: 3-590. Paris, France. · Organización • Organización Mundial de Sanidad Animal (OIE) (2008): Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases. Office International Des. Epizooties, Chapter 1.1.4. pp: 48-55. · Organización Mundial de la Salud (OMS) (2000): General requeriments for the sterility of biological substance. WHO Technical report Series. No. 872 Annex 3 pp. 69-74. • Organización Mundial de la Salud (OMS) (2010): Buenas prácticas de la OMS para laboratorios de control de calidad de productos farmacéuticos, Anexo 1.Serie de Informes Técnicos de la OMS, No. 957. Organización Panamericana de la Salud (OPS) (2000): General requeriments for the sterility of biological substances. WHO Technical report Series. N0. 373 pp: 70-76. · • Pérez,Iraní .;Villaroel, M.;Gómez, M. yRico,S. G. (2009): Evaluación de Medios de Cultivo para My •Pérez, Tania.; Sánchez, L.;Díaz, T.; Rosado, I.y Rodríguez,R. (2001): Aplicación del diseño experimental al estudio de un medio de cultivo para el crecimiento de Mycoplasma gallisepticum. Rev. Salud Animal. Vol 23 (2):80-83. •Poveda, J.B. (1998): Biochemical Characteristic in Mycoplasma identification. En: Methods in Molecular Biology. Vol. 104. Mycoplasma Protocols. Miles, R.J. y Nicholas, R.A. (eds). Humana Press. Inc., Totowa, New Jersey. pp: 69-79. • Razin, S.AND Cosenza, B.J. (1966): Growth Phases of Mycoplasma in Liquid Media Observed with Phase-Contrast Microscope. Journal of Bacteriology. Vol. 91, No. 2: 858-869. Razin, S.; Yogev, D. and Naot, Y. (1999): Molecular Biology and pathogenicity of mycoplasmas. Microbiol Mol Biol Rev 1998:1094–156. · •Regulación 41/2007: Validación de métodos analíticos. CECMED. pp: 1-27. • Regulación 16/2006: directrices sobre buenas prácticas para la fabricación de productos farmacéuticos. CECMED. pp:2-19. ·Rivera-Tapia, J. A.; Castillo, V.; Valeria, L. yHernández, S. J. A. (2010): Detección de micoplasmas en cultivos celulares. Rev.cienc. biomed;1 (2): 187 – 189. · Willby, Melisa J. and Krause, D. C. (2000): Insertional inactivation of the hmw3 gene of Mycoplasma pneumoniae. Proceedings of the 13th International Congress of IOM: 69. ·Zamora, Loidy. (2006): Evaluación de diferentes métodos de extracción de ADN para el diagnóstico de micoplasmas, mediante un ensayo de PCR. Tesis de Diploma. CENSA. REDVET: 2012, Vol. 13 Nº 11 Recibido 07.06.2012 /Ref. prov. JUN1236B_REDVET / Revisado 29.09.2012 Aceptado 28.10.2012 / Ref. def. 111217_REDVET / Publicado: 01.11.2012 Este artículo está disponible en http://www.veterinaria.org/revistas/redvet/n111112.html concretamente en http://www.veterinaria.org/revistas/redvet/n111112/111217.pdf REDVET® Revista Electrónica de Veterinaria está editada por VeterinariaOrganización®. Se autoriza la difusión y reenvío siempre que enlace con Veterinaria.org®http://www.veterinaria.org y con REDVET®http://www.veterinaria.org/revistas/redvet Autor Lozada Yoesley 1: 1MYCOLAB, Laboratorio para el diagnóstico de micoplasmas, Dirección de Microbiología, Centro Nacional de Sanidad Agropecuaria (CENSA) | Coautor 1: Lobo Evelyn 1:1 MYCOLAB, Laboratorio para el diagnóstico de micoplasmas, Dirección de Microbiología, Centro Nacional de Sanidad Agropecuaria (CENSA) | Coautor 2: Burgher Yaima 1:1MYCOLAB, Laboratorio para el diagnóstico de micoplasmas, Dirección de Microbiología, Centro Nacional de Sanidad Agropecuaria (CENSA) | Coautor 3: Duque Arianna 1:1MYCOLAB, Laboratorio para el diagnóstico de micoplasmas, Dirección de Microbiología, Centro Nacional de Sanidad Agropecuaria (CENSA) | Coautor 4: Martínez Siomara 2 : 2Grupo de Biología Molecular, Dirección de Microbiología, Centro Nacional de Sanidad Agropecuaria CENSA. Contactos: [email protected] y [email protected] Resumen diagnóstico por (Laboratorio agentes validación Por biofarmacéuticos la robustez, es un NC diagnóstico robusto, la lomicoplasmas Farmacopea ISO/IEC tanto, que límite y sensibles específico acreditación nos para incluye más 17025:2006.Para de propusimos de eldetección, Europea, rápido, aplicación diagnóstico yeste para confiables de confiable ensayo, micoplasmas, esta como 2007 especificidad biomédica de esto técnica para como objetivo pero micoplasmas) y se menos latécnica validó bajo detección para en capaz establecer y MYCOLAB precisión. costoso. un demostrar el ade Sistema (CM) emplear tiene de detectar un estas teniendo Como medianteel implementado diagnóstico de la para especies, hasta confiabilidad Gestión resultados elen diagnóstico 1micoplasmas cuenta ensayo confiable UFC/mL de En tal unla de tal es sistema de diferentes Calidad de sentido la elsueros yde los para cultivo validación caso con rutina resultados de (SGC) es una del parámetros microbiológico detección diagnóstico de cultivo alta del estos según precisión, CM resulta microbiológico de microorganismos. de se lapara micoplasmas NC validado desempeño comprobó imprescindible disponer lo la ISO/IEC que detección y(CM), permite de acreditado que en como 17025:2006. técnicas MYCOLAB productos el aprobada de lograr ensayo brindar fueron estos por de la Los partir contaminaciones, calidad del para desarrollo la fabricación infectan específicamente de la yfrecuentemente liberación biotecnología las de producidas estos los en cultivos Cuba, productos. por se celulares, hace necesario ,la como yimprescindible productos controlar parte de estrictamente biofarmecéuticos. los sistemas estas de A Sumario Mycoplasmas frequently infected cell cultures, serums andbiofarmeceutical products. With the development of biotechnology in Cuba, it is necessary to strictly control such pollution, specifically those caused by mycoplasma, as part of quality systems for the production and release of these products. Thus it is essential to have sensitive diagnostic techniques and reliable detection of these species, as in the case of microbiological culture (CM), adopted by the European Pharmacopoeia, 2007 as a technique to use for routine diagnosis of these organisms. MYCOLAB (Laboratory for diagnosis of mycoplasma) has implemented a system for the detection of these agents included in this trial, but to demonstrate the reliability of the results is essential to achieve the validation and accreditation of the technique under a Management System (QMS) according to the NC ISO/IEC 17025:2006. Therefore, we intended to establish a reliable diagnosis for the detection of mycoplasma in biopharmaceutical products MYCOLAB biomedical application by microbiological culture assay validated and accredited by the NC ISO/ IEC 17025:2006. To this was validated (CM) taking into account various performance parameters as they were robust, detection limit, specificity and accuracy. As a result of the validation of the CM was found that the assay is robust, specific for mycoplasma, can detect up to 1 CFU/mL and with high accuracy, allowing a diagnosis to provide faster, more reliable and less expensive. Artículo Introducción. La validación no es más que la confirmación mediante la aportación de evidencia objetiva de datos que respaldan la existencia o veracidad de algo, estos pueden obtenerse por medio de la observación, medición, ensayo/prueba u otros medios que han cumplido los requisitos para una utilización o aplicación específica prevista (NC ISO 9000:2005), similar concepto refiere la NC ISO/IEC 17025:2006 incluyendo la comparación con otro método de ensayo siendo esta una parte de la validación que se emplea para fines de comprobar la exactitud. Para validar los métodos se hace referencia a los parámetros a comprobar de acuerdo con las características de los ensayos cuantitativos o cualitativos de analitos mayoritarios o minoritarios en la muestra evaluada según lo refiere la REGULACIÓN No. 41-2007 del CECMED (Centro para el Control Estatal de Medicamentos, Equipos y Dispositivos Médicos), durante este proceso es posible identificar si la metodología nueva o modificada se acepta para su uso, en tanto demuestre equivalencia con el método de referencia, entendiéndose ésta como una diferencia no significativa en los resultados emitidos por ambos métodos, o se determine que el nuevo ensayo demuestra un comportamiento superior. Si en el proceso de validación el nuevo ensayo demuestra un recuento significativamente más bajo que el de referencia, se debe rechazar (Barrell et al., 2002). Teniendo presentes urogenital los et aquellos materias al., productos 2010) métodos primas en yenlas ycuenta un biotecnológicos por articulaciones derivados gran otra validados lonúmero parteél anterior biológicos que tanto de gran y garanticen conociendo aplicación enfermedades desarrollo del como hombre cultivos biomédica laelpapel de seguridad como infecciosas, la biotecnología, de patogénico de (Chaudhry células, de los productos, animales, pudiéndose sueros de et surge los al.,fetales, además los micoplasmas 2004; laencontrar cuales necesidad Ferrer, enzimas, dedentro infectar colonizando que de 2005; entre establecer de de las su Rivera-Tapia manera otros plantas, obtención los tractos (Hernández, sistemas indiscutible losutilizan et cultivos respiratorios, al., de2010;Arismendi calidad están 2007). como celulares paray Dentro de los sistemas de calidad la detección de contaminaciones biológicas juega un importante rol, de modo que las agencias reguladoras han establecido normas relacionadas con la detección de estas contaminaciones y entre ellas, específicamente, la detección de micoplasmas como prueba determinante para la liberación o no de productos biotecnológicos (Farmacopea Británica, 2004; Regulación 16:2006 CECMED; Farmacopea Europea, 2007), debido a los efectos indeseables que producen estos microorganismos en el individuo que recibe los productos contaminados, el error en la interpretación de un diagnóstico y en las alteraciones que inducen los micoplasmas en la actividad y funciones de la célula, relacionadas con la producción de severos eventos citopáticos, la inhibición de síntesis de carbohidratos, proteínas, ácidos nucleicos (Lobo y Vega, 2004; Rivera-Tapia et al.,2010). El Laboratorio de Diagnóstico de Micoplasmas, del CENSA (Centro Nacional de Sanidad Agropecuaria), cuenta entre los procedimientos utilizados para el diagnóstico de micoplasmas con el método de cultivo microbiológico el cual es utilizado por centros de referencias internacionales además de ser reconocida como la técnica de referencia en los documentos normativos relacionados con diagnóstico de micoplasmas en animales, cultivos celulares y productos biofarmacéuticos. En tal sentido la validación de este procedimiento en nuestro laboratorio nos pone al mismo nivel de los estos centros de referencias internacionales, además, de ser el único laboratorio del país que brinda el servicio de detección de micoplasmas a los diferentes productos o materias primas utilizadas tanto para investigaciones, producciones como componentes de diagnosticadores desarrollados por los diferentes centros del polo científico. Para el desarrollo del protocolo de validación se tuvo en cuenta lo referido en la REGULACIÓN No. 41-2007 del CECMED bajo un sistema de calidad regido por la norma NC ISO /IEC 17025:2006. MATERIALES Y MÉTODOS. Materialde Referencia Certificado (MRC), utilizado como controles positivos en elensayo Cultivo Microbiológico. Cepa de Mycoplasma arginini (M. arginini) NCTC 10129 1 : esta cepa se presenta como el contaminante más frecuente de cultivos celulares, sueros y productos biofarmacéuticos. Es la cepa tipo a emplear en los ensayos de cultivo microbiológico y PCR según lo recomendado por la Farmacopea Británica, 2004; Farmacopea Europea, 2007. Cepa de Mycoplasma orale(M. orale) NCTC 101121 Cepa de Acholeplasma laidlawii(A. laidlawii) NCTC 101161 Cepa de Mycoplasma hyorhinis (M. hyorhinis) NCTC 101301 Cepa de Mycoplasma fermentans,(M. fermentans)NCTC 101171 Cepa de Mycoplasma mycoides subsp. mycoides small colony biotype (MmmSC). ATCC 279481 Cepa de Mycoplasma mycoides subsp. mycoides large colony biotype (MmmLC). NCTC 101371 Cepa de Mycoplasma spp. Material de colección del laboratorio de Microbiología del Instituto Zooprofiláctico de Teramo, Italia. (Laboratoriode referencia de la OIE para el diagnóstico de la Pleuroneumonía contagiosa bovina). Desarrollo de la validación del método de cultivo microbiológico para el género Mycoplasma. Siembra de las cepas. La siembra de las cepas se realizó según lo descrito por Hayflick, 1965. Las cepas liofilizadas se resuspendieron en 1 mL de medio Micoplasma Hayflick líquido. Posteriormente se tomó 0.2 mL de cada una de las cepas y se sembró en medio Micoplasma Hayflick Agar. Se incubó a 370C en incubadora (Thermolyne) durante 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998. Estudio morfológico Las colonias fueron observadas a las 48 horas de incubación usando un microscopio óptico (Opton) de luz ordinaria bajo una magnificación de - 35 x. Se siguió como criterio de caracterización la formación de colonias pequeñas, entre 50 a 500 mm de diámetro y en forma de “huevo frito”,según lo descrito por Poveda, 1998. Cultivos de las cepas. El cultivo se realizó según lo descrito en el Manual de Obtención de Antígeno del Instituto de Investigaciones de la Universidad de Georgia, 2002. Se cortó un bloque de 1 cm2 de las placas crecidas y se sembraron en 5 mL de medio Hayflick líquido. Posteriormente se incubaron a 370C por 48 horas hasta que alcanzaron la fase exponencial de crecimiento con un pH entre 7.4-7.5 y una densidad óptica (DO 540nm) entre 0.2-0.4, medida en espectrofotómetro (Pharmacia). Se sembraron estos 5 mL de cultivo en 20 mL de medio Hayflick líquido, para un volumen final de 25 mL y se incubaron a 370C por 48 horas, hasta que alcanzó la DO y pH requeridos. Se realizó otro pase sembrando 10 mL de estos precultivos en 40 mL de medio, para un volumen final de 50 mL manteniendo las mismas condiciones de crecimiento. Por último, se tomaron 20 mL de los cultivos crecidos y se sembraron en 80 mL del medio en las mismas condiciones de crecimiento, para un volumen final de 100 mL. En cada pase, el cultivo de las cepas fue sembrado en Agar sangre para el control bacteriológico. Metodología de Validación. Teniendo en cuenta que este ensayo pertenece a la categoría de ensayo cualitativo, según la clasificación realizada por la Organización Internacional de Sanidad Animal (OIE) 2008 y la REGULACIÓN No. 41-2007 del CECMED , se tuvo presente la demostración de los siguientes parámetros: estudio de robustez, límite de detección, especificidad y precisión. ESTUDIOS DE ROBUSTEZ, LÍMITE DE DETECCIÓN, ESPECIFICIDAD Y PRECISIÓN DEL CULTIVO MICROBIOLÓGICO. Robustez En el estudio de robustez se evaluaron las siguientes variantes: - Diferentes rangos de temperaturas (330C, 350C; 370C y 390C) manteniendo una atmosfera de 5% CO2, - Diferentes seisy 12 meses). tiempos de conservación del suero equino para ser empleado como suplemento del medio de cultivo (tres meses, - Diferentes medios de micoplasma base Biopreparados, Cuba). PPLO-OXOID y Micoplasma Base Caldo- BIOCEN (Centro Nacional de Límite de detección. Se partió de un cultivo inicial de Mycoplasma arginini (NCTC 10129), con una concentración de 2x10 8 UFC/mL. S e realizaron diluciones seriadas en base a diez,desde 10 -1 hasta 10 -10 UFC/mL, las mismas fueron sembradas en placas con medio Hayflick e incubadas a 37 0 C por 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998. Todas las diluciones se trabajaron por triplicado. Especificidad. Para la determinación de este parámetro se utilizaron los siguientes cultivos de los MRC mencionadas anteriormente: - M. arginini,con una concentración de 2x108 UFC/mL - M. hyorhinis; con una concentración de 1.4 x108 UFC/mL - M. fermentans;con una concentración de 3,2x108 UFC/mL - M. orale con una concentración de 2.2x108UFC/mL - A. laidlawii, con una concentración de 1.7x108 UFC/mL -Staphylococcus aureus con una concentración de 2x108 UFC/mL,(ATCC 6538), donada gentilmente por Laboratorio de Microbiología, Dirección de Aseguramiento de la Calidad, CENSA. Los cultivos fueron sembrados en placas con medio Hayflick e incubadas a 370C por 48 horas en jarra con candil para favorecer las condiciones de microareofilia según lo descrito por Poveda, 1998.Todos los cultivos de las cepas se trabajaron por triplicado. Precisión La determinación de la precisión se realizó en dos niveles: intraensayo e interensayo relacionado con la elaboración del medio de cultivo, comprobando para cada caso la esterilidad y promoción delcrecimiento. - intraensayo(repetibilidad): elaboración del Medio de cultivo Hayflick por un mismo analista y bajo las mismas condiciones de trabajo en diferentes días, hastallegar a un total de 20 lotes con 15 placas cada uno. De ellas el 100% fueron sometidas a prueba de esterilidad y el 20% apromoción del crecimiento. - interensayo (precisión intermedia): realizado por dos (2) analistas, con las mismas condiciones, endías diferentes. En este estudio se mantuvo las mismas condiciones del análisis anterior para cada analista. Para el análisis estadístico de los resultados se utilizó la prueba t de student para comprobar la homogeneidad de varianza. RESULTADOS Y DISCUSIÓN. ENSAYOS RELACIONADOS CON EL CULTIVO PARA MICOPLASMAS. A pesar de los avances tecnológicos en el diagnóstico de los micoplasmas, el método de cultivo continúa siendo la técnica de referencia aprobada por las diferentes famacopeas (Farmacopeia Europea, acápite 2.6.7 y 2.6.16,2007 y 2010 y organismos reguladores como la OIE (Manual de la OIE, 2008), Organización Mundial de la Salud (OMS, 2000 y 2010) y la Organización Panamericana de la Salud (OPS, 2000). En la Figura 1 se observan los resultados obtenidos como parte del estudio morfológico utilizados en este ensayo. En todos los casos se puedo apreciar la conocida forma de “huevo frito” reportada como característica distintiva de los micoplasmas consistente en una región central granular oscura embebida en el agar y una zona traslúcida periférica alrededor de esta, lo cual coincide con lo reportado por Poveda, 1998 y aparece descrito en el Manual Bergey, del 2010. Los cultivos de estas cepaspresentaron el pH y DO requeridos según se refiere en el Manual de Obtención de Antígeno del Instituto de Investigaciones de la Universidad de Georgia, 2002, donde se señala que valores de pHentre 7.2 y 7.5 y una absorbancia entre 0.2 y 0.4 nm es lo recomendadoen un cultivo para ser utilizado en los ensayos de validación. Valores similares fueron obtenidos por Hernández, 2005 y Zamora, 2006 quienes señalan, además, que cuando un cultivo mantienesus propiedades morfológicas y bioquímicas estables y homogéneos, pueden ser utilizados en estudios de caracterización y posibilita la extracción de ADN de buena calidad. El análisis bacteriológico de estos cultivos resultó negativo, lo que demuestra que no presentaba contaminación bacteriana y que el crecimiento evidenciado se corresponde con las especies de micoplasmas y no con las conocidas formas L bacterianas ya que en subcultivos realizados todas las cepas de micoplasmas crecieron. Lo anterior tiene su explicación ya que en condiciones de incubación favorables o en las fases tempranas del cultivo (24 y 72 horas (hrs), las formas celulares esféricas de 0,3 µm de diámetro son las predominantes. Cuando las condiciones de incubación no son las óptimas o el cultivo ha envejecido, comienzan a aparecer formas cilíndricas (100 µm de largo yentre 0,3-0,4 µm de ancho), que contienen varios nucleoides similares a las formas L bacterianas. Estas estructuras fibrilares se fragmentan y dan origen a estructuras esféricas de 0,1 a 0,25 µm, denominadas “cuerpos elementales”, que carecen de viabilidad, según lo descrito por Razin y Concenza, 1966. Cuando estas estructuras son re-inoculadas en un medio fresco, no son capaces de crecer ni de multiplicarse criterios que sustentan los resultados obtenidos por nosotros. ESTUDIOS DE ROBUSTEZ, LIMITE DE DETECCIÓN, ESPECIFICIDAD Y PRECISIÓN DEL CULTIVO MICROBIOLÓGICO. Según lo establecido en la Farmacopeia Británica Veterinaria, 2004; Manual OIE, 2008 y Farmacopeia Europea, 2007 es necesario emplear material de referencia certificado en los estudios devalidación de cualquierensayo,ya que los mismos poseen todas sus propiedades bioquímicas y enzimáticas estables. El empleo de este material garantiza obtener resultados confiables y permite demostrar que realmente el ensayo empleado es útil para detectar el microorganismo deseado. De acuerdo a lo establecido en la Regulación 41/2007 del CECMED y la NC ISO/IEC 17025:2006, los métodos normalizados y estandarizados no requieren validación sino una evaluación de su desempeño. No obstante, para la introducción de los mismos cada laboratorio definirá sus criterios de evaluación caso a caso, tomando en consideración las características del método y la experiencia que se tenga en la caracterización del producto en cuestión. ROBUSTEZ Los resultados obtenidos en relación a las condiciones de incubación empleando diferentes rangos de temperaturas evidenciaron que en el caso de las variables de 330C, 350C y 390C no hubo crecimiento en ninguno de los medios utilizados, por el contrario si se observó crecimiento a 37ºC ±0,5 de temperatura. Esto se debe a que los micoplasmas son microorganismos mesófilos y necesitan este rango de temperatura para propiciar su crecimiento Poveda, 1998. Este resultadotambién coincide con lo reportado porBaseman et al., 2004,quienes obtuvieronde la región del cuello uterino y de la vagina 21 aislados de M. genitalium durante una investigación a 31 mujeres que presentaban uretritis no gonocócica al sembrar estos exudados en el medio SP-4 a 37ºC durante 21 días evidenciándose el cambio de pH. Se conoce que los micoplasmas carecen de las vías biosintéticas necesarias para la síntesis de ácidos grasos y precursores de los ácidos nucleicos ( Manual Bergey, 2002) , además de ser incapaces de sintetizar esteroles, es por ello que en su mayoría se presentan como parásitos de organismos eucarióticos, asociados a la membrana tanto de la célula como a la de los orgánulos citoplasmáticos ( Willby et al., 2000 ). Teniendo en cuenta estas características y para favorecer el crecimiento de estos microorganismos en medios artificiales se utiliza el suero equino como uno de los requerimientos nutricionales más relevante. En el estudio de los tiempos de conservación de tres, seis y doce meses del suero equino utilizado como suplemento, no se observó diferencia significativa entre los tres tiempos evaluados (Tabla 1), esto puede debersea que la conservación a-20ºCdel suero equino en estos intervalos de tiempo no afecta la calidad del colesterol favoreciendo el crecimiento de los micoplasmas. Estudios similares fueron llevados a cabo por Hernández et al., 2005 quienes confirman estadísticamente, la factibilidad que tiene el empleo del suero equino con respecto al empleo del suero humano para realizar la prueba de la coagulasa en tubo para la detección de Staphylococcus aureus por parte de los laboratorios microbiológicos y de poderobtener grandes volúmenes para su distribución a diferentes laboratorios, al mostrar ser muy estable a - 20 ºC por un período de 12 meses. El tercer parámetro evaluado en la robustez fue el empleo de dos tipos de medios de Micoplasma base procedente de dos casas comerciales, OXOID yBIOCEN. Además del suero equino utilizado como suplemento en el medio de cultivo y las condiciones de incubación, es importante conocer que a veces los componentes pueden ser tóxicos para los micoplasmas, según lo refiere Manual Bergey, 2002 recomienda el uso del Agar purificado o Agar Noble, que garantiza las condiciones óptimas de crecimiento en el medio de cultivo. Como resultado de este estudio se pudo evidenciar queno hubo diferencias en cuanto a los parámetros de control de esterilidad y promoción del crecimiento entre los medios analizados, comportándose de manera satisfactoria ambos medios de cultivo, estos resultados coinciden con los obtenidos por Pérez et al., 2001quienes aplicaron un diseño compuesto central para estudiar el medio de cultivo Mycoplasma base (Oxoid), enriquecido con extracto de levadura, suero equino y glucosa, para el crecimiento deM. gallisepticum en el cual demostró que una disminución de un 40% del medio Micoplasma base no influye negativamente en el rendimiento celular. Resultados similares a los nuestros fueron obtenidos por Lobo, 2000 quien utilizando un medio de cultivo que contenía PPLO y suero equino en condiciones de agitación favoreció el crecimiento de M. pullorum obteniéndose un mejor comportamiento en cuanto a la velocidad de crecimiento y rendimientos de la biomasa, aspectos que se deben tener en cuenta a la hora de trabajar en el laboratorio con estos microorganismos. LIMITE DE DETECCIÓN Como resultado del límite de detección del ensayo, el mismo, fue capaz de detectarhasta 1 UFC/mL, resultados similares se describen por Poveda, 1998; Pérez, et al.,2009 y Asarnow et al., 2010 quienes señalan que los micoplasmas son microorganismos muy exigentes desde el punto de vista nutricional y sus requerimientos culturales son muy altos por tanto, en la medida que le sean suplementados o garantizadas estas condiciones en los medios de cultivos artificiales se podrán obtener resultados favorables en cuanto a la promoción de crecimiento de estos microorganismos ya que la célula tendrá todos los cofactores enzimáticos necesarios para el desarrollo de las funciones metabólicas básicas. En nuestro caso el medio de cultivo utilizado contiene como suplemento dextrosala cuales utilizada, según refiere Poveda, 1998, como fuente de energía mediante la vía glicolítica Embden-Meyerhof-Parnas para la de obtención de trifosfato de adenosina (ATP), que garantiza el crecimiento de micoplasmas, por otra parte se mantuvieron lascondicionesde atmósfera propia para su desarrollo en condiciones de cultivo in vitro relacionadacon5 - 10 % de CO2 y 90 - 95% de N2 en microaerofilia y pH entre 7,0 – 7,4 que favorecieron el crecimiento, permitiendo obtener los resultados antes mencionados y de esta forma ofrecer una seguridad en el diagnóstico de estos microorganismos. ESPECIFICIDAD Todas las cepas de micoplamas empleadas en este ensayo crecieron entre las 24 y 48 horas a 37 0C con atmósfera de microaerofilia (Gráfico 1), lo que se describe como característico para estas especies según Razin, 1999. Los resultados obtenidosratificaron la especificidad del medio Hayflick para micoplasmascoincidiendo con lo reportado en la Farmacopea Europea, 2007 y el Manual Bergey 2002,quienes recomiendan este medio parael cultivo de los micoplasmas que afectan los cultivos celulares, sueros y productos biofarmacéuticos puesto que propicia condicionesfisiológicas y pH adecuado para el crecimiento de estas especie. En relación al comportamiento de Staphylococcus aureus no se evidenció crecimiento en el medio. Este resultado se explica si tenemos en cuenta que el medio Hayflick posee dentro de sus componentes la penicilina, antibiótico que actúa sobre la síntesis de la pared celular lo que evita que crezcan bacterias Gram positivas, esto propicia condiciones favorables para el crecimiento de los micoplasmas ya que al carecer de pared celular no tiene efecto sobre el crecimiento de los mismos. Por otra parte el medio de cultivo fue suplementado, además, con acetato de talium que inhibe el crecimiento de bacterias Gram negativas (según lo refiere la Farmacopea Española, 2005), de esta manera se garantiza el crecimiento de los micoplasmas y se evitan contaminaciones bacterianas. Independiente de estos resultados debemos señalar que dentro del Sistema de Gestión de la Calidad (SGC), de MYCOLAB esta implementado un procedimiento normativo operacional, relacionado con el protocolo para el diagnóstico de micoplamas.En el mismo se hace referencia a que todas las muestra que entre al laboratorio antes de proceder a las técnicas de cultivo y la PCR para la detección de micoplasmas se le deberá realizar el procedimiento para el control bacteriológico, aquellas muestras que resulten positivas saldrán del sistema de diagnóstico de micoplasmas, contribuyendo con esto aun mejor desempeño del ensayo. PRECISIÓN La continua manipulación del medio durante la preparación, incrementa la probabilidad de contaminación y en algunos casos puede interferir en el crecimiento de los microorganismos. Teniendo en cuenta este criterio basamos los estudios repetibilidad y precisión intermedia en la evaluación del control de esterilidad y promoción del crecimiento. En nuestro estudio ninguno de los medios preparados bajo estos criterios presentó contaminación alguna. Estos medios funcionaron de manera óptima, y permitieron el crecimiento de la cepa control en un tiempo aproximado de 48 horas, lo cual está dentro del rango descrito por Pérez et al., 2009. Los estudios para comprobar la homogeneidad de varianza demostraron que no hubo diferencias significativas para una p?0.05 en el coeficiente de variación. Esto sugiere que cuando se cuenta con un SGC, que de soporte al sistema de diagnóstico y se toman las medidas necesarias, se puede reducir al mínimo la posibilidad de contaminación y lograr resultados reproducibles entre los analistas ya sea en el mismo día o en condiciones diferentes(día y operario). Conclusiones. A partir de los resultados obtenidos se debe utilizar como proveedor, para nuestro laboratorio, el medio Micoplasma base de la firma BIOCEN, el cualcuenta con una patente que avala sucomposición y calidad, otro parámetro evaluado fue la robustez el cual demostró que el métodode cultivo microbiológico para micoplasmas es robusto, pudiéndose aplicar cualquiera de las variantes del tiempo de conservación del suero equino, atemperatura de incubación de 370C±0,5conel medio de cultivo recomendado. Teniendo en cuenta estos resultados proponemos el empleo del medio Micoplasma Hayflick modificado (penicilina/acetato de talium) para el diagnóstico de micoplasmas en cultivos celulares, sueros y productos biotecnológico como parte del sistema de mejora de MYCOLAB. El método de cultivo microbiológico evaluado en este estudio cumple con los indicadores requeridos de desempeño en cuanto a robustez, límite de detección, especificidad y precisión por lo que posibilita brindar resultados confiables para los fines previstos a partir de la técnica validada. Por otra parte se recomienda ampliar estudios de validación de la PCR incorporando un control interno para detectar inhibidores del ensayo en diferentes matrices e incorporar en el sistema diagnóstico del laboratorio MYCOLAB el empleo de PCR múltiples para la identificación de especies de micoplasmas contaminantes. Agradecimientos. A Evelyn Lobo por ser mi compañera y guía durante toda la investigación, gracias una y mil veces por su apoyo infinito y ayuda incondicional, la admiro y le estaré eternamente agradecido, ya que no solo es una gran amiga, también es como una madre llegando en muchas ocasiones a llamarme Roxano, el hijo macho. A Arsenio y a Alejandrapor asesorarme todo el tiempo con tanta paciencia. A mis padres por ser mi ejemplo y guía, enseñándome día a día los grandes valores de la vida,sepan quevivo orgulloso de ustedes, por eso los QUIERO y los llevo siempre en mi CORAZÓN. A mi gran amor, Dailis por todo el cariño, comprensión, dedicación y confianza que me brinda cada día, ayudándome en los momentos más difíciles, estando siempre a mi lado, a mis padres que sin ellos este trabajo no fuese posible, a mi tía Migdo y Noe que siempre me brindaron su apoyo y a mi abuela Juana, que siempre me está dando su amor. Bibliografía. •Arismendi, S. N.;Carrillo, L. R.yAndrade,S. N. (2010): Mollicutes fitopatógenos transmitidos por insectos: interacciones y efectos en sus vectores.Agro Sur Vol. 38(2) 55-67. •Asarnow, D.;Warford,A.;Fernandez,L.;Hom, J.;Sandhu,G.; Candichoy,Z.; Luna,G.;Goldman,M.; Rarich,R. (2010): Validation and international regulatory experience for a mycoplasma touchdown PCR assay. Biologicals. 38; 224–231. • Barrell, R. C.; Benton, D. B.; Boyd, P. and Cole, S. (2002): The microbiology of drinking water-Part 3-Practices and procedures for laboratories in methods for the examination of waters and associated materials. Environment Agency, Washington DC, EEUU. •Baseman, J. B.; Cagle, M. K.;Herrera, J. E.;Rasmussen,C.;Baseman, J. G.; Shain, R. and Piper, J. M. (2004): Diagnostic Assessment of Mycoplasma genitalium inCulture-Positive Women. JOURNAL OF CLINICAL MICROBIOLOGY. Vol. 42, No. 1. p. 203–211. · British Pharmacopoeia Veterinary. (2004): Test for Absence of Mycoplasmas. Appendix XVI. B (Vet) 3. pp A17- A19. Chaudhry, R .; Tabassum, I.; Nisar, N.; Dhawan, B.; Broor, S. and Khare, S. (2004): Mycoplasma contamination in cell culture. En: Abstract Book of 15 th International Congress of the International Organization of Mycoplasmology (IOM). July 11-16, Georgia, Athens. pp: 88. · •Europpean Pharmacopeia 5.8 (2007): Mycoplasmas. Appendix 2.6.7. ·Europpean Pharmacopeia 5.8 (2010): Mycoplasmas. Appendix 2.6.7. ·Farmacopeia Española 5.8 (2005): Mycoplasmas. Appendix 2.6.7. ·Ferrer, M. (2005): Análisis de los proteomas de dos micoplasmas: Mycoplasma penetrans y Mycoplasma genitalium. Instituto de Biotecnología y Biomedicina, Universidad autónoma de Barcelona. http://www.tesisenxarxa.net/TESIS_UAB/AVAILABLE/TDX-1121106- 133429//mfn1de1.pdf . ·Hernández, O. B.;Méndez, D. del R.; Santana, B. R. G.;Falcón, Y. A.;Casado, I. H. yGaldós María del C. (2005):Plasma equino como sustituto del plasma humano en la identificación del Staphylococcus aureus en los laboratorios de microbiología.Rev Cubana Invest Biomed. Vol. 24(2): pp- 1-12. •Hernández, Yenney. (2005): Desarrollo de un Sistema de Diagnóstico para la detección de micoplasmas en cultivos celulares y productos biofarmacéuticos. Tesis de Diploma. CENSA. •Hernández, Yenney. (2007): Desarrollo de un Ensayo de PCRpara la detección de micoplasmas en cultivos celulares, suero s y productos biofarmacéuticos. Tesis en opción al grado de Máster en Microbiología Veterinaria. CENSA. · Lobo, Evelyn. y Martinez, A. (2000): Crecimiento de Mycoplasma pullorum en cultivos estáticos y en agitación. Rev. Salud Animal. Vol 22 (2):86-88. · Lobo, Evelyn. (2002): Presencia y patogenicidad de Mycoplasma pullorum en Cuba. Tesis en Opción al grado de Doctor en Ciencias Veterinarias. CENSA. ·Lobo, Evelyn. and Vega, A. (2004): Mycoplasmas in cell cultures. Rev.Salud Anim.; Vol. 26 No. 1: 3-6. ·Manual de obtención del antígeno (2002): Protocolos para la producción y estandarización de antígeno. Departamento de agricultura. Universidad de Georgia, Atlanta, USA. ·Manual of Systematic Bacteriology Bergey. (2002): http://www.bergeys.org. •Manual of Systematic Bacteriology Bergey. (2010)The Bacteroidetes , Spirochaetes, Tenericutes ( Mollicutes ), Acidobacteria , Fibrobacteres , Fusobacteria ,Dictyoglomi, Gemmatimonadetes, Lentisphaerae, Verrucomicrobia, Chlamydiae, and Planctomycetes. Brown, D.R., M. May, J.M. Bradbury, K.-E. Johansson and H. Neimark. 2nd edn, vol. 4, (edited by Krieg, Staley, Brown, Hedlund, Paster, Ward, Ludwig and Whitman). Springer, New York, pp. 574–644. • NC-ISO/IEC 9000:2005 . Sistemas de gestión de la calidad: Conceptos y vocabulario. Traducción certificada. •NC-ISO/IEC 17025: 2006. Requisitos generales para la competencia de los laboratorios de ensayo y de calibración. Mundial de Sanidad Animal (OIE) (2008a): Office International Des. Epizooties, 6 ta edi. Vol 1 pp: 3-590. Paris, France. · Organización • Organización Mundial de Sanidad Animal (OIE) (2008): Validation and quality control of polymerase chain reaction methods used for the diagnosis of infectious diseases. Office International Des. Epizooties, Chapter 1.1.4. pp: 48-55. · Organización Mundial de la Salud (OMS) (2000): General requeriments for the sterility of biological substance. WHO Technical report Series. No. 872 Annex 3 pp. 69-74. • Organización Mundial de la Salud (OMS) (2010): Buenas prácticas de la OMS para laboratorios de control de calidad de productos farmacéuticos, Anexo 1.Serie de Informes Técnicos de la OMS, No. 957. Organización Panamericana de la Salud (OPS) (2000): General requeriments for the sterility of biological substances. WHO Technical report Series. N0. 373 pp: 70-76. · • Pérez,Iraní .;Villaroel, M.;Gómez, M. yRico,S. G. (2009): Evaluación de Medios de Cultivo para My •Pérez, Tania.; Sánchez, L.;Díaz, T.; Rosado, I.y Rodríguez,R. (2001): Aplicación del diseño experimental al estudio de un medio de cultivo para el crecimiento de Mycoplasma gallisepticum. Rev. Salud Animal. Vol 23 (2):80-83. •Poveda, J.B. (1998): Biochemical Characteristic in Mycoplasma identification. En: Methods in Molecular Biology. Vol. 104. Mycoplasma Protocols. Miles, R.J. y Nicholas, R.A. (eds). Humana Press. Inc., Totowa, New Jersey. pp: 69-79. • Razin, S.AND Cosenza, B.J. (1966): Growth Phases of Mycoplasma in Liquid Media Observed with Phase-Contrast Microscope. Journal of Bacteriology. Vol. 91, No. 2: 858-869. Razin, S.; Yogev, D. and Naot, Y. (1999): Molecular Biology and pathogenicity of mycoplasmas. Microbiol Mol Biol Rev 1998:1094–156. · •Regulación 41/2007: Validación de métodos analíticos. CECMED. pp: 1-27. • Regulación 16/2006: directrices sobre buenas prácticas para la fabricación de productos farmacéuticos. CECMED. pp:2-19. ·Rivera-Tapia, J. A.; Castillo, V.; Valeria, L. yHernández, S. J. A. (2010): Detección de micoplasmas en cultivos celulares. Rev.cienc. biomed;1 (2): 187 – 189. · Willby, Melisa J. and Krause, D. C. (2000): Insertional inactivation of the hmw3 gene of Mycoplasma pneumoniae. Proceedings of the 13th International Congress of IOM: 69. ·Zamora, Loidy. (2006): Evaluación de diferentes métodos de extracción de ADN para el diagnóstico de micoplasmas, mediante un ensayo de PCR. Tesis de Diploma. CENSA. REDVET: 2012, Vol. 13 Nº 11 Recibido 07.06.2012 /Ref. prov. JUN1236B_REDVET / Revisado 29.09.2012 Aceptado 28.10.2012 / Ref. def. 111217_REDVET / Publicado: 01.11.2012 Este artículo está disponible en http://www.veterinaria.org/revistas/redvet/n111112.html concretamente en http://www.veterinaria.org/revistas/redvet/n111112/111217.pdf REDVET® Revista Electrónica de Veterinaria está editada por VeterinariaOrganización®. Se autoriza la difusión y reenvío siempre que enlace con Veterinaria.org®http://www.veterinaria.org y con REDVET®http://www.veterinaria.org/revistas/redvet Palabras clave validación, prueba cualitativa, micoplasmas, cultivo. validation , qualitative test, mycoplasmas, culture.