“OBTENCIÓN DE DERIVADOS SOLUBLES EN AGUA DE LA
Anuncio

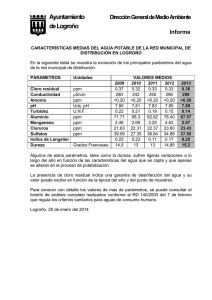
“OBTENCIÓN DE DERIVADOS DE QUITOSANA SOLUBLES EN AGUA Y SU APLICACIÓN EN PROCESOS DE COAGULACIÓN-FLOCULACIÓN”. Nely Ríos Donato1, Ricardo Navarro Mendoza1*, Mario Ávila Rodríguez1, Eduardo Mendizábal Mijares2 1) Instituto de Investigaciones Científicas. Universidad de Guanajuato. Cerro de la venada s/n, Pueblito de Rocha, Guanajuato, Guanajuato. Correo electrónico : * navarrm@quijote,ugto.mx 2) Centro Universitario de Ciencias Exactas e Ingeniería. Universidad de Guadalajara, México. INTRODUCCIÓN El tratamiento de aguas naturales, así como el de efluentes industriales cobra cada vez mayor importancia debido a los problemas ambientales provocados por la generación masiva de aguas con altos contenidos de materiales contaminantes. Así por ejemplo, tenemos que las aguas naturales contienen sólidos de diversos tamaños. Los sólidos son transportados gracias a la acción de arrastre y soporte del movimiento del agua. Algunos de ellos es posible separarlos mediante sedimentación, pero los más pequeños no se sedimentan rápidamente y causan problemas de olor, sabor, color y de salud, por lo que deben ser removidos [1]. Los cooides son sólidos pequeños con cargas eléctricas distribuidas sobre su superficie, de manera que se repelen fuertemente inhibiendo toda aglomeración [2]. Para separar estos sólidos del agua se utiliza generalmente un tratamiento llamado coagulación-floculación [3-5]. La coagulación consiste en introducir al agua una sustancia capaz de neutralizar la carga eléctrica superficial del coloide, a la cual le sigue la floculación, que es la agrupación de las partículas descargadas que se ponen en contacto unas con otras para formar un aglomerado llamado flóculo, cuyo tamaño y densidad permite su precipitación [6]. En los tratamientos de agua convencionales, el aluminio ha sido el coagulante más usado por su fácil manejo, su bajo costo y su facilidad para conseguirlo. Sin embargo, existen inconvenientes: al utilizar sales de aluminio, además de producirse grandes cantidades de sedimento, los altos niveles de aluminio remanentes en las aguas tratadas ponen en riesgo la salud pública ya que estas sales pueden ser causantes del síndrome de Alzheimer [7]. Una alternativa para disminuir el uso de sales inorgánicas son los floculantes orgánicos conocidos como polielectrolitos, los cuales pueden ser sínteticos o naturales. La quitosana (Q) es un polímero de origen natural, el cual puede ser obtenido a partir de la cáscara del camarón, es biodegradable, no tóxico y ha sido utilizado en la coagulación de sólidos suspendidos en soluciones de procesos alimenticios [8]. La quitosana es insoluble en agua bajo condiciones normales, pero puede disolverse en soluciones ácidas, en las cuales el ácido acético es el solvente más común [9-11]. Desde que se descubrió que la quitosana es efectiva en la coagulación-floculación sin ninguna desventaja conocida, se están realizando estudios para utilizarlos como un sustituto de los productos sintéticos [11]. En este trabajo se modificó químicamente la quitosana para incrementar su solubilidad, obteniendose el sulfato de quitosana (SQ) y la carboxiquitosana (CQ) y éstos se aplicaron al tratamiento de suspensiones de arcillas (caolinita) con buenos resultados. EXPERIMENTACIÓN Y RESULTADOS Debido a que la quitosana se presenta físicamente en forma de hojuelas rígidas y compactas, primeramente se aplicó un pretratamiento a la quitosana con la finalidad de provocar una expansión de la estructura molecular del polímero y permitir el acceso de los reactivos a los grupos funcionales internos y que la reacción pueda llevarse a cabo en todo el material y no solo en superficie. Este pretratamiento consiste básicamente en disolver la quitosana en medio ácido y luego precipitarlo en medio alcalino en forma de gel. Después se realiza una serie de lavados con agua. Posteriormente, el agua se sustituye gradualmente con metanol y luego con dimetilformamida (DMF), para obtener un gel de quitosana impregnada con DMF o solución al 5% de DMF (V/V en agua) según sea el caso. Enseguida fueron realizadas las siguientes modificaciones químicas: 1) Obtención del sulfato de quitosana (SQ) ( Figura 1) [12]. Figura 1. Reacción de sulfonación de la quitosana. Para obtener este producto, primeramente se hizo reaccionar DMF con HClSO3 para formar un complejo en forma de sal, que enseguida fue disuelto en tolueno. Posteriormente fue agregada la preparación de quitosana/DMF, dejando reaccionar por 2 hrs. Después de lo cual fue separado el producto y lavado varias veces con metanol, enseguida fue disuelto en agua para su purificación por medio de ultrafiltración (UF) y luego secado obteniéndose un producto sólido color ámbar. 2) Obtención de la carboxiquitosana (CQ) (Figura 2) [13]. Figura 2. Reacción de la quitosana en la obtención de la carboxiquitosana. Para este segundo producto, en la etapa 1 (ftaloilación) se hizo reaccionar la quitosana/soln. DMF con anhídrido ftálico/solución de DMF al 5% a una temperatura de 95ºC durante 6 horas. La mezcla reaccionante enseguida fue enfriada y puesta en agua fría, el precipitado fue separado y lavado varias veces con metanol y luego secado a 45ºC. En la etapa 2 (tosilación) el producto obtenido de la etapa 1 fue puesto en piridina y agitado por 1.5 horas, luego fue colocado en un baño de hielo y se agregó cloruro de tosilo disuelto en cloroformo y se hizo reaccionar a 0ºC durante 2 horas. Enseguida la temperatura fue aumentada a 18ºC, el producto fue lavado con agua y luego con metanol y se secó a 45ºC. En la etapa 3 (cianuración) el producto obtenido en la etapa 2 fue disuelto en dimetilsulfóxido (DMSO) y se hizo reaccionar con cianuro de sodio también disuelto en DMSO a una temperatura de 110ºC. El producto fue enfriado, dializado y concentrado. La etapa 4 (hidrólisis) consistió en reaccionar el producto obtenido en la etapa 3 con hidróxido de potasio y etanol. Se elevó la temperatura hasta reflujo, por unas horas y luego enfriado el producto fue dializado y secado a 45ºC, obteniéndose un producto sólido color ámbar (carboxiquitosana). Los dos compuestos obtenidos (SQ y CQ) fueron solubles en agua y fueron caracterizados por medio de técnicas de FTIR, RMN, análisis elemental y titulación potenciométrica. De acuerdo a los resultados obtenidos se pudo deducir que las condiciones de las síntesis afectan significativamente el grado de sustitución, lo cual determina las propiedades de solubilidad y su eficiencia en los procesos de coagulaciónfloculación. La Q, el SQ y la CQ se utilizaron para los experimentos de coagulación-floculación de caolinita (1 g/L) como se describe a continuación: En un equipo para prueba de jarras (Phipps & Bird modelo PB-700) fueron realizadas las pruebas de coagulación-floculación, utilizando para este fin un volumen de 1 L de suspensión coloidal en cada jarra, al cual se le agregó la cantidad necesaria de la solución de polielectrolito (Q, SQ o CQ) para obtener la concentración deseada. Después de agregar el polielectrolito, se aplicó una agitación rápida (3 minutos a 200 rpm) y enseguida una agitación lenta (30 minutos a 30 rpm). Posteriormente, se suspendió la agitación, iniciando la etapa de sedimentación. Se colectaron muestras a diferentes tiempos y a partir de las medidas de absorbancia a 350 nm, se determinó la turbiedez en NTU (unidades nefrelometricas de turbidez) y se graficaron los resultados en función del tiempo de sedimentación, pH y concentración de polielectrolito. En la Figura 3 se comparan los resultados obtenidos con suspensiones de 1.0 g/L de caolinita para diferentes valores de pH y diferentes concentraciones de SQ en función del tiempo de sedimentación. Los resultados obtenidos para los blancos (suspensiones en ausencia de SQ), muestran que las suspensiones son muy estables a valores de pH superiores a 3, de manera que la turbidez se mantiene prácticamente constante durante todo el tiempo de sedimentación y aumenta con el pH. A medida que el pH disminuye, la cantidad de caolinita suspendida (medida en unidades NTU) es menor, ya que en medios ácidos disminuye la carga de la caolinita, debido a la cercanía del punto isoeléctrico, dando lugar a la floculación. Sin embargo, no toda la caolinita es precipitada naturalmente. A pH 4, la turbidez inicial es muy elevada (aproximadamente 130 NTU) y disminuye rápidamente por efecto de la adición de SQ, pero en este caso, la turbidez disminuye gradualmente con la concentración de SQ. A valores de pH mayores (4.5 y 5), la turbidez inicialse incrementa aún más (500 NTU) y el SQ muestra un efecto mucho mayor, para todas las concentraciones estudiadas, mostrando una eliminación de la urbidez practicamente total desde los primeros dos minutos pH 4 pH 3 45 120 35 Turbidez (NTU) Turbidez (NTU) 40 30 25 20 15 10 100 80 60 40 20 5 0 0 0 10 20 30 40 50 0 60 10 20 40 50 60 tiempo de sedimentación (min) tiempo de sedimentación (min) pH 5 pH 4.5 600 Turbidez (NTU) 600 Turbidez (NTU) 30 500 400 300 200 100 500 400 300 200 100 0 0 0 10 20 30 40 50 60 tiempo de sedimentación (min) 0 10 20 30 40 50 60 tiempo de sedimentación (min) Figura 3. Comparación de la eficiencia de remoción de caolinita (1.0 g/L) como función del tiempo y del pH para diferentes concentraciones de SQ. Blanco (); 2 ppm (■), 4 ppm (▲), 6 ppm (x), 8 ppm (*), 10 ppm (●). En la Figura 4, se muestra la turbidez de suspensiones de caolinita de 1.0 g/L, después de 20 minutos de sedimentación, en función del pH, para diferentes concentraciones de SQ y Q. En estas curvas se hace evidente el efecto del pH en la estabilización de las suspensiones. También se observa que el mayor efecto del SQ se presenta a pH 4.5-5, logrando una disminución significativa de la turbidez. Este efecto es independiente de la concentración de SQ. A valores de pH de 5.5 y 6, el SQ presenta un efecto menor en la turbidez. En cambio cuando es utilizada la quitosana se observa que a altas concentraciones (10, 8 y 6 ppm) la suspensión permanece estable (no hay precipitación de las partículas de caolinita), obteniéndose curvas similares al blanco, en todo el dominio de pH estudiado. Para bajas concentraciones de quitosana (4 y 2 ppm), tampoco hay diferencia respecto al blanco a pH 3 y 4. Sin embargo, se observa buena remoción de la caolinita a pH 5 y 6. Con concentraciones menores de quitosana (1.0 y 0.8 ppm) se obtuvieron curvas (no mostradas) prácticamente idénticas a las obtenidas con 2 ppm. SQ Turbidez (NTU) 600 500 400 300 200 100 0 2 3 4 5 6 7 5 6 7 pH Q Turbidez (NTU) 600 500 400 300 200 100 0 2 3 4 pH Figura 4. Remoción de caolinita (1.0 g/L) con SQ y Q. Efecto del pH y de la concentración del polielectrolito. Blanco (); 2 ppm (■); 4 ppm (▲); 6 ppm (x); 8 ppm (*); 10 ppm (●). Tiempo de sedimentación: 20 minutos. En la figura 5 se muestran los resultados obtenidos para el CQ en donde el pH óptimo de remoción de partículas también está entre 4.5-5, disminuyendo su efectividad a valores de pH más altos. Cabe señalar que se usaron concentraciones menores de CQ (1-5 ppm) que para las pruebas de SQ y Q (2-10 ppm). Al comparar las Figuras 4 y 5, se observa que la eficiencia de remoción de caolinita, es mejor para SQ seguido de la Q y finalmente la CQ. También se observó que en el caso de la Q, el tiempo de sedimentación requerido (10 min.) es mayor que en el caso del SQ y del CQ (2 min.) . CQ Turbidez (NTU) 600 500 400 300 200 100 0 2 3 4 5 6 7 pH Figura 5. Remoción de caolinita (1.0 g/L) con CQ. Efecto del pH y de la concentración del polielectrolito. Blanco (); 1 ppm (■); 2 ppm (▲); 3 ppm (x); 4 ppm (*); 5 ppm (●). Tiempo de sedimentación: 20 minutos. CONCLUSIONES Se obtuvieron dos derivados de quitosana solubles en agua (SQ y CQ) los cuales mostraron ser efectivos para el proceso de coagulación-floculación de suspensiones coloidales de caolinita. El sulfato de quitosana y la carboxiquitosana demostraron una buena eficiencia en la remoción de partículas coloidales de caolinita a valores de pH bajos (4.5-5). Esta eficiencia es mayor que la de la quitosana a esos mismos valores de pH. Además el tiempo necesario para la sedimentación es muy corto (2 min.). BIBLIOGRAFÍA 1. J. A. Romero Rojas. CALIDAD DEL AGUA, 2° Edición, Editorial Alfaomega. México, 1999,167-179. 2. American Water Works Association, WATER QUALITY AND TREATMENT, 2° Edición, Editorial McGraw Hill, Madrid, 1975, 82-112. 3. A. Amirtharajah, C. R. O´Melia. WATER QUALITY AND TREATMENT: A HANDBOOK OF COMMUNITY WATER SUPPLIES/ AMERICAN WORKS ASSOCIATION, 4° Edition, Editorial McGraw Hill, USA, 1990, 278-302. 4. S.H. Maron, C.F. Prutton. FUNDAMENTOS DE FÍSICO QUÍMICA, Editorial Limusa, México, 1989, 849-879. 5. M. Rigola Lapeña. TRATAMIENTO DE AGUAS INDUSTRIALES, 1° Edición, Editorial Alfaomega, Colombia, 1999, 40-49. 6. A. Rushton, A.S. Ward. R.G. Holdich. SOLID-LIQUID FILTRATION AND SEPARATION TECHNOLOGY, 2° Edition, Editorial Wiley-VCH, Germany 2000, 182-190. 7. D. R. C. McLauchlan. Environmetrics, 6, 233-275 (1995). 8. E. Khor. CHITIN FULFILLING A BIOMATERIALS PROMISE, Elsevier. Amsterdam, 73-100, ( 2001). 9. A. Toffey, G.Samaranayake, C. E. Frazier and W. G. Glasser. Journal of Applied Polymer Science, 60, 7585 (1996). 10. R. Divakaran, V.N. Sivasankara. Water Research, 36, 2414-2418 (2002). 11. Lares Velásquez ALGUNOS USOS DEL QUITOSANO EN SISTEMAS ACUOSOS. Revista Iberoamericana de Polímeros 4 (2), 91-109, (2003). 12. C. Huang, S. Chen, H. Ruhsing Pan. Water Research, 34, 1057-1062 (2000). 13. K Kurita., H Yoshino., K Yokota.. Macromolecules, 25, 3786-3790 (1992).