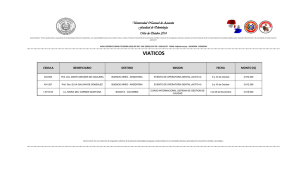
6alban.pdf
Anuncio

UNIVERSIDAD DE GUAYAQUIL FACULTAD PILOTO DE ODONTOLOGIA TRABAJO DE GRADUACION Previo a la obtención del título de ODONTOLOGA TEMA: Incisivo superior lateral derecho con lesión periapical AUTORA: Susana Denisse Albán Regato TUTOR: Dra. Dolores Sotomayor Guayaquil, Abril 201 1 CERTIFICACION DE TUTORES En calidad de tutor del trabajo de graduación: Nombrados por el honorable consejo de Directivo de la Facultad Piloto de Odontología de la Universidad de Guayaquil. CERTIFICAMOS Que hemos analizado el trabajo de graduación como requisito previo para optar por el titulo de tercer nivel de Odontóloga. El trabajo de graduación se refiere a: Incisivo superior lateral derecho con lesión periapical Presentado por: Susana Denisse Albán Regato 0992246063-9 Apellidos y Nombres Cedula de Ciudadanía Tutores: ____________________ ____________________ Dra. Dolores Sotomayor Metodológico Académico _____________________ Washington Escudero Decano Guayaquil, abril 2011 2 AUTORIA Las opiniones, criterios conceptos y análisis vertidos en el presente trabajo de graduación son de exclusiva responsabilidad de la autora. Susana Denisse Albán Rega 3 AGRADECIMIENTO En primer lugar mi mayor agradecimiento es hacia Dios, quien siempre me ha bendecido, guiado, alentado y fortalecido para poder logar las metas que me he propuesto en mi vida, como la que estoy cumpliendo ahora al culminar mi carrera como profesional. De igual forma quiero agradecerles a mis padres que siempre han estado junto a mí apoyándome incondicionalmente en todos los momentos de mi vida, sobre todo en el invalorable apoyo que es la crianza de mi hijo. Es propicio el momento para también agradecer a mis profesores por sus conocimientos entregados a mí y a mis compañeros, sembrando en nosotros el mejor de los criterios para tomar en el momento oportuno la mejor decisión. 4 DEDICATORIA Dedico este logro a Dios, puesto que el quiso que esto fuera posible… Dedico este libro a la persona más importante de mi vida, mi hijo Benjamín Francisco. Por él y para él todo mi esfuerzo Te amo Benja… De igual manera dedico esta meta alcanzada a mis padres Francisco Albán y Susana Regato, que por sus esfuerzos hoy estarán más orgullosos de mí… Y así también a mis abuelos que han contribuido en todo momento con su cariño, sus experiencias y su apoyo Marcos Regato., Mary Arrata. Y Lorgia Zúñiga… 5 INDICE CARATULA CERTIFICADO DE TUTORES AUTORIA AGRADECIMIENTOS DEDICATORIA INTRODUCCION . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1 OBJETIVO GENERAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2 OBJETIVO ESPECIFICO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3 CAPITULO 1 FUNAMENTACION TEORICA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4 1. ANATOMIA DENTARIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.1 DIENTE . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2 PARTES DEL DIENTE . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.1 ESMALTE DENTAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 5 1.2.2 DENTINA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.3 CEMENTO DENTAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.2.4 PULPA DEMTAL. . . . . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . 1.3 ESTRUCTURA DE SOPORTE DEL DIENTE . . . . . . . . . . . . . . . . . . 1.3.1 ENCIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6 6 1.3.2 LIGAMENTO PERIODONTAL .. . . . . . . . . . . . . . . . . . . . . . . . 1.3.3 HUESO ALVEOLAR . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.4 ESTRUCTURA MORFOLOGICA . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.4.1 CORONA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.4.2 CUELLO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 1.4.3 RAIZ . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5 INCISIVO LATERAL SUPERIOR DERECHO . . . . . . . . . . . . . . . . . 1.5.1 MEDIDAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5.2 CARA VESTIBULAR. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 1.5.3 CARA LINGUAL. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5.4 CARA MESIAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5.5 CARA DISTAL. . . . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . 1.5.6 CARA INSISAL. . . . . . . . . . . . . . . . . .. . . . . . . . . . . . . . . . . 1.5.7 FORMA. . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.5.8 RAIZ. . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 9 1.5.9 FUNCION. . . . . . . .. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 1.6 MORFOLOGIA DE LA CAVIDAD PULPAR. . . . . . . . . . . . . . . . . . . 1.6.1 CAMARA PULPAR. ... . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 10 1.6.2 CONDUCTO RADICULAR. . . . . . . . . . . . . . . . . . . . . . . . . . . CAPITULO 2 EMBRIOLOGIA PULPAR. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.1 GENERALIDADES. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7 12 2.2 ETAPAS DEL DESARROLLO. . . . . . . . . . . . . . . . . . . . . . . . . . . . . 14 2.3 ETAPA DE BOTON , BROTE O YEMA. . . . . . . . . . . ... . . . . . . . . . 2.4 ETAPA DE CAQUETE O SOMBRERO. . . . . . . . . . . . . . . . . . . . . . 2.5 ETAPA DE CAMPANA. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 15 2.6 DESARROLLO DE LAS ESTRUCTURAS RADICULARES. . . . . . . 2.7 IMPORATNCIA EN LA CLINICA ENDODONTICA DEL DESARROLLO DENTARIO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 17 2.8 CONDUCTOS LATERALES Y FORAMENES ACCESORIOS. . . . . 18 2.9 ANOMALIAS EN EL DESARROLLO DENTAL. . . . . . . . . . . . . . . . . 2.9.1 NEOPLASIAS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.9.2 INFECCIONES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.9.3 TRAUMATISMOS. . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 19 2.9.4 TRASTORNOS NUTRICIONALES . . . . . . . . . . . . . . . . . . . . . . 2.9.5 DEFECTOS CONGENITOS . . . . . . . . . . . . . . . . . . . . . . . . . . . 2.10 EFECTOS DE MEDICAMENTOS . . . . . . . . . . . . . . . . . . . . . . . 20 CAPITULO 3 NECROSIS PULPAR 3.1 DEFINICION . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 21 3.2 TIPOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.3 ETIOLOGIOA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 22 3.4 HISTOPATOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.5 MICROBIOLOGIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 8 23 3.6 SINTOMAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.7 DIAGNOSTICO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 3.8 TRATAMIENTO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 24 3.9 PRONOSTICO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . CAPITULO 4 ANESTACIA LOCAL PARA ENDODONCIA 4.1 GENERALIDADES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 25 4.2 ACCION DE LAS SOLUCION ANESTISICA . . . . . . . . . . . . . . . . . . . 26 4.3 ANESTESIA POR INFILTRACION O SUPRAPERIOSTICA . . . . . . 4.4 BLOQUEO REGIONAL (BLOQUEO NERVIOSO) . . . . . . . . . . . . . . 27 4.5 TECNICAS DE REFUERZO O SUPLEMENTARIAS EN ENDODONCIA . 4.6 ANESTESIA INTRAPULPAR . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 28 4.7 INYECCION EN EL LIGAMENTTO PERIODONTAL . . . . . . . . . . . . 29 4.8 INYECCION INTRASEPTAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 4.9 INYECCION INTRAOSEA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 30 CAPITULO 5 OBTURACION DEL CONDUCTO Y CONDENSACION LATERAL 5.1 INTRODUCCION . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 31 5.2 PRINCIPIOS DE LA OBTURACIÓN . . . . . . . . . . . . . . . . . . . . . . . . 32 5.3 MATERIALES DE OBTURACION . . . . . . . . . . . . . . . . . . . . . . . . . . 34 5.4 GUTAPERCHA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 36 5.5 TECNICA DE CONDENSACION LATERAL . . . . . . . . . . . . . . . . . . 39 9 5.6 RESUMEN DE LA TECNICA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 40 CAPITULO 6 BIOSEGURIDAD EN ODONTOLOGIA 6.1 INTRODUCCION . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 44 6.2 BIOSEGURIDAD . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 45 6.3 LOS PRINCIPIOS DE BIOSEGURIDAD . . . . . . . . . . . . . . . . . . . . . 46 6.4 DEFINICION DE TERMINOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 47 6.5 RECOMENDACIONES PRÁCTICAS . . . . . . . . . . . . . . . . . . . . . . . 48 6.6 LIMPIEZA Y DESINFECCION DE MATERIALES Y EQUIPOS . . . 50 6.7 CRITERIOS PARA DESINFECCION, DECONTAMINACION . . . . 50 6.8 CRITERIOS PARA ESTERILIZACION . . . . . . . . . . . . . . . . . . . . . . 54 6.9 METODOS DE ESTERILIZACION . . . . . . . . . . . . . . . . . . . . . . . . . 55 6.10 PROCEDIMENTOS DE DESCONTAMINACION . . . . . . . . . . . . . 56 6.11 RECOMENDACIONES DE BIOSEGURIDAD EN ODONTOLOGIA . 57 6.12 MECANISMOS DE INFECCION . . . . . . . . . . . . . . . . . . . . . . . . . . 58 6.13 PRECAUCIONES EN LA CONSULTA DEL PACIENTE . . . . . . . . 59 6.14 RECOMENDACIONES PARA EL TRATAMIETO DE PACIENTES. 6.15 TECNICAS DEL LAVADO DE MANOS . . . . . . . . . . . . . . . . . . . . . 60 6.16 GUANTES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 6.17 MASCARILLA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 61 6.18 PROTECTORES OCULARES . . . . . . . . . . . . . . . . . . . . . . . . . . . . 62 6.19 VESTIMENTA DEL PROFESIONAL . . . . . . . . . . . . . . . . . . . . . . . 10 6.20 ESTERELIZACION Y DESINFECCION DEL CONSULTORIO . . . 6.21 ELIMINACION DE MATERIALES DESCARTABLES . . . . . . . . . . . 64 6.22 PRECAUCIONES GENERALES EN EL AREA ESPECIFICA DE TRABAJO ESTOMATOLOGICO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 65 6.23 PRECAUCIONES CUANDO SE PRESENTAN LESIONES ACCIDENTALES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 66 6.24 RECOMENDACIONES DURANTE LA ATENCION . . . . . . . . . . . . 6.25 CONTROL AMBIENTAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 68 6.26 SALUD OCUPACIONAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 70 6.27 NORMAS MINIMAS DE BIOSEGURIDAD EN ODONTOLOGIA . . . CAPITULO 7 ANTECEDENTES GENERALES 7.1 MOTIVO DE LA CONSULTA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 74 7.2 DIAGNOSTICO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 75 7.2.1 RADIOGRAFIA PRE-OPERATORIA . . . . . . . . . . . . . . . . . 7.2.2 EXPLORACION CLINICA . . . . . . . . . . . . . . . . . . . . . . . . . 7.2.3 SEMIOLOGIA DEL DOLOR . . . . . . . . . . . . . . . . . . . . . . . . 76 7.2.4 VITALOMETRIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.2.5 INTERPRETACION RADIOGRAFICA . . . . . . . . . . . . . . . . 7.3 ANESTSIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 77 7.4 AISLAMIENTO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 78 7.5 APERTURA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 79 11 7.5.1 APERTURA Y ACCESO CAMERAL . . . . . . . . . . . . . . . . 7.5.2 NEUTRALIZACION DEL CONTENIDO . . . . . . . . . . . . . . 7.6 ODONTOMETRIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 80 7.6.1 LONGUITUD APARENTE . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.6.2 LONGUITUD DE INSTRUMRNTO . . . . . . . . . . . . . . . . . . 7.6.3 LONGUITUD DE TRABAJO . . . . . . . . . . . . . . . . . . . . . . . 7.7 TECNICAS RADIOGRAFICAS . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.8 BIOMECANICA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 81 7.8.1 PRIMERA CITA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.8.2 MEDICACION INTRACONDUCTO . . . . . . . . . . . . . . . . . 7.8.3 HIDROXIDO DE CALCIO . . . . . . . . . . . . . . . . . . . . . . . . . 82 7.8.3.1 PROPIRDADES DEL HIDROXIDO DE CALCIO . . . . 7.8.3.2 PROPIRDADES BIOLOGICAS DEL HIDROXIDO DE CALCIO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.8.4 CURA OCLUSIVA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 83 7.9 SEGUNDA CITA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.9.1 ANESTESIA LOCAL . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.9.2 PREPARACION Y AISLAMIENTO DEL CAMPO OPERATORIO .................................................. 7.9.3 RETIRO DE LA OCLUSIVA . . . . . . . . . . . . . . . . . . . . . . . 7.9.4 RETIRO DEL MATERIAL OBTURADOR PROVISIONA , IRRIGADO Y SECADO . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.9.5 IRRIGACION Y SECADO DEL CONDUCTO . . . . . . . . . 12 84 7.10 OBTURACION . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.10.1 CONOMETRIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.10.2 OBTURACION DEL CONDUCTO RADICULAR . . . . . . 85 7.10.3 RADIOGRAFIA PORT-OPERATORIA . . . . . . . . . . . . . 86 7.11 ACCIDENTES OPERATORIOS . . . . . . . . . . . . . . . . . . . . . . . . . . 7.11.1 FARMACOPEDIA . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 7.12 RECONSTRUCCION DEL DIENTE . . . . . . . . . . . . . . . . . . . . . . . 91 7.12.1 OBTURACION DEL CAVIDAD . . . . . . . . . . . . . . . . . . . 7.12.2 CONTROL DE OCLUSION . . . . . . . . . . . . . . . . . . . . . . 92 7.12.3 RADIOGRAFIA FINAL . . . . . . . . . . . . . . . . . . . . . . . . . 7.12.4 RECOMENDACIONES AL PACIENTE . . . . . . . . . . . . CONCLUSIONES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 93 RECOMENDACIONES . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 94 ANEXOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 95 ANEXOS GRAFICOS . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . . 104 13 INTRODUCCION Con el pasar del tiempo, la Odontología en el campo de la Endodoncia dental ha venido siendo fiel testigo de los avances de la tecnología, observando la optimización de las características y propiedades de los materiales a usar en un tratamiento de Conducto constatándose tal progreso de los materiales en su manipulación y resistencia más eficiente, con la finalidad de aproximarse al hallazgo del material ideal. Este trabajo narra sobre la Necrosis Pulpar tipos de necrosis y técnicas de biomecánicas, irrigación y condensación a emplearse para realizar un buen tratamiento de endodoncia. La posibilidad de poder tratar una pieza que ha sufrido un daño pulpar, con un tratamiento endodóntico es muy alentador tanto para el paciente como para el profesional. El presente trabajo tiene como principal propósito considerar el factor positivo y negativo de los materiales e instrumentos empleados para realizar un tratamiento de endodoncia. Esta recopilación de información se basó en la realización del caso clínico presente en el incisivo superior lateral derecho, al cual se procedió a realizar una endodoncia con la patología de Necrosis Pulpar Crónica, con la finalidad de que la pieza dental cumpla su función masticatoria y de estética Todo esto fue para conseguir la conservación de la pieza dentaria en cuestión, lo que constituye hoy por hoy la prioridad del profesional de la salud oral. 14 OBJETIVO GENERAL Describir los diversos conceptos y técnicas de la endodoncia dental, desde las perspectivas de su origen, localización, extensión y clasificación, relacionada a un incisivo lateral derecho para de esta forma tener mayor claridad y conocimiento al proceder a realizar un tratamiento endodóntico durante la práctica clínica. 15 OBJETIVO ESPECIFICO • Constatar que la pieza dentaria presente un daño en su pulpa dental que amerite un tratamiento endodóntico. • Complementar el examen clínico con el estudio radiográfico del caso con el fin de otorgar un diagnóstico preciso. • Ejecutar el plan de tratamiento establecido, sin dejar de lado el control de su evolución una vez culminado el tratamiento. 16 NECROPULPECTOMIA CON LESION PERIAPICAL Capítulo 1.- FUNDAMENTACION TEORICA 1 Anatomía Dentaria 1.1 DIENTE El diente es un órgano anatómico duro, enclavado en los alvéolos de los huesos maxilares a través de un tipo especial de articulación denominada gonfosis y en la que intervienen diferentes estructuras que lo conforman: cemento dentario y hueso alveolar ambos unidos por el ligamento periodontal. El diente está compuesto por calcio y fósforo, que le otorgan la dureza. Los dientes son estructuras de tejido mineralizado que comienzan a desarrollarse desde pronta edad y los cuales nos ayudan a masticar alimentos para una buena digestión. El diente realiza la primera etapa de la digestión y participa también en la comunicación oral. Básicamente en el diente se pueden reconocer dos partes, la corona, parte visible recubierta por esmalte dental y la raíz no visible en una boca sana. Los dientes, ordenados desde el centro hacia las mandíbulas son: incisivos que cortan, los caninos que desgarran, los premolares que trituran y los molares que muelen. Ver anexo fig. 1, pag.104 Pieza dentaria y sus partes 17 1.2 Partes del diente 1.2.1Esmalte dental: es un tejido formado por hidroxiapatita y proteínas (en muy baja proporción). Es el tejido más duro del cuerpo humano. En zonas donde el esmalte es más delgado o se ha desgastado, puede ser sumamente sensible. El esmalte es translúcido, insensible al dolor pues en el no existen terminaciones nerviosas. Con el flúor se forman cristales de fluorhidroxiapatita que es mucho más resistente que la hidroxiapatita al ataque de la caries dental. 1.2.2 Dentina: tejido mineralizado, pero en menor proporción que el esmalte. Es el responsable del color de los dientes. Contiene túbulos en donde se proyectan prolongaciones de los odontoblastos. La dentina proporciona elasticidad al frágil pero duro esmalte. 1.2.3 Cemento dental: tejido conectivo altamente especializado. Es una capa dura, opaca y amarillenta que recubre la dentina a nivel de la raíz del diente. Se encarga de unir la pieza dental con el resto de la mandíbula o maxila. 1.2.4 Pulpa dentaria: de tejido mesodérmico está constituida por un tejido suave que contiene vasos sanguíneos (arteria y vena) que conducen la sangre hacia el diente y por fibras nerviosas que otorgan sensibilidad al diente. Dichos nervios atraviesan la raíz (del diente) por medio de finos canales. Su célula principal son los odontoblastos (son células tanto de la pulpa como de la dentina), éstos fabrican dentina y son los que mantienen la vitalidad de la dentina. Los odontoblastos poseen prolongaciones conocidas como Proceso de Tomes que se alojan en los túbulos dentinarios. 18 1.3 Estructuras de soporte de los dientes Los tejidos peridentarios que conforman el periodonto, son todos aquellos tejidos que rodean al diente. El periodonto está constituido por la: 1.3.1 Encía: es la parte de la mucosa bucal que rodea el cuello de los dientes y cubre el hueso alveolar. 1.3.2 Ligamento periodontal: es una estructura de tejido conjuntivo que rodea la raíz y la une al hueso alveolar. Entre sus funciones están la inserción del diente al hueso alveolar y la resistencia al impacto de los golpes. También posee propiedades mecanorreceptoras siendo capaz de transmitir las fuerzas ejercidas sobre el diente a los nervios adyacentes. 1.3.3 Hueso alveolar: es la parte del hueso maxilar donde se alojan los dientes. Se denomina hueso alveolar al hueso de los maxilares que contiene o reviste las cuencas o alveolos, en las que se mantienen las raíces de los dientes. Ver anexo fig. 2, pag.105 Partes de sostén del diente 1.4 Estructura morfológica 1.4.1 Corona: es la parte del diente libre o visible en la cavidad oral. La capa de diente que lo recubre es el esmalte, y podemos observar en boca la parte funcional del órgano dentario. Esta porción del diente se encuentra expuesta al medio bucal en forma permanente. 19 1.4.2 Cuello: llamado zona cervical, es la unión de la corona con la raíz y se sitúa en la encía marginal. 1.4.3 Raíz: esta parte del diente no es visible en la cavidad bucal ya que está incrustada en el alvéolo dentario, dentro del hueso, y se encuentra recubierta por el cemento dentario. Sirve de anclaje. Los dientes normalmente tienen entre una y tres raíces, dependiendo de si son incisivos (una raíz), caninos (1), premolares (1 o 2) o molares (dos o tres, en casos excepcionales más de tres) 1.5 Incisivo lateral superior derecho 1.5.1 Medidas La corona tiene de 10 a 11 mm de largo, desde el punto más alto de la línea cervical al punto más bajo del borde incisal, raíz de 11 a 12 mm, longitud total 22mm, mesiodistalmente tiene una amplitud de 8 a 9 mm en las áreas de contacto, raíz 2º 3mm más larga que la corona Incisivos Superiores Laterales Inicio de formación 1 año Corona Completa de 4 a 5 años Erupción 8 a 9 años Raíz Completa 11 años Ver anexo fig. 3 pág. Cara vestibular, palatina y oclusar del incisivo lateral superior derecho 20 1.5.2 Cara vestibular Cresta incisal redondeada y los ángulos mesiales y distales igualmente redondeados la cara vestibular es más convexa que la del incisivo central, excepto en algunas formas cuadradas y planas 1.5.3 Cara lingual Presenta sus crestas marginales muy marcadas y su cíngulo es prominente y con tendencia a presentar profundos surcos de desarrollo dentro de la fosa lingual, en el punto en el que se une al cíngulo; este diente se estrecha hacia lingual. 1.5.4 Cara mesial La cara mesial es parecida a la de un incisivo central pequeño excepto en la raíz ya que esta es más larga Se curvatura de la línea cervical hacia el borde incisal, su cresta incisal es gruesa. 1.5.5 Cara distal Debido a su posición sobre la raíz la anchura de la corana vista por esta cara es mayor que por su cara mesial Parece más ancha que la cara mesial, su curvatura cervical es menor que la mesial; se dice que es frecuente encontrar un surco de desarrollo distal en la corona que se extiende a lo largo de parte o de toda la raíz 1.5.6 Cara incisal Tanto su cíngulo como su borde incisal son grandes, también se le observa una convexidad vestibular. El perfil de la cara incisal es muy uniforme 1.5.7 Forma 21 Trapecio desiguales con los lados más largos en la superficie incisal u oclusal pero en su cara mesial o distal se dice que tiene una forma triangular. 1.5.8 Raíz Su raíz es dos veces el tamaño de la corona se estrecha del cerviz al apice y esta inclinada hacia el lado distal. La longitud de la raíz tien en ocaciones 1,5 veces la longitud de la corona. 1.5.9Función Su fusión masticatoria es de corte, también tiene función estética por q si no estuviera se vería mal otra de las funciones podría ser de fonación por q al momento de hablar apoyamos la lengua en ellos y soporte del labio. 1.6 MORFOLOGÍA DE LA CAVIDAD PULPAR INCISIVO LATERAL SUPERIOR DERECHO La vista lingual en la radiografía se revelará: 1. Curvatura apicodistalde la pulpa en el 53% de las veces 2. Inclinación mesioaxialde 16º del diente No serán visibles en la radiografía: 1. presencia del hombro lingual donde se unen la cámara y el conducto 2. angulación linguo-axial de 29º del diente 3. la cavidad pulpar es más ancha en dimensión vestíbulo-palatina con una forma general ovoide 4. A nivel del tercio apical el conducto suele ser de forma circular 5. La curvatura apico-lingual no suele observarse en la radiografía 22 Longitud promedio del diente 22.8 mm. Un conducto Conductos 99.9 % laterales 10% Ramificaciones apicales 12 % Curvatura radicular • Recto 30% • Curva distal 53% • Curva mesial 3% • Curva labial 4% • Curva gradual y de bayoneta 6% 1.6.1 Cámara pulpar: presenta características similares al incisivo central superior, aunque con dimensiones menores. Sin embargo, si se tiene en cuenta el volumen total de las coronas (del central y del lateral), la cámara pulpar del incisivo lateral es proporcionalmente mucho mayor que la del incisivo central. 1.6.2 Conducto radicular: Aunque es único y cónico y con configuración similar a la del incisivo central superior, presenta dimensiones menores. A nivel del tercio apical, tiene tendencia a curvarse hacia distal, siendo que muchas veces esa curvatura es tan pronunciada que impide el ensanchamiento del conducto. Consecuencias clínicas de la anatomía pulpar para un tratamiento endodóntico favorable en los incisivos laterales superiores. • El contorno de la cámara pulpar del incisivo lateral superior es similar al del central, sin embargo, es más pequeño y pueden existir dos cuernos pulpares o ninguno. 23 • Este diente es más ancho en sentido vestíbulolingual que en sentido mesiodistal • La sección transversal en la unión cemento-esmalte muestra una cámrapulpar centrada en la raíz y su forma puede ser triangular, oval o redonda • Desde la unión cemento-esmalte, el conducto pulpar se hace redondo en su sección transversal en las porciones media y apical de la raíz • Normalmente sólo existe un conducto, pero se han publicado casos con dos y tres conductos. Ver anexo fig. 4 pág. 106 Imágenes de cámara pulpares de incisivos lateral 24 Capítulo 2.- EMBRIOLOGÍA PULPAR 2.1 GENERALIDADES Estudios embriológicos han demostrado que la pulpa deriva de la cresta neural cefálica. Las células de la cresta neural se originan en el ectodermo a lo largo de los bordes laterales de la placa neural y migran en forma extensiva. Las células que se movilizan a los lados de la cabeza hacia los maxilares superior e inferior contribuyen a la formación de los gérmenes dentarios. La papila dental, de la cual se origina la pulpa madura, se desarrolla a medida que las células ectomesenquimáticas proliferan y se condensan en la vecindad de la lámina dental en los sitios en los cuales se desarrollarán los dientes. Durante la sexta semana de vida embrionaria, la formación de los dientes comienza como una proliferación localizada de ectodermo asociada con los procesos de los maxilares superior o inferior. Esta actividad proliferativa trae como resultado la formación de dos estructuras en forma de herradura, una sobre cada proceso, las cuales son denominadas listones dentarios primarios. Cada listón dentario primario se divide en un listón vestibular y un listón dentario. En contraste con hipótesis anteriores, en las cuales se decía que el ectodermo era el determinante primario, estudios cuidadosos han demostrado que el mesénquima dental es el que inicia y controla en forma primaria la formación del diente. El mesénquima induce la formación de la lámina ectodérmica, que a su vez propicia la formación de un folículo ectodérmico y por último del esmalte. 25 Cada folículo define una concentración de células mesodérmicas denominada papila dental en un sitio apropiado determinado genéticamente. La secuencia es conocida en toda la embriología de los mamíferos. El mesénquima también determina la forma del órgano del esmalte, un patrón bien ilustrado por el diente en crecimiento. Primero, el folículo exodérmico se modifica y adopta una forma especializada a modo de campana (órgano del esmalte). A su vez, el mesodermo situado abajo se conforma para ajustarse a este molde ectodérmico, convirtiéndose así en la verdadera papila dental. La maduración de esta papila dental ocurre apenas con un ligero retraso respecto a la del órgano del esmalte. Cuando el órgano del esmalte puede reconocerse como una estructura de cuatro capas en su nivel más coronario, la papila también se encuentra muy modificada. Una vez que aparece el esmalte interno, éste se convierte en el inductor primario. Los odontoblastos surgen por el estímulo ectodérmico, se diferencian con mayor rapidez que sus vecinos ectodérmicos, maduran y producen dentina en el vértice de la cúspide, convirtiéndose así en las primeras células en producir estructura dentaria calcificada. Sólo cuando se ha formado la dentina aparecen los ameloblastos, que producen esmalte. Asimismo, en la raíz en formación, es la presencia de la primera dentina contra la vaina epitelial radicular la que da la señal de retroceso del ectodermo. Estos fenómenos son fundamentales para el establecimiento de las uniones entre la dentina y el esmalte y la dentina y el cemento. Desarrollan el mensaje genético relativo a la forma externa del diente y la forma de la pulpa. La maduración de la papila dental avanza progresivamente en sentido apical, comenzando en el nivel más coronario del diente y de ahí hasta el ápice. La presencia lateral del órgano del esmalte o vaina radicular precipita la diferenciación de los odontoblastos y, en poco tiempo, la formación de la 26 dentina. En esta etapa, la vascularidad y el contenido celular del plexo subodontoblástico son dignos de tomarse en cuenta. No existen fibras nerviosas en el área de la dentina en formación. Poco a poco, al engrosarse la dentina coronaria y radicular, los elementos sensitivos nerviosos penetran en la papila y se acercan a la dentina coronaria. A la vez, las fibras vasomotoras autónomas entran en la papila y establecen sus uniones con los diferentes vasos sanguíneos. Cuando el diente hace erupción, la pulpa que se halla en su interior puede ya en forma arbitraria denominarse madura. El procedimiento de células sobre fibras ha desaparecido, casi toda la dentina coronaria y gran parte de la dentina radicular han sido formadas y se ha establecido un patrón adulto de vasos sanguíneos y nervios. 2.2 ETAPAS DEL DESARROLLO Por conveniencia, se describe en etapas el desarrollo de los dientes, aunque no hay límites precisos entre ellas: 2.3 ETAPA DE BOTÓN, BROTE O YEMA Después de la sexta semana de vida fetal, ocurre un engrosamiento de la capa epitelial, por rápida proliferación de algunas células de la capa basal. Esto se conoce como lámina dental y es el primordio o precursor del órgano del esmalte. Poco después, en cada maxilar se presentan 10 pequeños engrosamientos redondeados dentro de la lámina dental. Estos son los futuros gérmenes dentales. 2.3 ETAPA DE CASQUETE O SOMBRERO Después de la etapa de botón, la división celular rítmica (circadiana) origina proliferación desigual de parte del epitelio. La superficie profunda del botón comienza a invaginar y varias capas se hacen evidentes. Estas son el epitelio dental interno, que es una capa de células epiteliales altas a nivel de la concavidad, y el epitelio dental externo, que es una capa sencilla de 27 células epiteliales cortas sobre la superficie exterior. En el centro, se separan las células por aumento de líquido intercelular mucoide rico en glucógeno, como queda demostrado por la reacción del ácido peryódico de Schiff. Estas células se conocen como retículo estrellado u órgano dental. La proliferación epitelial se fija a la lámina dental por un tramo de epitelio que sigue creciendo y proliferando hacia el tejido conjuntivo. Alrededor de la octava semana de vida intrauterina, se observa el primer esbozo de la papila dental. Esto corresponde a condensación del tejido conjuntivo bajo el epitelio dental interno, que más tarde se convierte en la pulpa dental. En un principio las células de la papila dental son grandes y redondeadas, o poliédricas, con citoplasma pálido y núcleo grande. Al mismo tiempo, se condensa el mesénquima que rodea el exterior del diente en desarrollo y se torna más fibroso. Este tejido se llama saco dental. Las células del saco dental formarán los tejidos del periodonto, que son: el ligamento periodontal, cemento y hueso alveolar. 2.5 ETAPA DE CAMPANA Se profundiza la invaginación y ocurren una serie de interacciones entre las células epiteliales y mesenquimatosas que originan diferenciación de las células del epitelio dental interno en células columnares altas, llamadas ameloblastos. El intercambio de información inductiva entre el epitelio y mesénquima ocurre a través de la membrana basal. Los ameloblastos contribuyen a formar esmalte. Las células de la papila dental, que están debajo de los ameloblastos, se diferencian en odontoblastos que van a elaborar dentina. Varias capas de células escamosas de poca altura empiezan a surgir junto al epitelio dental interno. Esta capa se llama estrato intermedio. 2.6 DESARROLLO DE LAS ESTRUCTURAS RADICULARES 28 Es importante el conocimiento del ápice radicular puesto que, las etapas de formación radicular y el tipo de tejido presente dentro de la raíz del diente, tienen gran influencia en la práctica endodóntica. Durante el desarrollo dental el epitelio dental interno y el epitelio dental externo se unen y forman el rodete cervical, el cual se invagina dentro del tejido conectivo subyacente. Este rodete cervical determina la futura unión cementoadamantina. Se convierte, entonces, en la llamada vaina epitelial radicular de Hertwig. Esta porción invaginada permanece como una capa continua hasta que la dentina de la raíz se ha formado. Posteriormente a la aposición de dentina, la vaina de Hertwig se desintegra en dirección coronal siguiendo la disminución del tejido conectivo del saco dentario. Cuando la vaina radicular empieza a desintegrarse, las células del tejido conectivo se diferencian en cementoblastos y el cemento se deposita en la dentina. Los cementoblastos inicialmente elaboran una matriz de tejido cementoide, esto es, una capa de cemento no calcificado. Subsecuentemente la mineralización de la matriz anterior ocurre y nuevo tejido cementoide se forma. El cemento está continuamente depositándose y aumentando en grosor a través de toda la vida del diente. Ocasionalmente en el diente en desarrollo, la vaina epitelial de Hertwig permanece adherida a la dentina subyacente, especialmente en las regiones radiculares cervicales y en la furcación. El epitelio adherido puede entonces formar esmalte, resultando en la formación de una perla de esmalte. De acuerdo con Orban, el ápice radicular permanece en su lugar: esto quiere decir que, el diente y las estructuras de soporte que lo rodean se mueven oclusalmente, continuando con la formación radicular. 29 La longitud final de la raíz y el cierre apical varía de acuerdo con la erupción dentaria y el sexo del paciente. En términos generales, se puede resumir que los varones tardan más tiempo en formar cada uno de sus dientes tanto en longitud como en maduración del foramen, que las niñas. Por otra parte los dientes, después de la erupción, tardarán en llegar a su longitud radicular total hacia los 3 o 4 años más. Mientras que para el cierre apical habrán de transcurrir otros 2 a 5 años más todavía. Sirva de ejemplo el canino superior: Erupción: alrededor de los 9 años a) Longitud radicular completa: Hombres: 12 ½ años Mujeres: 11 años b) Cierre del foramen apical: Hombres: 18 años Mujeres: 14 años 2.7 IMPORTANCIA EN LA CLÍNICA ENDODÓNTICA DEL DESARROLLO DENTARIO La apertura en embudo a nivel de foramen apical se presenta en todo diente incompletamente formado. Este ápice radicular inmaduro contiene tejido conectivo. La reparación exitosa de pulpas inflamadas en dientes con forámenes inmaduros es mayor si se compara con aquella de dientes con formación apical completa, probablemente debido al excelente metabolismo del primer grupo. Por lo tanto, los procedimientos de pulpotomía o recubrimientos pulpares tienen un mejor pronóstico en dientes con ápice abierto. Una vez que el foramen ha sido formado, la pulpectomía total tendrá un mejor pronóstico. 30 Cuando se requiere la terapia endodóntica en un diente con ápice inmaduro, se consiguen buenos resultados obturando el conducto más corto existiendo grandes probabilidades de que el ápice siga formándose aún en el caso de existir grandes lesiones periapicales. 2.8 CONDUCTOS LATERALES Y FORAMENES ACCESORIOS Si la vaina epitelial se desintegra antes de que la dentina sea formada, se produce un conducto lateral. Los forámenes accesorios se forman de manera similar. Además de esto los conductos accesorios o laterales pueden formarse como resultado de una falta de formación dentinaria alrededor de un vaso sanguíneo presente en el tejido conectivo periradicular. Un conducto accesorio puede aparecer en cualquier parte a lo largo de la raíz, lo que determina la creación de una vía de comunicación entre los tejidos periodontales y endodónticos y una posible puerta de entrada hacia la pulpa si los tejidos periodontales pierden su integridad. 2.9 ANOMALIAS EN EL DESARROLLO DENTAL 2.9.1 NEOPLASIAS Si se presenta una alteración durante la proliferación, puede formarse un ameloblastoma u otro tumor. Los ameloblastomas son tumores odontogénicos de origen ectodérmico; sus células se diferencian en epitelio de esmalte, sin formar en realidad esmalte. Otros tumores, como mixomas y fibromas odontógenos, pueden formarse por células mesenquimatosas embrionarias o adultas, del germen dental. 2.9.2 INFECCIONES Las infecciones pueden alterar las morfodiferenciación y maduración. 31 etapas de histodiferenciación, La sífilis produce dientes de Hutchinson, que son dientes anteriores con forma de pala o con ranuras o de molares en configuración de moras. Fiebres exantemáticas como rubéola, varicela, sarampión y escarlatina también pueden dañar el desarrollo de los dientes. Como el esmalte se forma continua y rítmicamente, es posible calcular la edad en que ocurrió la fiebre por la ubicación de la región picada sobre la superficie de esmalte del diente. 2.9.3 TRAUMATISMOS El traumatismo a los dientes primarios se transmite con facilidad a los permanentes en desarrollo por la estrecha relación de los ápices radiculares de los primarios y los gérmenes dentales de los sucesores permanentes. El tipo de defectos en formaciones resultantes de la lesión, depende de su intensidad y de la etapa de formación dental en el momento del traumatismo. 2.9.4 TRASTORNOS NUTRICIONALES Entre otras alteraciones sistémicas que atacan el desarrollo dental está la desnutrición proteínica, deficiencia de ácidos grasos esenciales y diversas insuficiencias vitamínicas y minerales. 2.9.5 DEFECTOS CONGÉNITOS Los defectos de genes sencillos, variaciones que dañan genes múltiples ordenados a lo largo de los cromosomas, alteraciones numéricas o morfológicas de los mismos pueden producir defectos heredados en los dientes. Entre los defectos están los encontrados en Síndrome de Down, anodoncia y dientes supernumerarios; amelogénesis y dentinogénesis imperfecta (dentina opalescente hereditaria), hipoplasia e hipocalcificación hereditarias del esmalte, amelogénesis imperfecta, displasia dentinaria, diente invaginado (densinvaginatus, dens in dente), taurodontismo, displasia 32 ectodérmica, síndrome trico-dento-óseo, displasia pulpar, odontodisplasia regional, hipofosfatasia, hipofosfatemia hereditaria familiar, porfiria congénita (eritropoyética). 2.10 EFECTOS DE MEDICAMENTOS a) Antibióticos.- La tetraciclina se incorpora en la dentina durante el proceso de mineralización debido a su gran afinidad por calcio (iones metálicos). Se forma un complejo tetraciclina-calcio-ortofosfato, que resulta en una decoloración clínicamente observable. En el feto humano, los dientes son susceptibles a los efectos lesivos del antibiótico desde la 28ª semana de gestación. Si se administra tetraciclina a niños, entre dos meses y dos años de edad, los dientes permanentes se pueden pigmentar y tornar hipoplásicos. b) Hormonas endócrinas.- Las hormonas endócrinas desempeñan una función importante en el desarrollo dental, particularmente antes de la erupción. Se alteran, en especial, las raíces de los dientes. Una vez que se forma por completo el diente, las hormonas no lo dañan. c) Radiación.- Las células no diferenciadas son las que más responden a la radiación, en comparación con las diferenciadas. En los dientes humanos en desarrollo, el daño depende de la magnitud, fuente y tipo de radiación, factores relacionados con la exposición y la etapa del desarrollo de la misma. 33 Capítulo 3.- NECROSIS PULPAR 3.1 Definición Es la muerte de la pulpa. Puede ser total o parcial dependiendo de que sea toda la pulpa o una parte la que esté involucrada. Aunque la necrosis es una secuela de la inflamación, puede también ocurrir por traumatismos, donde la pulpa es destruida antes de que se desarrolle una reacción inflamatoria. Como resultado se produce un infarto isquémico y causar una pulpa necrótica gangrenosa seca. Las pulpitis agudas, así como los estados degenerativos, dependiendo de algunos factores intrínsecos, pueden avanzar rápida o lentamente hacia la muerte pulpar, lo que implicaría el cese de los procesos metabólicos de este órgano. 3.2 Tipos: 1. Por coagulación. La porción soluble del tejido se precipita o se convierte en material sólido. La caseificación es una forma de necrosis por coagulación en la que el tejido se convierte en una masa de aspecto de queso consistente de proteínas coaguladas, grasas y agua. 2. Por licuefacción. Las enzimas proteolíticas convierten el tejido en líquido. Ya que la pulpa está encerrada en paredes rígidas, no tiene circulación sanguínea colateral y sus vénulas y linfáticos se colapsan si la presión tisular aumenta. Así es que la pulpitis irreversible lleva a la necrosis por licuefacción. Cuando el exudado que se produce puede drenar por alguna lugar, ya sea la exposición en cavidad oral o por la caries, la pulpa puede 34 permanecer intacta mayor tiempo, pero si la pulpa esta inflamada y cerrada se llega más rápido y totalmente a la necrosis pulpar. También puede haber necrosis por isquemia. Con respecto a su tratamiento, el tipo de necrosis no tiene significación clínica. Esto es, su tratamiento es el mismo sin importar su tipo. 3.3 Etiología Causas: Cualquier daño a la pulpa, tal como bacterias o sus toxinas, trauma o irritación química. Clínicamente no importa el tipo de necrosis. 3.4 Histopatología El tejido pulpar necrótico tiene debris celular y bacterias en la cavidad pulpar. Puede empezar la inflamación Periapical. La descomposición de las proteínas por las bacterias anaeróbicas es denominada putrefacción. Algunos de los productos nocivos intermedios o terminales encontrados en estas proteínas descompuestas (necróticas) e infectadas, son: 1. Productos proteolíticos intermedios, que emiten un hedor desagradable 1. Indol y escatol, producidos por las des-aminación de triptofano (esto es, la pérdida de moléculas de amina de un aminoácido) 2. Putrecina y cadaverina (también conocidos como ptomainos), de la des-carboxilación (pérdida de moléculas carboxilos de un aminoácido) 3. Indican, derivado del indol (sulfato de indoxil-potásico) 2. Productos terminales, tales como sulfato hidrogenado, amoniaco, agua, dióxido de carbono y ácidos grasos 35 3. Exotoxinas, que son secreciones bacterianas 4. Endotoxinas, que son liberadas cuando las bacterias son destruidas 5. Proteínas bacterias extrañas 3.5 Microbiología En alto porcentaje el conducto radicular necrótico contiene una flora bacteriana mixta, tanto anaerobios como aerobios. La acción de las bacterias sobre el tejido pulpar necrótico provoca la gangrena, por descomposición de las proteínas y su putrefacción , en la que intervienen productos intermedios que, como el indol, escatol, cadaverina y putrecina, son responsables del penetrante y desagradable olor de muchas gangrenas pulpares. 3.6 Síntomas Asintomático, puede presentarse decoloración del diente. El aspecto opaco de la corona puede deberse a falta de transparencia. Otras veces el diente presenta francamente un color grisáceo o café y perder el brillo normal. Si la necrosis es parcial puede responder ligeramente a los estímulos térmicos, debido a la presencia de terminaciones nerviosas vitales de tejidos vecinos inflamados. El acceso a cámara es indoloro y es reconocible la fetidez. 3.7 Diagnóstico Historia de dolor severo que cesó después. No responde a pruebas térmicas o eléctricas o tallado dentinario. La radiografía generalmente muestra una cavidad amplia o restauraciones, y aumento en el grosor del ligamento periodontal. 36 Los dientes necróticos son casi siempre asintomáticos, no responden al frío ni a las pruebas eléctricas, pero algunas veces responden al calor, pero esto se le atribuye a la expansión del aire contenido en el conducto. 3.8 Tratamiento Pulpectomía no vital y obturación de los conductos radiculares. No se cuenta con ningún preparado que disuelva con seguridad el tejido necrótico, pero de todos los disponibles, los agentes oxidantes han demostrado ser eficaces y seguros como auxiliares de la instrumentación. El hipoclorito de sodio, el peroxido de hidrogeno, urea al 30%, glioxido y urea en 50-50, han demostrado resultados clínicos excelentes Con respecto a su tratamiento, el tipo de necrosis no tiene significación clínica. Esto es, su tratamiento es el mismo sin importar su tipo. 3.9 Pronóstico Favorable para el diente, si se aplica la terapia endodóntica adecuada. 37 Capítulo 4.- ANESTESIA LOCAL PARA ENDODONCIA (Se aconseja al Alumno de endodoncia consultar libros especializados en anestesia local para odontología y los apuntes de la materia Anestesia que ya debe haber cursado, para reafirmar los conocimientos de farmacología, vías de administración, dosis, instrumental y técnicas convencionales de la Anestesia local. No sería factible dar aquí un curso completo de anestesia, pero sí revisaremos algunos conceptos importantes y las técnicas más útiles en la práctica endodóntica) 4.1 GENERALIDADES Los anestésicos locales son, en opinión de Stanley F. Malamed (Malamed 5, XI), los fármacos más seguros y más eficaces disponibles en toda la medicina para la prevención y el control del dolor. De hecho no existen otros fármacos que realmente eviten el dolor; en la actualidad ningún otro agente impide que un impulso nervioso nociceptivo alcance el cerebro del paciente, donde sería interpretado como dolor. Si se deposita un anestésico local en la cercanía de un nervio sensitivo, se producirá un control adecuado del dolor en prácticamente cualquier situación clínica. Otros fármacos (analgésicos tales como opioides y AINES) y técnicas (anestesia general) actúan sobre el dolor mediante la modificación de la respuesta del paciente al estímulo nociceptivo a través de una depresión del sistema nervioso central mediada por fármacos. El dolor se sigue sintiendo pero la respuesta a él está minimizada (analgésicos) o anulada porque el paciente se encuentra inconsciente (anestesia general). 38 4.2 ACCION DE LAS SOLUCION ANESTESICA Los agentes anestésicos como cualquier otro medicamento, no deben administrarse sin un conocimiento completo de la historia médica y dental del paciente. Deben investigarse reacciones adversas y alérgicas durante administraciones anteriores. Los anestésicos locales inyectables empleados por lo común son de naturaleza débilmente básica y poco solubles en agua. Para hacerlos de utilidad clínica se les combina con ácido clorhídrico para formar clorhidratos, que son solubles en agua y de reacción ácida. Cuando se les diluye, las sales de los compuestos anestésicos locales existen en dos formas: una molécula no cargada (RN) y en catión con carga positiva (RNH+). La porción relativa de cada una dependerá del pH de la solución en el cartucho y en los tejidos y el pK del compuesto anestésico específico. El pK es el valor del pH en que un compuesto contiene igual cantidad de moléculas no ionizadas y de cationes ionizados. 4.3 ANESTESIA POR INFILTRACION O SUPRAPERIOSTICA La anestesia supraperióstica llamada también por infiltración o paraperióstica, es la inyección de un anestésico local en los tejidos blandos en la región del ápice radicular. La infiltración es probablemente el método más simple, seguro y rápido para producir anestesia suficiente para remover la pulpa dental. La aguja se inserta en el fondo de saco vestibular ligeramente mesial al diente por anestesiar, llevarla hasta tocar hueso hacia el ápice del diente, donde se deposita el anestésico. Generalmente un cartucho anestésico (1.8 ml) es 39 suficiente, aunque frecuentemente es necesaria más anestesia que para una extracción dental. La anestesia palatina para los dientes maxilares, no es necesaria en la mayor parte de los casos de la terapia endodóntica, aunque en ocasiones se utiliza como refuerzo. A pesar del cuidado puesto en la técnica, si no se consigue la anestesia completa, puede ser necesario colocar una inyección subperióstica, insertando la aguja cerca del ápice radicular, por debajo del periostio y depositando lentamente 0.5 ml de solución. 4.4 BLOQUEO REGIONAL (DE CONDUCCIÓN O BLOQUEO NERVIOSO) La solución anestésica local se deposita cerca de un tronco nervioso principal, generalmente alejado del área que va a ser intervenida. Se habla también del bloqueo de campo que se diferencia del bloqueo nervioso por la extensión del área anestesiada. Por regla general, los bloqueos de campo son más circunscritos y anestesian los tejidos alrededor de una o dos piezas dentarias, mientras que los bloqueos nerviosos afectan a zonas más extensas, por ejemplo, el área anestesiada tras el bloqueo del nervio infraorbitario o del nervio alveolar inferior. La consecución de una anestesia adecuada en el maxilar superior no suele constituir un problema, excepto en aquellos casos en los que existan anomalías anatómicas o estados patológicos. El hecho de que los ápices de las raíces de las piezas dentarias se encuentren cubiertos por un hueso menos denso y el acceso relativamente sencillo a los troncos nerviosos proporcionan al profesional dental bien formado tasas de éxito del 95% o superiores. 40 No ocurre lo mismo en la mandíbula del adulto. La anestesia pulpar de los dientes mandibulares es más difícil de conseguir de manera sistemática, lo que queda demostrado por el hecho de que las tasas de éxito del bloqueo del nervio alveolar inferior, la inyección mandibular que se emplea con mayor frecuencia, son del 80-85%. Los motivos que justifican la menor tasa de éxito comprenden la mayor densidad de la cortical alveolar bucal (lo que impide la inyección supraperióstica en el paciente adulto), el acceso limitado al nervio alveolar inferior y las frecuentes variaciones anatómicas. Esta es la razón para el estudio de múltiples técnicas para el bloqueo del nervio dentario inferior que el estudiante debe conocer para minimizar los fracasos. 4.5 TÉCNICAS DE REFUERZO O SUPLEMENTARIAS EN ENDODONCIA Lograr una anestesia local exitosa es un reto continuo para el dentista. Las técnicas de refuerzo y su instrumental son frecuentemente ofrecidos en el mercado como una panacea pero también tienen sus inconvenientes y complicaciones, por lo que es necesario conocerlas profundamente. La ineficiencia en la anestesia local en áreas de inflamación puede ser el resultado de un aumento en la actividad nerviosa periférica o una disminución del pH de los tejidos inflamados que permite que solo unas cuantas moléculas de anestésico alcancen el nervio y por tanto se evita la anestesia total. Por tanto las técnicas suplementarias tienen un lugar en la práctica de la endodoncia. 4.6 ANESTESIA INTRAPULPAR Esta inyección directa solo puede administrarse si existe una exposición pulpar lo suficientemente grande para que penetre la aguja, pero lo 41 suficientemente pequeña para que la solución no ser regrese sin penetrar a la pulpa. Este problema en comunicaciones grandes puede remediarse introduciendo la aguja hasta que llene el lumen del conducto totalmente, siendo necesario en ocasiones doblar la propia aguja para penetrar a los conductos. Una o dos gotas de solución anestésica depositadas rápidamente en la pulpa resultan en una anestesia inmediata y efectiva. Birchfield y Rosenberg encontraron que no era importante si se utilizaba anestesia o suero salino estéril para la anestesia intrapulpar siempre y cuando la solución se introdujera bajo presión en la pulpa. 4.7 INYECCIÓN EN EL LIGAMENTO PERIODONTAL (INYECCIÓN INTRALIGAMENTARIA) La inyección intraligamentaria es utilizada para aumentar la anestesia dental incompleta. Está considerada una inyección intraósea, debido a la distribución del agente anestésico en los espacios medulares adyacentes al ligamento periodontal. En algunos pacientes causa una disminución transitoria en la presión sanguínea y aumento en el ritmo cardiaco. Estos cambios cardiovasculares se manifiestan clínicamente como palpitaciones y ansiedad. Esta inyección no es recomendable para pacientes con padecimientos cardiovasculares. 4.8 INYECCIÓN INTRASEPTAL La inyección intraligamentaria es utilizada para aumentar la anestesia dental incompleta. Está considerada una inyección intraósea, debido a la distribución del agente anestésico en los espacios medulares adyacentes al ligamento periodontal. En algunos pacientes causa una disminución transitoria en la presión sanguínea y aumento en el ritmo cardiaco. Estos 42 cambios cardiovasculares se manifiestan clínicamente como palpitaciones y ansiedad. Esta inyección no es recomendable para pacientes con padecimientos cardiovasculares. 4.9 INYECCIÓN INTRAÓSEA La aguja debe ser avanzada con firmeza en la cortical ósea en el hueso intraseptal hacia distal del diente por anestesiar. Puede haber una considerable resistencia al avance del émbolode. La facilidad de administración significa por lo general que la aguja está situada en tejidos blandos y no en hueso. Debe descargarse suficiente solución para alcanzar las fibras periodontales (se recomiendan aproximadamente 0.3 a 0.5 ml). Su proporción de éxitos no es tan alta. 43 Capítulo 5.- OBTURACION DEL CONDUCTO Y CONDENSACION LATERAL 5.1 INTRODUCCIÓN La endodoncia abarca muchos aspectos, cuando se trata de la endodoncia práctica, el debridamiento total del espacio pulpar, la creación de un selle apical y la obturación completa del sistema de conductos radiculares constituyen los objetivos principales. Es importante que el operador tenga los conocimientos y la habilidad para lograr a la perfección cada uno de estos objetivos, una vez más, cabe mencionar que la inadecuada instrumentación y conformación de los conductos radiculares influirá en la obturación de estos, por tanto en el selle y el éxito del tratamiento. Una de las principales metas de la terapia endodóntica, es la obturación tridimensional del sistema de conductos radiculares, esto significa que el diente debe pasar a un estado lo más inerte posible para el organismo, impidiendo la reinfección y el crecimiento de los microorganismos que hayan quedado en el conducto, así como la creación de un ambiente biológicamente adecuado y tenga lugar la cicatrización de los tejidos. Se han desarrollado muchos materiales y técnicas para conformar la obturación de los conductos radiculares, el objetivo es la obliteración total del espacio radicular. Históricamente se habla de la utilización del oro, oxicloruro de zinc, parafina, amalgamas, plumas, puntas de plata, pastas a base de óxido de zinc y eugenol, pastas yodoformadas, con diversos grados de éxito y satisfacción. Sin embargo, el material de elección es la gutapercha ya que ha demostrado propiedades físicas y químicas aceptables así como toxicidad 44 e irritabilidad mínima. Es por ello que en esta revisión solamente se abarcará dicho material. Se han propuesto numerosas técnicas de obturación, como la condensación lateral con gutapercha fría y sus variaciones, cono único, técnica de condensación vertical propuesta por Schilder, técnica con vástagos plásticos o metálicos cubiertos por gutapercha, técnica termomecánica y las de inyección termoplastificada. Todas y cada una de ellas han reportado ventajas y desventajas cuando se comparan entre ellas, sin embargo, todo dependerá de la comodidad y habilidad del operador para llevarlas a cabo. Es imposible determinar la complejidad del sistema de conductos radiculares tanto clínica como radiográficamente. Esto nos presenta muchas dificultades en el momento de la limpieza y obturación, ya que está comprobado que la persistencia de restos orgánicos y bacterias en las irregularidades pueden interferir en los resultados del tratamiento endodóntico. El propósito de este artículo es, recopilar en la literatura los aspectos de la obturación del sistema de conductos radiculares sus principios, materiales y técnicas. 5.2 PRINCIPIOS DE LA OBTURACIÓN Es muy importante mencionar que la obturación debe conformarse tridimensionalmente (Schilder 1967) y que esta dependerá significativamente de la calidad de la limpieza y conformación del canal, así como de los materiales utilizados, su uso y la interpretación radiográfica del proceso. La inhabilidad para rellenar el conducto en tres dimensiones consistirá en la formación de espacios tanto apical como coronalmente o internamente dentro de la masa de gutapercha, produciendo vías de filtración, que 45 favorecerán el crecimiento bacteriano o la reinfección. Lo anterior está confirmado por el estudio de Washington, realizado por Ingle el cual aborda los éxitos y fracasos endodónticos, sugiriendo que la incompleta obturación del conducto constituye la principal causa de fracaso endodóntico en un 60%. Cuál debe ser la extensión adecuada de la obturación del conducto radicular, ha sido tema de discusión desde siempre. Se sabe que los límites anatómicos del espacio pulpar son la unión cementodentinaria en la parte apical y la cámara pulpar en la porción coronal. Kuttler, claramente demostró que la unión de la dentina con el cemento se encuentra a 0.5 - 0.7 mm de la superficie externa del agujero apical y que más allá de esto continúan las estructuras periodontales. Es por ello que desde hace más de 50 años aproximadamente, se prescribe que este sea el límite hasta donde debe extenderse la obturación del conducto radicular. Sin embargo, muchos no están de acuerdo con esta afirmación, y prefieren obturar hasta la superficie externa radiográfica de la raíz o después de esta, con el fin de producir una pequeña sobre obturación Periapical. Los objetivos de la obturación se resumen en eliminar todas las filtraciones provenientes de la cavidad oral o de los tejidos periapicales en el sistema de conductos radiculares y sellar dentro del sistema todos los agentes irritantes que no puedan eliminarse por completo durante el procedimiento de limpieza y conformación del canal. La razón fundamental es que está comprobado que la eliminación parcial del tejido pulpar, los microorganismos y sus productos son la principal causa de la necrosis pulpar y la posterior extensión al tejido periapical. Previo a la obturación de los conductos, algunos recomiendan la remoción 46 del barrillo dentinario, que no es más que la combinación de detritos orgánicos e inorgánicos presentes en las paredes del canal seguido al debridamiento. Técnicamente este barrillo impide la penetración y adhesión del material obturador dentro de los túbulos dentinarios, por lo que la retención o remoción de este, puede influir la calidad de la obturación. Se han realizado numerosos estudios sobre la microfiltración a través de la obturación de los conductos radiculares, para esto se han utilizado diferentes métodos como la penetración de tintas, radioisótopos, penetración bacteriana, etc. En un estudio realizado con dos diferentes métodos (penetración de tinta china y bacteriana) se demostró la presencia de filtración bacteriana en casos obturados con técnicas de gutapercha termoplastificada y sin remoción del barrillo dentinario, a diferencia de aquellos obturados en ausencia de este. Un conducto radicular puede obturarse cuando se ha ensanchado lo suficiente, no existe evidencia de exudado o hemorragia y se encuentra asintomático. Aunque si la molestia es leve se hace una excepción a esta última norma. Es importante recalcar la realización de un buen selle coronal, posttratamiento endodóntico, escogiendo un adecuado cemento temporal, que no permita la filtración hacia los conductos radiculares, asi como el interés por parte del paciente y del operador en enfatizar la importancia en realizar la restauración definitiva a la menor brevedad posible. 5.3 MATERIALES DE OBTURACIÓN Grossman, clasificó los materiales de obturación en: plásticos, sólidos, cementos y pastas. Este autor reiteró en 1940 la propuesta de Brownlee de 1900, sobre los requisitos para un material de obturación ideal: 47 • No irritar el tejido periapical. • Fácil de introducir en el conducto radicular. • Sellar herméticamente, lateral y verticalmente. • Volumen estable. • No contraerse después de insertarse. • Bacteriostático, o al menos no favorecer el crecimiento bacteriano. • Biológicamente compatible y no tóxico. • Debe estar rápidamente disponible y ser fácil de esterilizar antes de su uso. • No teñir la estructura dentaria. • Radiopaco. • Fácil remoción, si fuese necesario. La gutapercha por si sola no puede asegurar un selle hermético, por lo que para todas las técnicas de obturación se acompaña del uso de un cemento sellador. En cuanto a los cementos selladores también se han propuesto muchos, se dispone de aquellos a base de óxido de zinc y eugenol, hidróxido de calcio, resinas epóxicas, ionómeros de vidrio y siliconas. Grossman enumeró requisitos y características de un sellador ideal e Ingle propuso dos más: • Debe tener buena adhesión entre el material y la pared del conducto al fraguar. • Formar un sellado hermético. • Radiopaco. • Partículas del polvo finas para que se puedan mezclar fácilmente con el líquido. • No debe encogerse al fraguar. • No manchar las estructuras dentarias. • Bacteriostático o al menos no favorecer la reproducción de bacterias. 48 • Fraguar con lentitud. • Insoluble en los líquidos bucales. • Biocompatible y no irritante para los tejidos periapicales • Soluble en un solvente común, por si fuese necesario retirarlo. • No ha de generar una reacción inmunitaria. • No debe ser mutagénico, ni carcinogénico. Estos requerimientos ideales no los cumple una sola formulación, es por ello que existe una gran cantidad de materiales y técnicas para la obturación de conductos radiculares. 5.4 GUTAPERCHA Se considera el material de elección, sin importar el método que se utilice para obturar el sistema de conductos radiculares. La gutapercha fue introducida en Gran Bretaña como una curiosidad exótica. Antes de su uso en odontología, se utilizaba en la industria para la fabricación de corcho, fibras o hilos, instrumentos quirúrgicos, ropa, pipas, protección para buques, tiendas, sombrillas, pelotas de golf y para reemplazar papel. Por su inalterabilidad en agua fría, especialmente en agua salada durante el siglo IX fue utilizado como aislante para los cables del telégrafo. Luego su uso fue descartado en la industria ya que tuvo mayor éxito la vulcanización del caucho que la gutapercha. Es por ello que su plasticidad y relativa baja temperatura se situaban mejor en otras situaciones, y fueron estas cualidades las que llamaron la atención en odontología y se conoce en esta área desde hace más de 100 años. Hill, en 1847 desarrolló la primera gutapercha o “empaste de Hill” como material para obturar el canal radicular, patentándola en 1848. Ya en 1867 49 Bowman la propuso, como material de primera elección. Esta reportado por Perry en 1883, su uso combinando alambres de oro cubiertos por gutapercha o tiras de gutapercha enrolladas en puntas y empaquetadas en el canal radicular. En 1887 se comenzó a fabricar las primeras puntas de gutapercha por la S.S., White Company y a proponerse diferentes formulaciones, pero fue con la introducción de las radiografías, que surgió la necesidad de adicionar un material que rellenara los espacios vacíos y se pensó en el uso de cementos selladores, para lo cual surgieron los compuestos fenólicos o derivados del formaldehído. En 1914 Callahan, propuso el reblandecimiento y la disolución de la gutapercha y de ahí en adelante surgieron muchos materiales propuestos como agentes selladores utilizados junto con la gutapercha. La gutapercha es un polímero orgánico natural con un peso molecular de 104 hasta 106. Este producto es producido por los árboles de la familia Sapotaceae, principalmente del género Palaquium o Payena, originario de las islas del Archipiélago Malayo. La gutapercha químicamente pura existe de dos formas cristalinas: alfa y beta y pueden ser convertidas una a la otra y viceversa dependiendo de la temperatura. En cuanto a las propiedades físicas, existen muy pocas diferencias, se relaciona más a los diferentes niveles de enfriamiento a partir del punto de fusión. La forma alfa proviene directamente del árbol, aunque la forma disponible como se encuentra comercializada es la estructura beta. Actualmente se está adoptando la forma cristalina alfa, debido a que la fase alfa sufre una menor contracción y las presiones durante la compactación, pueden compensar 50 mejor cualquier contracción que se produzca. Este cambio parece lógico, ya que al calentar la fase beta (37°C), la estructura cambia a alfa (42 °C - 44°C) y finalmente a una mezcla amorfa (56 °C- 64 °C) y como consecuencia la gutapercha sufre una contracción o encogimiento significativo. La composición química de la gutapercha, varia dependiendo la casa fabricante. Normalmente, tienen entre un 19-22% de gutapercha, 59-75% de óxido de zinc y en pequeños porcentajes ceras y resinas, agentes colorantes, antioxidantes y sales metálicas. Se ha comprobado que los altos índices de óxido de zinc le confieren una actividad antimicrobiana o como mínimo inhiben el crecimiento bacteriano. En un estudio realizado por la Universidad de NorthWestern se encontró que este contenido incrementa la fragilidad de los conos y reduce su resistencia a la tensión a diferencia de otro estudio que reporta que el contenido de gutapercha es el que le confiere fragilidad a las puntas. La gutapercha se encuentra disponible en forma de conos con tamaños estandarizados (siguen las normas de la ISO con respecto a las limas) y no estandarizados (extra-fino, fino-fino, medio-fino, fino-medio, medio, medio, medio-grande, grande y extra-grande). Estos últimos se utilizan como accesorios en algunas técnicas de obturación, sin embargo son los de primera elección en la técnica de compactación vertical con gutapercha reblandecida con calor. Existen otras formas disponibles dependiendo la técnica de obturación, pueden ser en forma de bolitas o de cánulas (técnica termoplastificada) y otras en formas de jeringas calentables (termomecánica). La gutapercha como material de obturación, presenta muchas ventajas: facilidad de compactación y su adaptación a las irregularidades del conducto, puede ser reblandecida con calor o solventes químicos (xilol, cloroformo, 51 benceno), es inerte, buen estabilidad dimensional, no alergénico, radiopaco y de remoción fácil. Pero también presenta desventajas como la carencia de rigidez y adherencia, y la necesidad de tope apical ya que puede ser desplazada fácilmente mediante presión. Indicaciones para el uso de gutapercha, como material de obturación de conductos radiculares: 1. En dientes que requieran núcleo, para el refuerzo de la restauración coronaria. 2. Siempre que se trabaje con paredes irregulares o configuraciones no circulares (ovalada, en forma de riñón, en "moño") ya sea debido a la anatomía del conducto o como resultado de la preparación. 3. Cuando se prevee la presencia de un conducto lateral o accesorio y cuando se determina la presencia de foraminas apicales múltiples o en casos de resorción interna. 4. En conductos extremadamente anchos, porque es posible fabricar un cono de gutapercha adaptado al caso individual tratado. La obturación de los conductos radiculares con gutapercha y un sellador es el método biológicamente más adecuado y más seguro a largo plazo. Existen diferentes técnicas de aplicación de la gutapercha como la técnica de cono único, cono seccionado, condensación lateral, vertical, termomecánica y las termoplastificadas. 5.5 TÉCNICA DE CONDENSACIÓN LATERAL O COMPACTACIÓN LATERAL EN FRIO Por su eficacia comprobada, sencillez, control del límite apical de la obturación y el uso de un instrumental simple han determinado la preferencia de su elección, convirtiéndose en la técnica más utilizada. Es eficaz para casi 52 todos los conductos radiculares y requiere una preparación de estos en forma de embudo con una matriz apical sobre dentina sana. Esta técnica ha sido utilizada por mucho tiempo y ha sido el patrón con el que se comparan otras técnicas. 5.6 Resumen de la técnica: 1. Una vez concluida la instrumentación y conformación del conducto correctamente, se irriga y se seca con puntas de papel. 2. Se elige un cono o punta de gutapercha estandarizada del mismo calibre que la lima más amplia que fue utilizada hasta la longitud de la conductometría (lima apical principal) y el cono principal se desinfecta con hipoclorito de sodio. 3. Se introduce el cono principal al conducto hasta la longitud de trabajo y se verifica visualmente su ajuste o agarre apical (sensación de resistencia táctil) y radiográficamente. (Conometria) 4. Se marca o se corta el cono de gutapercha a nivel del borde oclusal externo. 5. Se mezcla el cemento sellador y se coloca en el conducto mediante lima, léntulo, instrumental ultrasónico o también barnizando el cono principal y/o punta de papel. La consistencia del sellador debe ser filamentosa o según las especificaciones del fabricante. La cantidad que se introduce es tal que la pared del conducto quede recubierta en su totalidad. Se coloca el cono principal firmemente hasta que llegue a la longitud de trabajo. 6. Colocación del cono principal e inserción del espaciador a 0.5 -1 mm de la conductometria. Una vez se alcance esta longitud el cono principal esta 53 condensando lateral y verticalmente moviendo el instrumento en un arco aproximado de 180°, en los canales curvos se reduce el movimiento del espaciador dependiendo el grado de curvatura, se compacta el cono hacia el lado de la curvatura creando un espacio para los conos accesorios. La elección de los conos se basa en el tamaño del espaciador utilizado. El instrumento elegido debe alcanzar la longitud de trabajo. En caso de conductos curvos, los espaciadores de acero inoxidable deben precurvarse o mejor aún utilizar de níquel- titanio. 7. Utilizando un espaciador, se produce lateralmente lugar para introducir una punta de gutapercha accesoria (estandarizada o no estandarizada) con un poco del cemento sellador. Este paso se repite hasta que se llena el conducto y el espaciador pueda penetrar solo 2-3 mm en la entrada del conducto. 8. Se toma una radiografía (prueba de la obturación o penacho) con objeto de verificar si existen espacios o sobre obturación. En caso de estar todo correcto, se continúa con los pasos siguientes. 9. Se corta el exceso de los conos de gutapercha (penacho sobresaliente de la cámara pulpar) a nivel de la unión cemento-esmate, con un instrumento caliente o un dispositivo especial de calentamiento (Touch n’ Heat) haciendo condensación vertical con el lado obturador del mismo. 10. Limpiar la cámara pulpar de los restos de cemento sellador y gutapercha, varios autores proponen humedecer una torunda en cloroformo o xilol para completar la limpieza. 11. Sellar la cámara pulpar con un cemento temporal para posteriormente restaurarlo definitivamente. 54 12. Retirar el dique de hule y tomar dos radiografías finales (ortorradial y distoradial). Es muy importante tener en cuenta escoger el espaciador adecuado, los espaciadores digitales según las normas ISO proveen una obturación homogénea y hermética, seguramente debido a la libertad de movimiento y rotación de éste. En un estudio realizado por Dang y Walton en 1989, demostraron que los espaciadores cónicos causan cuatro veces más deformaciones con expansión de la dentina que los espaciadores digitales estandarizados. También esta descrito que los conductos radiculares obturados con puntas de gutapercha de calibre 25 y con espaciadores digitales eran claramente homogéneos y no mostraban sobre obturación o formación de pliegues, al contrario de las puntas no estandarizadas fina-fina donde se ha encontrado sobre obturación en un 30%, huecos y alta de homogeneidad. Ver anexo fig. 5 pág. 107 Caso clínico de endodoncia y obturación lateral editorial MASSON. Existen variantes de la técnica de obturación con condensación lateral: • Condensación lateral con gutapercha fría plastificada químicamente o técnica de impresión directa. La variante consiste en el empleo de un solvente (cloroformo, eucaliptol, etc.) para reblandecer el cono principal y asi asegurar que ese adapte mejor a las aberraciones en la porción apical del conducto, por lo tanto proveer un mejor selle a dicho nivel. Es entonces cuando se conoce la gutapercha en forma de cloropercha y eucapercha. 55 • Obturación con condensación lateral solo en tercio apical y la porción coronal con segmentos de gutapercha caliente o con la inyección de gutapercha termo plastificada o compactación termomecánica, todas las formas compactadas verticalmente. 56 Capitulo.- 6 Bioseguridad en odontología 6.1 INTRODUCCION Las normas de bioseguridad están destinadas a reducir el riesgo de transmisión de microorganismos de fuentes reconocidas o no reconocidas de infección en Servicios de Salud vinculadas a accidentes por exposición a sangre y fluidos corporales. Los objetivos de estas recomendaciones son establecer: 1. Las medidas de prevención de accidentes del personal de salud que está expuesto a sangre y otros líquidos biológicos. 2. La conducta a seguir frente a un accidente con exposición a dichos elementos. Se debe tener presente que debido al desarrollo científico técnico se deben preveer revisiones periódicas de estas normas a los efectos de asegurar la actualización de las mismas. Tanto los Cirujano Dentistas y el personal de Salud son quienes están más expuestos a contraer las enfermedades infectocontagiosas como el SIDA, la hepatitis B, la tuberculosis, el herpes y las infecciones por virus hominis. El consultorio odontológico es uno de los ambientes en los que el paciente y el profesional pueden adquirir estas enfermedades si no se toma en consideración los fundamentos de Bioseguridad. A comienzo de la década de los 80 surge primero en forma aislada y luego en forma de pandemia la infección por VIH. Desde entonces esta ha despertado gran interés en todos los profesionales de la salud especialmente en el campo de la odontología" debido a su prevalencia en aumento y a su modo de contagio. 57 Desde el punto de vista de posibilidad de contagio por un agente infeccioso, la enfermedad que más debe preocupar a la profesión Odontológica es la infección por el virus de la hepatitis B se estima que en el mundo hay más de 200 millones portadores asintomático con este virus, existiendo varios informes de odontólogos y técnicos de laboratorio que han sido infectados por haberse expuesto a materiales contaminados. Así, está comprobado que varios casos de infecciones en el personal de salud ha ocurrido por contacto accidental con sangre, material contaminado con este virus. La aparición de estas infecciones entre otras ha tenido gran impacto sobre la práctica odontológica y la salud publica. Además representa reto a la profesión, ya que obliga a reeducar y reevaluar los conocimientos y los métodos de atención la meta principal de estos cambios es una educación apropiada que lleve a que el odontólogos conozca las manifestaciones de estas infecciones y las normas para evitar su contagio durante la atención odontológica. Uno de los cambios que se han dado en la profesión, ha sido la adopción de nuevas reglas del control de infecciones que aseguren que el riesgo de transmisión de estas durante la atención odontológica sea mínimo. 6.2 BIOSEGURIDAD CONCEPTO: Es el conjunto de medidas preventivas que tienen como objeto proteger la salud y seguridad personal de los profesionales de salud y pacientes frente a los diferentes riesgos producidos por agentes biológicos, físicos, químicos y mecánicos. 58 Estas normas nos indican cómo hacer para cometer menos errores y sufrir pocos accidentes y, si ellos ocurren, cómo debemos minimizar sus consecuencias. Bioseguridad debe entenderse como una doctrina de comportamiento encaminada a lograr actitudes y conductas que disminuyan el riesgo del trabajador de la salud de adquirir infecciones en el medio laboral. Compromete también a todas aquellas otras personas que se encuentran en el ambiente asistencial, éste ambiente debe estar diseñado en el marco de una estrategia de disminución de riesgos. Para evitar la propagación de las enfermedades o contagiarnos debemos Interrumpir el proceso de transmisión de las mismas. Entonces es preciso tomar medidas protectoras tanto para protegernos coma para proteger a las personas que están bajo nuestro cuidado. Durante el trabajo es esencial tener en cuenta los principios básicos de bioseguridad. 6.3 LOS PRINCIPIOS DE BIOSEGURIDAD A) Universalidad: Implica considerar que toda persona puede estar infectada. Asimismo, considerar todo fluido corporal como potencialmente contaminante. Las medidas deben involucrar a todos los pacientes de todos los servicios, independientemente de conocer o no su serología. Todo el personal debe seguir las precauciones estándares rutinariamente para prevenir la exposición de la piel y de las membranas mucosas, en todas las situaciones que puedan dar origen a accidentes, estando o no previsto el contacto con sangre o cualquier otro fluido corporal del paciente. Estas precauciones, deben ser aplicadas para TODAS las personas sin excepción ni distinción, independientemente de presentar o no patologías. B) Uso de barreras: Comprende el concepto de evitar la exposición directa a sangre y otros fluidos orgánicos potencialmente contaminantes, mediante la 59 utilización de materiales adecuados que se interpongan al contacto de los mismos. La utilización de barreras (ej. guantes) no evitan los accidentes de exposición a estos fluidos, pero disminuyen las consecuencias de dicho accidente. C) Medios de eliminación de material contaminado: Comprende el conjunto de dispositivos y procedimientos adecuados a través de los cuales los materiales utilizados en la atención de pacientes, son depositados y eliminados sin riesgo de contagio por mal manejo de estos. 6.4 DEFINICIÓN DE TERMINOS TRANSMISIÓN.- Contagio por medios directos e indirectos. ASEPSIA.- Ausencia de infección. SALUD.- Estado optima biopsicosocial de acuerdo a las capacidades de una persona. NORMA EN BIOSEGURIDAD.- conjunto de reglas establecidas para conservar al salud y seguridad del personal paciente y comunidad frente a los riesgos de infección. ANTISEPSIA.- Inhibición patogénica de los microorganismos para evitar infección. BARRERA.- Obstáculo para evitar la transmisión de una infección. Infección.- Acto de adquirir una enfermedad contagiosa Esterilización.- Término genérico que significa la eliminación de todas las formas de material viviente incluyendo bacterias, virus, esporas y hongos. Por lo general incluyen sistemas de calor o radiación. Constituye el procedimiento a seguir con los instrumentos invasivos (instrumental quirúrgico y material que va a ser introducido al cuerpo del paciente. 60 Desinfección.- Término genérico que implica que la mayor parte de microorganismos patógenos son eliminados pero con frecuencia permanece los no patógenos o las formas resistentes de éstos. Por lo general incluye agentes químicos. Constituye el procedimiento a seguir en artículos que no requieran necesariamente un proceso de esterilización tales como las superficies de trabajo de la unidad dental. Niveles de Desinfección Este proceso se divide en tres niveles: • Desinfección de Bajo Nivel: No elimina esporas bacterianas ni al Mycobacterium tuberculosis. • Desinfección del Nivel Intermedio: Elimina al Mycobacterium pero no las esporas bacterianas. • Desinfección de Alto Nivel (D.A.N.): Elimina al Mycobacterium tuberculosis virus, hongos y algunas esporas. El instrumental no invasivo requiere un nivel de Desinfección Alto – Intemedio, mientras que el material ambiental requiere un nivel de Desinfección Bajo – Intermedio. Antiséptico.- Agente que inhibe pero no necesariamente destruye microorganismos. Actúa sobre tejidos vivos. Descontaminación.- Es un pretratamiento necesario para su protección cuando se manipulan materiales potencialmente contaminados 6.5 RECOMENDACIONES PRACTICAS PARA DESARROLLAR ACTIVIDADES VINCULADAS A LA ASISTENCIA DE PACIENTES Manejo de materiales corto-punzantes como aguja, bisturí, instrumentos puntiagudos, láminas, etc. Para evitar accidentes laborales, es obligatorio desechar los materiales corto-punzantes en descartadores luego de su uso. se recomienda: 61 • No reencapuchar las agujas. • No doblarlas. • No romperlas. • No manipular la aguja para separarla de la jeringa. • De ser posible usar pinzas para manipular instrumentos cortopunzantes. • Los recipientes descartadores deben estar lo más próximo posible al área de trabajo. Agujas y jeringas Se deberán usar materiales descartables. Las jeringas y agujas usadas deben ser colocadas en recipientes descartadores. Las agujas no deben ser dobladas ni se les debe colocar el capuchón protector y éste debe desecharse en el mismo momento en que se retira de la aguja estéril. Descartadores Se considera descartadores al recipiente donde se depositan, con destino a su eliminación por incineración, todos los materiales corto punzantes. Estos descartadores no deben bajo ninguna circunstancia ser reutilizados. El descartador debe estar hecho con material resistente a los pinchazos y compatible con el procedimiento de incineración sin afección del medio ambiente. Es recomendable que los descartadores tengan asa para su transporte y que la misma permita manipularlo lejos de la abertura del descartador. La abertura debe ser amplia de forma tal que al introducir el material descartado, la mano del operador no sufra riesgo de accidente. El descartador debe tener tapa para que cuando se llene hasta las tres cuartas partes del volumen del mismo, se pueda obturarlo en forma segura. Los descartadores deben ser de color amarillo y tener el símbolo de material infectante y una inscripción advirtiendo que se manipule con cuidado. Deberá 62 tener dicha inscripción y símbolo, de dimensiones no menores a un tercio de la altura mínima de capacidad del recipiente y con dos impresiones, de forma de visualizarlo fácilmente desde cualquier posición. Material de curaciones (gasas, torundas) Luego de su uso deberán colocarse en una bolsa de plástico (de color amarillo) que se cerrará adecuadamente previo a su incineración directa o envío como residuo hospitalario. Limpieza diaria Todo el ambiente asistencial debe ser higienizado con agua y detergentes neutros, utilizando utensilios de limpieza que al tiempo de facilitar la tarea protejan al trabajador. En caso de existir sangre y fluidos corporales, se indica el tratamiento local previo con uso de compuestos clorados. El personal de servicio deberá usar uniformes adecuados con guantes de limpieza y demás utensilios (equipamiento de protección individual 6.6 LIMPIEZA Y DESINFECCION DE MATERIALES Y EQUIPO CLASIFICACION DE MATERIALES a. CRÍTICOS Los materiales o instrumentos expuestos a áreas estériles del cuerpo deben esterilizarse. Ej. Instrumental quirúrgico y/o de curación. b. SEMI CRÍTICO Los materiales o instrumentos que entran en contacto con membranas mucosas pueden esterilizarse o desinfectarse con desinfectantes de alto nivel (glutaraldehído). Ej. Equipo de terapia ventilatoria, Endoscopios, Cánulas endotraqueales, Espéculos vaginales de metal. 63 c. NO CRÍTICO Los materiales o instrumentos que entran en contacto con la piel íntegra, deben limpiarse con agua y jabón y desinfectarse con un desinfectante de nivel intermedio o de bajo nivel. Ej. Esfignomanómetros, Vajilla, Chatas y violines, Muebles, Ropas. Los artículos críticos, semicriticos y no críticos deben ser limpiados mediante acción mecánica utilizando agua y un detergente neutro o enzimático. Todos los materiales, luego de ser usados deberán ser colocados en inmersión en un detergente enzimático o neutro durante un mínimo de 5 minutos, posteriormente cepillados y enjuagados en agua potable corriente a los efectos de retirar todo resto de materia orgánica presente. Luego secados y de acuerdo a la categorización del material deben ser esterilizados o desinfectados. Los críticos deben ser esterilizados, los semicríticos pueden ser procesados con desinfectantes de alto nivel (ej. glutaraldehído al 2% en un tiempo mínimo de 20 minutos) y los no críticos mediante desinfección de nivel intermedio o de bajo nivel. 6.7 CRITERIOS PARA DESINFECCIÓN DESCONTAMINACIÓN, LIMPIEZA, DESINFECCIÓN Descontaminación.- Es un pretratamiento necesario para su protección cuando se manipula materiales potencialmente contaminados. Debe utilizar detergentes enzimáticos y luego desinfectantes. Puede usar cloro al 0.5%, fenol al 5%, peroxido de hidrógeno al 6%, glutaraldehido, formaldehído, etc. El glutaraldehido es lo más recomendable para instrumental metálico. 64 Limpieza.- Es la eliminación física de la sangre, fluidos corporales ó cualquier otro material extraño visible (polvo ó suciedad) de la piel ó de los objetos inanimados Es necesario limpiar concienzudamente con agua y detergente; los cepillos dentales duros son adecuados para eliminar el material orgánico de los equipos e instrumentos. Con este paso se eliminará la mayoría de los microorganismos (hasta un 80%) Desinfección química.- Para conseguir un DAN (Desinfección de Alto Nivel) remojar los artículos en un desinfectante químico de alto nivel por 20 minutos y después enjuagarlos bien con agua estéril o hervida. Desinfectantes Químicos: - Soluciones de cloruro.- Inactivan todas las bacterias, virus, parásitos y algunas esporas. Son poco costosas, de fácil disponibilidad y actúan con rapidez. Son muy eficaces contra el virus de Hepatitis B y el VIH ( virus del SIDA) Puede descontaminar grandes superficies como mesas de exámenes Procedimiento: • Usar solución de cloro al 0.1% en agua potable • Las superficies (mesas, camillas, sillones dentales, etc.), frótelas prolijamente con un trapo embebido en la solución, dejar actuar unos 10 minutos y luego volver a limpiar • Reemplace la solución diariamente ó con mayor frecuencia, porque pierde su potencia con el tiempo y exposición solar. Formaldehído al 8%.- Puede utilizarlo en sus formas liquida ó gaseosa, tanto para DAN como para esterilización química 65 No es inactivado con facilidad por los materiales orgánicos Un remojo de 24 horas en formaldehído mata todos los microorganismos, incluidas las endosporas bacterianas Puede utilizarlo hasta por 14 días. Reemplácelo antes si se enturbia Glutaraldehido.- Se encuentra en forma alcalina, neutra ó ácida. Los neutros ó alcalinos tienen mayor poder de aniquilación y propiedades anticorrosivas que los ácidos Se usa más comúnmente, el glutaraldehido al 2%, que debe usarse a temperaturas de 25° C (77° F) Para una DAN eficaz, remojar los instrumentos y demás artículos por 20 minutos Para su preparación debe seguir las indicaciones del fabricante El formaldehído y el glutaraldehido son tóxicos, siendo el formaldehído de mayor toxicidad. Debe manejarlos con cuidado. Sus vapores son irritantes para la piel, ojos y el tracto respiratorio Úselos solo en una zona ventilada, utilice guantes y limite el tiempo de exposición Todos los equipos ó instrumentos remojados debe enjuagarlos concienzudamente después con agua hervida o estéril Nunca mezcle formaldehído con cloro pues al combinarse forman un gas tóxico (eter bisclorometílico) Desinfectantes de uso común DESINFECTANTE CARACTERÍSTICAS 66 OBSERVACIONES CLORO (Lejía) Económico, fácil uso Corrosivo para Util para grandes metales superficies Cambiar cada día Tóxico FORMALDEHÍDO (Paraformaldehído, formol) Poco activo a Util para DAN y temperatura menor a esterilización química 20°C Cambiar cada 14 días GLUTARALDEHIDO Recomendable para Tóxico Cidex, Aldehídex, esterilización química y Cambiar cada 14 días Microbiex, Glutarex) DAN (antes si se enturbia) 6.8 CRITERIOS PARA ESTERILIZACIÓN Esterilización por Medios Físicos: Puede conseguirse por calor o por radiación (lámparas de rayos ultravioleta comúnmente han resultado no ser efectivas contra VIH). El sistema de elección en Estomatología es la esterilización por calor húmedo ó seco Calor Húmedo: Emplea la esterilización por vapor saturado a presión en AUTOCLAVE. Es el método más efectivo y de menor costo para esterilizar la mayoría de los objetos ó materiales, si se realiza correctamente. Requiere una temperatura de 121 C a 1,5 atmósferas (15 PSI) por 15 minutos Calor Seco: 67 Se logra por conducción del calor, desde la superficie externa del artículo hacia las capas internas. Los microorganismos mueren por quemadura lenta de sus proteínas. Demora más que la esterilización a vapor, el calentamiento es más lento sin humedad Usar este método sólo para artículos que puedan soportar una temperatura mayor de 160° C en un tiempo no menor de 60’. Las agujas y los instrumentos con bordes cortantes como: limas para endodoncia, agujas de sutura, deben esterilizarse a temperaturas no mayores a los 160° C. Mayores temperaturas disminuyen el filo de los bordes cortantes. Se recomienda contar el tiempo recién a partir del momento que se alcanza la temperatura deseada. Se recomienda las siguientes relaciones de temperatura / tiempo: 60 minutos 170° 120 minutos 160° Después del enfriamiento, sacar los instrumentos sueltos con pinzas o tenazas estériles y almacenarlos en recipientes cubiertos, igualmente estéril. 6.9 METODOS DE ESTERILIZACIÓN (CUADRO SIMPLIFICADO) METODOS MEDIO OPCIONES Físicos calor húmedo -autoclave a vapor saturado calor seco - horno líquido - inmersión en glutaraldehído 2% 68 - Inmersión en ácido paracético Químicos Gas -gas de oxido de etileno (ETO) - gas de formaldehído - vapor de peróxido de hidrógeno Plasma - plasma de peroxido de hidrógeno - plasma de ácido paracético Nota: La esterilización por autoclave es un método económico y eficaz. Pueden estar al alcance como opciones, el pupinel (horno), el glutaraldehído y el formaldehído. Todos los demás son costosos 6.10 PROCEDIMIENTOS DE DESCONTAMINACIÓN, LIMPIEZA, DESINFECCIÓN Y ESTERILIZACIÓN a. Limpiar los instrumentos manualmente por personal con experiencia empleando guantes gruesos de hule. Antes de su esterilización se restregarán en agua caliente con detergente y se eliminarán todas las huellas de sangre y saliva. b. Se esterilizarán los espejos, exploradores, clamps, portaclamp, talladores, bruñidores, matrices metálicas, portamatrices, jeringas para cartucho, mangos de bisturí, pinzas, portaimpresiones metálicos, perforador de dique, arco de Young, curetas, fresas de carburo tungsteno y diamante, fórceps, elevadores y similar instrumental quirúrgico y de operatoria. c. Las pinzas ortodónticas deberán ser esterilizadas por calor ó desinfectadas con agentes fenólicos transparentes ó clorhexidina en alcohol. 69 d. Deberán ser descartables los vasos de plástico ó papel, agujas para jeringa, cartuchos de anestesia vacíos ó con material sobrante, portaimpresiones plásticos ó material de impresión usado, eyectores de saliva, suturas y agujas. e. Esterilizar en autoclave la gasa, lana de algodón, puntas de papel y lienzos f. Las espátulas y placas de vidrio para mezclar lavarlos con agua caliente y detergente y luego estilizarlos por calor. g. Los pisos del quirófano y superficies generales de trabajo lavarlos con detergente y secarlos diariamente. h. Las lámparas limpiarlos diariamente para retirar el polvo i. El equipo de limpieza (cubetas, trapeadores, ropas, etc) deberá ser enjuagado y almacenado seco. La pieza de mano limpiar con agua y detergente usando escobilla blanda y secarlos con material absorbente antes de ser sumergida en la solución desinfectante por 10 minutos (puede usarse alcohol 70% y otra solución recomendada). Para su esterilización es necesario verificar las especificaciones del fabricante, algunas marcas no pueden ser esterilizadas (en estos casos seguir el procedimiento de desinfección indicado por el fabricante). 6.11 RECOMENDACIONES DE BIOSEGURIDAD EN ODONTOLOGIA: El odontólogo es un profesional universitario, con una sólida formación científico-humanista en cuyo ámbito de acción debe ser capaz de: • Brindar atención odontológica de alta calidad y referir, con prontitud y acierto, a aquellos pacientes que requieren cuidados odontológicos especializados. Además, deberá ejecutar acciones de promoción de Salud 70 y, en lo específico odontológico, participar en prevención de enfermedades, recuperación y rehabilitación de las mismas. Asimismo, deberá adoptar las disposiciones odontológicas y reglamentarias vigentes referidas a normas de salubridad y medio ambiente, conduciéndose según los propios principios éticos y humanistas, que exige el cuidado de la integridad biológica, física y sicológica de los pacientes. Cuando se realizan procedimientos odontológicos de rutina, se pueden causar durante las maniobras pequeños sangrados o incluso no es raro observar sangrados espontáneos. Si tenemos en cuenta además, que la cavidad bucal es portadora de una multiplicidad de agentes microbianos, podemos concluir que el odontólogo puede contaminarse o contaminar accidentalmente. Por esta razón, creemos que el odontólogo debe conocer detalladamente las normas de bioseguridad e incorporarlas a su práctica cotidiana Son válidos entonces para dicha práctica asistencial toda la sistemática anteriormente desarrollada y que por tal razón no se va a reiterar en este capítulo. Creemos conveniente hacer hincapié en los temas siguientes, que no agotan el tratamiento de los mismos, pero que a la luz de los problemas prácticos resultan útiles su consideración especial: 6.12 MECANISMOS DE INFECCIÓN: La infección en la práctica estomatológica puede producirse por los siguientes mecanismos: • Contacto directo con la sustancia infectada (lesión, sangre, saliva) • Contacto directo con objetos contaminados • Salpicaduras de sangre ó saliva, secreciones nasofaringeas sobre la piel ó mucosa sana ó erosionada 71 • Contaminación por aerosoles infectados 6.13PRECAUCIONES EN LA CONSULTA DEL PACIENTE: Considerar los siguientes aspectos en la evaluación del paciente: • En la historia clínica: Referencias sobre la pérdida de peso, procesos infecciosos por bacterias, virus, hongos (con especial énfasis en infecciones por mycobacterium tuberculosis, virus de Hepatitis B, C, Herpes simple y SIDA). • En el examen clínico: presencia de lesiones en piel ó mucosa; linfadenopatías 6.14 RECOMENDACIONES PARA EL TRATAMIENTO DE PACIENTES 1.- LAVADO DE MANOS: Su finalidad es eliminar la flora bacteriana transitoria, reducir la residente y evitar su transporte. Por ello es imprescindible el lavado de manos antes y después de la colocación de los guantes. La medida tiene como fundamento la posible existencia de lesiones y abrasiones que no puedan ser advertidas a simple vista, la presencia de sangre impactada debajo de las uñas del profesional y la posibilidad de perforaciones no visibles sobre la superficie de los guantes. Además deberá incluir al limpieza adecuada del lecho subungueal. Para hacerla efectiva deberá siempre retirarse de las manos todas las alhajas, incluyendo el reloj. 72 Se recomienda soluciones jabonosas que contengan un 4% de Gluconato de Clorhexidina como ingrediente activo debido a su acción residual. Los jabones en barra pueden convertirse en focos de infección cruzada El enjuague debe realizarse con agua fría para cerrar los poros, el secado debe realizarse con servilletas o toallas de papel. Las toallas de felpa pueden convertirse en focos de infección cruzada. Lavarse las manos inmediatamente después de contactar sangre, saliva ó instrumental de operatoria. 6.15 TECNICA DEL LAVADO DE MANOS La técnica de lavarse las manos tiene la siguiente secuencia: 1. subirse las mangas hasta el codo 2. retirar alhajas y reloj 3. mojarse las manos con agua corriente 4. aplicar 3 a 5 mi de jabón líquido 5. friccionar las superficies de la palma de la manos y puño durante 10 o 15 segundos 6. enjuagar en agua corriente de arrastre 7. secar con toalla de papel 8. cerrar la canilla con la toalla. 6.16 GUANTES Se recomienda para el examen clínico guantes descartables no esterilizados. Para procedimientos quirúrgicos se recomienda los descartables esterilizados. Los guantes reusables deben ser gruesos y se emplean solo para el lavado de instrumentos. Los guantes contaminados con sangre u otros fluidos deber ser descartados 73 El lavado de guantes con agentes antisépticos altera la naturaleza del látex y no asegura el arrastre de microorganismos de su superficie. Para ver el gráfico seleccione la opción "Descargar" del menú superior Se debe evitar realizar acciones ajenas a la atención del paciente mientras lleva los guantes puestos. Si el tratamiento no es quirúrgico y debe ser momentáneamente interrumpido para luego continuar con el mismo procedimiento (tomar un frasco, abrir una puerta, contestar el teléfono, hacer una anotación, etc.) son muy útiles las manoplas ó las bolsitas descartables de polietileno superpuestas al guante de látex. Retirar los guantes: • Luego del uso. • Antes de tocar áreas no contaminadas o superficies ambientales. • Antes de atender a otro paciente. Las manos deben ser lavadas inmediatamente después de retirados los guantes para eliminar la contaminación de las mismas que sucede aún con el uso de guantes. 6.17 MASCARILLAS La mascarilla protege principalmente la mucosa nasal y evita su contaminación por aerosoles originados por el instrumental rotatorio del consultorio. Aunque la mascarilla protege la vía nasal y oral, esta última es menos peligrosa pues es la más difícil de transmitir gérmenes patógenos. Entre las mascarillas descartables, el material de elección es la fibra de vidrio ó la mezcla de fibras sintéticas que filtran mejor los microbios que las de papel. 74 Ver anexo pag. Debe encajar cómoda y adecuadamente sobre el puente de la nariz para evitar el empañamiento de los protectores oculares En los procedimientos quirúrgicos la superficie de la mascarilla debe ser considerada material contaminado por lo que debe evitarse su contacto aún con las manos enguantadas. 6.18 PROTECTORES OCULARES Evitan las lesiones oculares causadas por partículas proyectadas hacia el rostro del operador, a la vez que protege contra infecciones considerando que muchos gérmenes de la flora oral normal son patógenos oportunistas. Debido a la dificultad para su esterilización hay que lavarlos entre paciente y paciente con agua, jabón germicida ó soluciones antisépticas. Luego de ser enjuagados deben ser secados con toallas ó servilletas de papel. El procedimiento no debe dañar la superficie del protector. 6.19 VESTIMENTA DEL PROFESIONAL Comprende mandil, pechera y gorro. Tiene por finalidad evitar la introducción de microorganismos en el área de trabajo. Asimismo, evita la contaminación de la ropa normal durante la atención en el consultorio. Los mandiles deben tener manga larga, cuello alto y cerrado. 6.20 ESTERILIZACIÓNACIÓN Y DESINFECCIÓN DEL CONSULTORIO, MATERIALES Y EQUIPO: 75 El local asistencial deberá contar de paredes y pisos de fácil lavado, evitando apliques innecesarios o materiales rugosos o porosos que dificulten la higiene del consultorio. La salivera deberá ser higienizada después de cada paciente eliminando todo tipo de residuos que se pudieran acumular, debiendo utilizar desinfectantes químicos. La mesa de trabajo deberá mantenerse en buenas condiciones de higiene durante toda la jornada de trabajo. Para lograrlo es recomendable colocar sobre el mismo papel descartable, que se cambiará luego de la atención de cada paciente. En dicha mesa de trabajo sólo deberá estar el equipamiento necesario para la atención de cada paciente. Se deberá evitar expresamente que el porta residuos se encuentre en dicha mesa de trabajo. Con relación al foco se debe forrar el mango del mismo con una bolsita de nylon que deberá ser cambiada después de cada paciente. El instrumental deberá ser esterilizado o desinfectado en cajas cerradas o envuelto correctamente en papel, identificando para cada caso la fecha en que dicho procedimiento se realizó. Las fresas deben ser esterilizadas o desinfectadas como el resto del material y guardadas en cajas metálicas. No se las debe colocar para su uso en un fresero. Luego de ser utilizadas con un paciente, se debe proceder conforme al resto del instrumental sucio. No deben utilizarse las vitrinas para exponer el material fuera de las condiciones anteriormente señaladas. La limpieza de turbinas se podrá realizar utilizando compresas embebidas en glutaraldehído o alcohol con las concentraciones recomendadas, debiéndose realizar tal procedimiento de higiene luego de ser utilizadas con cada paciente. La esterilización y desinfección de los materiales reutilizables directamente vinculados a la atención de pacientes deberán seguir la secuencia siguiente: 76 • El material sucio deberá ser primeramente sumergido en una solución de hipoclorito al 0.5% o glutaraldehído al 2% durante 20 minutos. • Luego se procederá al cepillado con detergente neutro o enzimático a fin de remover la materia orgánica. • Enjuagado con abundante agua corriente de arrastre y secado. Finalmente esterilizado o desinfectado (ver "Métodos de esterilización y desinfección"). Tazas de goma, espátulas y cubetas no metálicas se desinfectarán con glutaraldehído al 2% durante 20 minutos o hipoclorito de sodio al 0.5% 20 minutos o aplicando alcohol 70º C mediante fricción mecánica. Debe recordarse que las sustancias químicas desinfectantes deben ajustarse a las recomendaciones de sus fabricantes, tanto en lo que se refiere al tiempo de exposición de los materiales para asegurar la desinfección, como a su validez luego de ser preparadas. 6.21 ELIMINACIÓN DEL MATERIAL DESCARTABLE: Los materiales sucios o descartables deberán ser eliminados en forma segura. A tales efectos los objetos o materiales cortopunzantes deberán ser depositados en descartadores apropiados tal cual fue señalado en estas normas. Se recomienda que dichos recipientes sean de paredes rígidas, boca ancha y de amplia capacidad y de material compatible con la incineración y no afección del medio ambiente. A los efectos de su descarte, luego de alcanzada las tres cuartas partes de su capacidad, se obturará la boca mismo y se procederá a su eliminación. 77 Las gasas y algodones sucios así como las piezas dentarias eliminadas de la boca, deberán ser colocados en bolsas de nylon gruesas adecuadamente cerradas. El tratamiento final de descartadores y bolsas de material sucio debería asimilarse a las disposiciones establecidas en cuanto a residuos hospitalarios, es decir incineración directa o posterior a su recolección. 6.22 PRECAUCIONES GENERALES EN EL AREA ESPECÍFICO DE TRABAJO ESTOMATOLOGICO • Evite heridas accidentales con instrumentos punzantes ó cortantes contaminados y el contacto de mucosas ó de lesiones abiertas de piel con material proveniente de los pacientes. • Use jeringas y agujas desechables y después deposítelas, junto con las hojas de bisturí y otros materiales con filo, en un recipiente resistente a los cortes ubicado en el mismo lugar donde se realizan los procedimientos. • En procedimientos que impliquen contacto con sangre o fluidos corporales potencialmente infectantes usar batas, mascarillas y anteojos protectores. Si se mancha las manos con sangre, lávelas de inmediato con cuidado, aplicándose luego soluciones desinfectantes para mayor seguridad. • Rotule claramente, con una advertencia especial, las muestras de sangre y de otras secreciones. Desinfecte el exterior del envase con una solución de cloro. • Los objetos manchados con sangre, colóquelos en una bolsa rotulada ("Precaución: contiene sangre"), antes de enviarlos para su limpieza y destrucción. 6.23 PRECAUCIONES CUANDO SE PRESENTAN LESIONES ACCIDENTALES: 78 • En caso de sufrir lesión accidental con elementos punzocortantes potencialmente infectados, inmediatamente realizar un lavado minucioso con agua y jabón. • Previamente presione los bordes de la herida para favorecer la salida de sangre por la misma. Si es necesario colóquese un apósito. Evite frotar la zona con cepillos debido al riesgo de originar microlesiones. • En el caso de exposición de los ojos, lávelos de inmediato con agua y después irríguelos con solución salina estéril • Igualmente si se mancha con sangre, secreciones o fluidos, lávese prolijamente la zona con agua y jabón • Si se decide que la lesión es significativa (según resultado de ficha de accidentes), se debe seguir la evaluación del paciente y, previa consejería, se deben realizar las pruebas de VIH y hepatitis B, tanto al paciente como a Ud. Y reportar el accidente al responsable de bioseguridad de su consultorio ó clínica. • Si el resultado del paciente es positivo para hepatitis B, es recomendable que reciba el tratamiento con inmunoglobulinas de inmediato y la primera dosis de vacuna contra hepatitis B • Lo recomendable es que todo trabajador que está en riesgo de exposición a sangre u otros fluidos, este vacunado contra la hepatitis B. 6.24 RECOMENDACIONES DURANTE LA ATENCIÓN EN EL CENTRO ODONTOLOGICO • Además de las precauciones generales, debe tener presente las siguientes recomendaciones: • Usar mandil o chaqueta de mangas largas, guantes, mascarillas y protectores de ojos al realizar los procedimientos quirúrgicos. • Los instrumentos dentales empleados en cada paciente, debe esterilizarlos adecuadamente antes de reutilizarlos. 79 • Es recomendable que cuente con un juego de instrumental básico, incluido juego de fresas, para cada paciente. Al finalizar la labor del turno esterilícelos adecuadamente • La desinfección de fresas, cubetas de impresión material de acero no quirúrgico o de aluminio es recomendable que la haga con alcohol de 70% durante 30 minutos, el hipoclorito las corroe rápidamente • Los instrumentos sensibles al calor (espátula para resina y otros) puede someterlos a DAN y enjuagarlos posteriormente. • No utilizar cartuchos de anestesia con solución sobrante en otro paciente. • Ensartar la aguja de la cárpule en su protector mediante la técnica de una mano para evitar lesiones accidentales. • Manipular con cuidado el material utilizado con cada paciente (radiografías, impresiones, registros de mordida , etc.) • Tratar de evitar lesiones en las manos • Es mejor que use esponja suave para el restregado de las manos. Las escobillas pueden ocasionarle microlesiones. • Durante el acto operatorio, utilice un protector plástico sobre su chaqueta y coloque otro en el paciente para evitar el contacto con la sangre y fluidos contaminados • Cite al paciente con sospecha de infección o con diagnostico confirmado para la ultima hora de consulta. • Los vasos plásticos usados para el enjuagatorio deben ser descartables • Utilice diques de goma, eyectores de alta velocidad y coloque al paciente en la posición más cómoda para evitar salpicaduras. • Envuelva con plástico transparente los equipos y superficies difíciles de desinfectar (lámparas, cabezas de unidades de equipos de rayos X, etc.). Elimine estos protectores al concluir el acto operatorio. • Es deseable la esterilización de piezas de mano entre paciente y paciente. De no ser posible, lavarla bien y sumergirla en solución desinfectante por 80 20 minutos (la clorhexidina 4% en dilución 60% es conveniente por no corroer el rotor, alcohol yodado si es corrosivo). • La inserción de la placa radiográfica en la boca del paciente para la toma debe ser efectuada con instrumental, no con la mano. Luego de la toma, tomar la placa con una pinza enjuagarla a chorro y dejarla reposar unos minutos en solución desinfectante antes de su revelado. • Revelar placas con pinzas para evitar lesión dérmica por ácidos • Descontamine la jeringa triple remojándola en solución desinfectante por 30 minutos. • Para evitar la aspersión del material infectado de la pieza de mano, deje correr y descargue agua de la pieza por 1 minuto antes de comenzar la atención del día y después de la atención de cada paciente. Las superficies del equipo dental deben ser perfectamente lisas y casi sin uniones. Deben tener además, un acabado que permita la limpieza y la desinfección 6.25 CONTROL AMBIENTAL Cubiertas descartables: • Reducen el tiempo dedicado a limpieza-desinfección de superficies que no puedan ser descontaminadas con facilidad entre atenciones como el sillón dental bandejas, mesas de trabajo, entre otros. Pueden ser: hojas de aluminio, bolsas de polietileno, compresas de papel forradas en plástico, etc. • La persona que elimina las cubiertas descartables contaminadas debe tener guantes de goma gruesos, mascarilla y protectores oculares. Eliminación de desechos: 81 Los desechos son de tres tipos: Comunes ó no contaminados, infecciosos ó contaminados y especiales. • Desechos comunes o no contaminados: No representan riesgo de infecciones para las personas que los manipulan, tales como papeles, cajas, botellas no usadas para muestras, recipientes plásticos, etc. • Desechos infecciosos o contaminados: Son desechos con grandes cantidades de microorganismos y si no se eliminan en forma apropiada, son potencialmente riesgosos. Muchos de ellos están contaminados con sangre, pus, y otros fluidos corporales. • Desechos especiales: Los constituyen elementos radiactivos y líquidos tóxicos, tales como sustancias para revelado de Rx, insecticidas, etc. Recuerde que el manejo apropiado de los artículos de desecho minimiza la propagación de las infecciones al personal de salud y a la comunidad local, protege de lesiones accidentales a quienes los manipulan y proporciona un ambiente agradable. Eliminación de objetos punzocortantes: Colocar con pinza todos los artículos punzocortantes en un recipiente y rotúlelo indicando lo que contiene. Estos recipientes pueden ser fabricados con objetos de fácil disposición tales como una lata con tapa ó una botella de plástico fuerte. Sumerja los desechos punzocortantes en una solución de hipoclorito de sodio con la finalidad de desinfectar el material y dañarlo para impedir que vuelva a ser usado. 6.26 SALUD OCUPACIONAL El personal debe conservar un adecuado estado de salud, la Inmunización contra la hepatitis B. La inmunización comprende tres dosis (la segunda al 82 cabo de 1 mes y la tercera a los 6 meses) y protege por un periodo de 10 años transcurridos los cuales se requiere un refuerzo. Según la FDI los estudiantes y profesionales relacionados a la Odontología que realizan procedimientos invasivos y cuyo estado HIV se desconoce pero que por factores ajenos a sus labores profesionales estén en riesgo de ser HIV-seropositivos deberán someterse regularmente a los exámenes apropiados para establecer el nivel de riesgo HIV. 6.27 Normas Mínimas de Bioseguridad Odontología Sabemos cuáles son los virus a los que estamos expuestos, tal como el virus de la Hepatitis (A-B-C-D), H.I.V., Tuberculosis, Herpes, Micosis y enfermedades no convencionales por nuevos agentes infecciosos. La odontología del fin del siglo XX se ha encontrado con nuevos e inesperados desafíos que hay que interpretar y resolver. Al comenzar el tratamiento del paciente: 1. Desinfectar con hipoclorito de sodio al 2%, iodopovidona al 2,5% o las superficies del mobiliario dental, turbinas, micromotor, jeringa triple y muy especialmente la salivadera. Estas maniobras deben repetirse con cada paciente. 2. Proceder de igual forma con la prótesis o aparatología que se reciba del laboratorio, o que se envíe. 3. Confeccionar una historia clínica del paciente en forma concisa y puntual (no más de diez preguntas), independiente de la ficha odontológica; tratando de conocer los últimos antecedentes de enfermedades infecciosas, si las hubiere y medicación que toma. 4. Se ubicará al paciente en el sillón, recién entonces se le colocará el babero, el vaso y el eyector (descartables). 83 5. Se dejará correr el agua de la turbina y de la jeringa de agua y aire, durante aproximadamente 30 segundos. Durante el tratamiento: 1. Tanto Ud. Como su personal auxiliar utilicen siempre guantes descartables, barbijos (no de tela), si no usa anteojos colóquese protectores oculares con paneles laterales, ya que estos brindan una protección total. Utilice ambo y coloque camisolín sobre el ambo cuando realice prácticas operativas. 2. En cuanto a sus manos, protéjalas lavándolas con jabón antiséptico, pueden ser de iodopovidona o clorexidina de 2% antes de colocarse los guantes y al retirarlos. No se seque con toallas de tela, hágalo con toallas de papel descartable. Si durante la atención del paciente, éstos guantes se perforan o desgarran, se deben descartar inmediatamente colocándose un par nuevo. Cambie los guantes con cada paciente, no los reutilice, recuerde que el látex va perdiendo consistencia y se va haciendo más poroso, permitiendo el pasaje de microorganismos muy pequeños como los virus. Un guante nuevo reduce en un 50% el riesgo de infección si se produjere un accidente, (pinchazo con agujas u otro instrumental contaminado). En caso de pacientes de alto riesgo, utilice doble par de guantes. 3. Manipule con cuidado el instrumental filoso y punzante, (bisturíes, sindesmótonos, elevadores y en especial agujas). Recuerde que para el contagio de una hepatitis B, solo se requiere un "pinchazo" con 0,004 ml de sangre contaminada. 4. Al anestesiar a su paciente, hágalo con una jeringa estéril, una aguja descartable y solución anestésica fresca, evitando usar anestubos que contengan sobrantes de otras anestesias. "No encapuche las agujas a menos que lo haga con protectores". 84 5. Trate de minimizar la formación de aerosoles dentales. Se ha comprobado que su dispersión y por consiguiente la de microorganismos, puede llegar hasta dos metros de distancia. Trabaje con aislación absoluta del campo operatorio cuando la operación lo permita. Esto impide la formación y dispersión de aerosoles. 6. Las RX periapicales y oclusales, límpielas con toallitas de compuestos fenólicos o solución de iodopovidona al 2,5% antes y después de usarlas. Al finalizar el tratamiento: Todas estas tareas, tanto si las hace Ud., como su personal auxiliar, deben realizarse con las manos enguantadas: 1. El material descartable, como agujas, hojas de bisturí u otros elementos filosos o punzantes se deben descontaminar con hipoclorito de sodio al 2% durante 20 minutos. Este método es el más económico y aquí mucho no importa la acción corrosiva del hipoclorito de sodio, ya que este material se descartará. Una vez realizado este paso, se deben desechar en envases rígidos para su posterior eliminación o incineración. 2. Las gasas, algodones y otros elementos contaminados con sangre o saliva que sean descartables, no punzantes o cortantes, es conveniente descontaminarlos durante 30 minutos en hipoclorito de sodio al 2% antes de eliminarlos en bolsas de polietileno rotuladas. 3. Con todo el instrumental u objetos que no sean descartables, se procederá a descontaminarlos ya sea con agentes químicos como el hipoclorito de sodio al 2%, solución de iodopovidona al 2,5%, solución de detergente enzimático 8 ml por litro durante 10 minutos o el uso del autoclave 130°, 1 atmósfera y ½ de presión durante 20 minutos. 85 a. Una vez finalizada esta etapa de descontaminación, se procederá a lavar el instrumental con agua, se lo secará con toalla de papel y se lo acondicionará para su posterior esterilización. b. Como método de esterilización sugerimos: c. Autoclave a presión a 134°, 1 atmósfera y ½ durante 20 minutos. d. Estufa por calor seco, sugerimos utilizarla durante 2 horas como mínimo, a 200° (éste es el tiempo aconsejable, pues no quema el instrumental y las gasas). e. Es imprescindible controlar el funcionamiento de estufas y autoclaves una vez cada tres meses a través de los controles biológicos de esterilización. 1. a. Para los cabezales de las turbinas, micromotores y jeringas triples utilice toallitas fenólicas o solución de hipoclorito. b. Limpie la platina, mesa auxiliar, módulo rodante y salivadera con toallas absorbentes, descartables embebidas en hipoclorito de sodio, iodopovidona, toallitas fenólicas. 2. Por último limpie las superficies que se hayan contaminado durante la atención del paciente: 86 Capítulo 7.- ANTECEDENTES GENERALES Paciente aparentemente sano describe que no se encuentra bajo ningún tratamiento médico, no presenta alergia a ningún tipo de medicamento, no presenta complicaciones con la anestesia, no presenta casos de hemorragia. ANTECEDENTES PERSONALES SI NO Esta bajo tratamiento médico ▪ Complicaciones con anestesia ▪ Alergia a medicamentos ▪ Hemorragias ▪ SIGNOS VITALES • PULSO: 80 por minuto • PRESIÓN ARTERIAL: 120/80 mm./Hg • TEMPERATURA: 37 grados centígrados • RESPIRACION: 16 por minuto 87 7.1Motivo de la consulta: Paciente acude a la clínica de internado por que presenta una apertura en incisivo lateral superior derecho en su cara palatina y pide que se le realice una restauración en esa pieza 7.2 Diagnostico 7.2.1Radiografía Pre-Operatoria Tomamos una radiografía periapical de la pieza dentaria para así conocer todos los detalles necesarios para la buena realización de un diagnóstico y del tratamiento endodóntico. 7.2.2 Exploración clínica. Inspección: mucosa normal, corona completa con apertura en su cara palatina Percusión: negativo Palpación: textura normal. Movilidad: negativo Transiluminacion:monocrómico. Maloclusión dentaria no Maloclusión maxilar 88 no 7.2.3 Semiología del dolor. Tipo: Intensidad; Cronología: Ubicación: Estimulo: 7.2.4 Vitalometria: Prueba térmica Frio: negativo Calor: negativo Prueba de la cavidad: negativo. 7.2.5 Interpretación radiográfica: Corona: con presencia de sombra radiolucida compatible con caries Raíz: única de forma cónica 89 Cámara: de forma triangular Conducto: único amplio y recto Ligamento Periodontal: ensanchado Ápice y Periapice: presenta una sombra radiolucida compatible con un granuloma por su tamaño; presenta lesión periapical Trabeculado óseo: normal Reabsorción: ninguna Pieza incisivo lateral superior derecho pulpa dental no vital en estado irreversible, con lesión periapical 7.3 Anestesia Maniobras previas Se procedió a realizar una profilaxis al paciente con la finalidad de eliminar la materia alna con la ayuda de cepillo profiláctico, pasta profiláctica y enguaje bucal. 7.3.1 ANESTESIA Con el fin de bloquear la sensibilidad de la pieza y para evitar las molestias del clamp, procedimos a anestesiar el diente a endodonciarse. 90 Se realiza la anestesia infiltrativa utilizando una aguja corta, penetramos por vestibular en el pliegue que divide el labio de la encía, pliegue mucogingival o bucolabial en la zona en la que se encuentra la pieza para anestesiar. Cuando se inyecta pequeña cantidad de solución anestésica en la región apical del diente que va a operarse, la solución se difunde a través del periostio, la porción cortical y el hueso y finalmente alcanza el nervio dentario anterior, debido a la proximidad de la raíz a la superficie exterior del maxilar, es posible obtener buena anestesia con este procedimiento. Este método produce anestesia de la pulpa y de los lado del labial, en el lugar de la tejidos blandos del inyección. Por palatino hacemos la punción en el trayecto del palatino anterior para provocar analgesia durante el tratamiento endodóntico. 7.4 Aislamiento PREPARACIÓN Y AISLAMIENTO DEL CAMPO OPERATORIO Selección del clamp para la pieza a tratarse. Se utilizoClamp de mariposa para anteriores Se utilizó la técnica preparación del conjunto (Arco, Dique de goma, Clamp), para luego proceder a colocar dicho conjunto con una pinza porta clamp a la boca para el aislamiento total de la cavidad. El Clamp fue colocado en la misma pieza a nivel cervical 91 7.5 Apertura 7.5.1 APERTURA Y ACCESO CAMERAL La apertura la realice a nivel del cíngulo en la cara palatina con una fresa redonda de diamante, presentaba una pequeña apertura pero estaba poco conformada , luego cambié a una fresa Endo-Zeta para alisar las paredes de la cavidad para que al momento del limado no haya obstrucción y además se debe retirar los restos de dentina para evitar el taponamiento del conducto radicular, la disolución de agentes orgánicos e inorgánicos del conducto radicular, incluyendo la capa de desecho que se produce en la superficie de la dentina por acción de los instrumentos y se compacta al interior de los túbulos dentinarios. Luego procedí a la localización del conducto con un localizador de conductos denominado DG16. 7.5.2 Neutralización del contenido Antes de la exploración, con el fin de reducir la cantidad o agresividad de ese contenido, se inició la neutralización con la irrigación de la cámara pulpar y la entrada del conducto radicular con hipoclorito de sodio en concentración del 1 al 5%, por sus características como antiséptico y disolvente de materia orgánica. a manera de tres tiempos, siguiendo tercio a tercio la raíz. Por sus características asépticas, disolvente alcalino, que al estar en contacto con un medio acido este es neutralizado. Preparada la primera lima (#30) se empieza a la extracción del contenido pulpar por medio de tercios, primero el tercio cervical, luego el tercio medio y por último el tercio apical hasta el CDC, 2mm antes del ápice. 92 7.6 Odontometria 7.6.1 ODONTOMETRIA.Consiste en la determinación correcta de la longitud real del diente que tiene por objetivo asegurar que los procedimientos endodónticos se realicen dentro de los límites del conducto radicular. Con la cámara pulpar limpia y seca, procedo a introducirla primera lima # 30 con una longitud de instrumento (– 2 mm) menos de la aparente 20mm la cual la medí con una regla milimetrada. Luego coloqué la lima en el conducto ya con la longitud de instrumento y pase a tomar una radiografía la cual la denominamos conductometría y la medida de trabajo exacta que fue 21mm 7.6.2 Longitud Aparente: 22 mm 7.6.3 Longitud de Instrumento: 20 mm 7.6.4 Longitud de Trabajo: 21mm 7.7 Tecnicas Radiográficas Empleadas • Técnica Cono corto.- Bisectriz • Técnica Cono largo.- Paralelismo 93 7.8 Biomecánica 7.8.1Primera cita La preparación del sistema de conductos es un conjunto de procedimientos mecánicos, con la ayuda de productos químicos que tiene por finalidad de limpiar, conformar y desinfectar el conducto radicular y así crear condiciones óptimas para poder condensarlo. La técnica a utilizar es apico coronario. Empecé con el proceso de biomecánica utilizando limas Maillefer de la primera serie de tipo K primera lima #30 y con la longitud de trabajo de 21mm, comenzamos el limado del conducto con movimientos giratorios en sentido horario entre un cuarto y media vuelta de manera lenta y moderada, desplazándola por todas las paredes, y movimientos de arriba abajo en las paredes del conducto. Para luego irrigar el conducto, recordando que irrigar no significa inyectar, con la ayuda de una jeringa descartable, irrigamos el conducto con hipoclorito de sodio, en concentración 0.9%, a manera de tres tiempos, siguiendo tercio a tercio la raíz. Su finalidad es la lubricación del instrumento y de agente blanqueador. El objetivo de la irrigación es la limpieza del conducto, la desinfección y la lubricación de los instrumentos. Luego se introduce la lima tipo K#35 y de esa manera continúe limando e irrigando el conducto hasta terminar con la lima #55 de la segunda serie. Una vez bien limado el conducto, Procedí a secar el conducto con conos de papel #55 (segunda serie) con la longitud de trabajo de 21mm, hasta que el conducto quede completamente seco. 7.8.2 Medicación intraconducto. 94 Por ser u tratamiento realizado en tres sesiones, se dejo en el interior del conducto un medicamento. Prepare una mezcla de hidróxido de calcio químicamente puro suero fisiológico y lo lleve al interior del conducto con una lima de trabajo # 40 (primera serie) girando el instrumento en sentido contrario a las manecillas del reloj. 7.8.3 HIDROXIDO DE CALCIO: Es una base alcalina terrosa, de un peso molecular de 74.08 es un polvo fino e inodoro, blanco, soluble en agua, e insoluble en alcohol, un PH de 12.4 7.8.3.1 Propiedades del hidróxido de calcio la elevada del ph se debe a la alta liberación de iones de hidróxido dándote la propiedades inactivar enzimas bacterianas, por otra parte estimula el sistema enzimático de los tejidos orgánicos proporcionándole su efecto en las estimulación de los tejidos duros. Los iones de hidróxido actúan sobre las membranas celulares bacterianas e inactivan los acidos grasos de endotoxinas. Las infecciones del conducto radicular bien establecidas están caracterizadas por bacterias anaerobias estrictas o facultativas las cuales desarrollan su actividad en ausencia del oxigeno utilizando Co2, el hidróxido de calcio reacciona con el CO2, formando carbonato de calcio, privando a estas bacterias del sustrato esencial para su supervivencia 7.8.3.2 Propiedades Biológicas del Hidróxido de Calcio Cuando el hidróxido de calcio entra en contacto con el tejido conectivo pulpar o periapical provoca una zona de necrosis superficial el CO2, presente en la 95 zona, reacciona con el hidróxido y forma granulaciones de carbonato de calcio en forma de calcita. Este estimula el tejido conectivo subyacente a depositar granulaciones finas de sales de calcio a los cuatro o cinco días esta capa depositada estimula los fibroblastos, presentes en la zona a sufrir cito diferenciación esta célula desarrollan una intensa actividad metabólica de producción de colágeno y fibronéctina, secretándolas en forma de matriz hacia la barrera inicial, esta matriz comienza a atraer cristales de fosfato de calcio en forma de hidroxiapatita, iniciando su mineralización. Para que el hidróxido de calcio ejerza su actividad biológica debe ser colocado en contacto directo con el tejido conectivo sano y no con un coagulo sanguíneo o fragmento de dentina de lo contrario no se desencadenara el proceso de estimulación 7.8.4 Cura Oclusiva Seguido a esto se puso el material provisional CAVIT sellando el diente y evitando así la filtración o la contaminación que podrían ocasionar el fracaso. 7.9 Segunda cita 7.9.1 Anestesia local. Con el fin de bloquear la sensibilidad y para evitar las molestias del clamp, coloco anestésico a nivel de la encía del paciente, para poder realizar el tratamiento con tranquilidad. 7.9.2 Preparación y aislamiento del campo operatorio. Se realizó el aislamiento absoluto con la finalidad de mantener condiciones asépticas y evitar la aspiración de instrumentos y productos químicos utilizados durante el tratamiento. Seleccione el clamp para la pieza a tratarse (premolar). Utilice la técnica preparación del conjunto (arco, dique de goma, clamp), para luego proceder 96 a colocar dicho conjunto con una pinza porta clamp a la boca para el aislamiento total de la cavidad. 7.9.3 Retiro de la Oclusiva. Retiramos el material provisional (Cavit-Coltosol) con la pieza de mano a alta velocidad con una fresa cilíndrica de diamante. 7.9.4 Retiro del material obturador provisional, irrigado y secado. Se retira el material de obturación provisional Con la misma lima con la que depositamos el medicamento intraconducto lo removimos haciendo movimientos de rotación en sentido horario e, irrigo el conducto con hipoclorito de sodio con el fin de eliminar cualquier residuo del conducto 7.9.5 IRRIGACION Y SECADO DEL CONDUCTO Enseguida irrigamos el conducto con hipoclorito de sodio con el fin de eliminar cualquier residuo y con conos de papel estériles de la misma medida que la última lima secamos el interior del conducto. 7.10 Obturación 7.10.1 CONOMETRÍA Se seleccionó un cono de gutapercha de calibre igual al último instrumento utilizado en la conformación y con la longitud de trabajo usada para la conformación. 97 Se tomó el cono #50 de la segunda serie ya que la última lima empleada fue la # 55 y con la misma longitud real de trabajo (21mm) se lo introdujo en el conducto y se procedió a su adaptación; como hubo un buen ajuste y resistencia discreta a la tracción que son las cualidades que debe reunir este primer cono denominado cono maestro, luego se tomó una radiografía para confirmar el nivel de su adaptación apical. 7.10.2 OBTURACIÓN DEL CONDUCTO RADICULAR La obturación del sistema de conductos radiculares tiene por objetivo el llenado de la porción conformada del conducto con materiales antisépticos que promuevan un sellado estable y tridimensional y estimulen el proceso de reparación. La técnica de obturación que se siguió fue la siguiente: Técnica de condensación lateral: • Se preparó el cemento obturador Sealapex. • Se tomó el cono principal un poco de cemento y se lo introdujo con lentitud en el conducto hasta que penetre en toda la extensión de la longitud real de trabajo. • Con un espaciador digital de calibre compatible con el espacio ya existente en el conducto se procedió al calibrado del mismo. • Se tomó un cono accesorio o secundario y girando el espaciador en sentido antihorario se lo retiró e inmediatamente se introdujo el cono secundario en el espacio dejado por el instrumento. • Se repitió este procedimiento con otros conos accesorios (#25, 20, 15) hasta llenar el conducto con la mayor cantidad posible de conos accesorios, los que junto con el 98 cono principal y el sellador Sealapex serán los responsables de la obturación tridimensional del conducto. • Cortamos el mechón que se ha formado con un gutaperchero y con la ayuda de un mechero a nivel de la entrada del conducto para que no se produzcan cambio de color de la corona. 7.10.3 RADIOGRAFÍA POST-OPERATORIA Por último se tomó otra radiografía para observar que el conducto este lleno completamente, a la cual llamamos radiografía final. 7.11 Accidentes Operatorios Este paciente en el transcurso del tratamiento endodóntico llego a la clínica con molestia debido a que presento drenaje de materia purulenta x el conducto y inflamación de la cara a nivel apical hubo que hacer irrigado con suero fisiológico y prescribirle medicación antibiótica como antiflamatorio el paciente presentaba a nivel radiográfico una sombra radiolucida compatible con un granuloma por su tamaño 7.11.1 FARMACOPEDIA 99 UNIVERSIDAD DE GUAYAQUIL UNIVERSIDAD DE GUAYAQUIL FACULTAD PILOTO DE ODONTOLOGÍA FACULTAD PILOTO DE ODONTOLOGÍA DEPARTAMENTO DE INTERNADO DEPARTAMENTO DE INTERNADO Guayaquil, 09 de julio del 2010 Guayaquil, 09 de julio del 2010 PACIENTE: Leo Jimenez Plaza PACIENTE: Leo Jimenez Plaza Rp Prescripción 1) DICLOXACILINA: capsulas 500 mg· #15. 1) 2)RELMEX: tabletas 100 mg. #6 2) DICLOXACILIUNA: tomar una capsula cada 8horas por 5 dias RELMEX: tomar una tableta cada 12 horas por 3 días. DESCRIPCIÓN DE MEDICAMENTOS 1) DICLOXACILINA NOMBRE GENERICO: Dicloxina NOMBRE COMERCIAL: Dicloxacilina PRESENTACIONES.Polvo para suspensión frasco de 1.5g y 3g. Frasco para 60ml suspensión. Capsulas de 500mg caja por 50. 100 COMPOSICION.• Cada capsula de 500 mg contiene o Dicloxacilina o Exipientes 3g 1.5 p.p.s. DESCRIPCION.DICLOXACILINA (DICLOXINA) corresponde al grupo de las penicilinas semisinteticas para uso oral, establece en el medio acido del estomago. Su principal característica es la resistencia a la penicilinasa Dicloxina se absorbe rápida y completamente en el tracto digestivo. Después de 60 minutos de una dosis oral, se logran niveles máximos sanguíneos, alcanzando un estado terapéutico activo en la sangre, tejidos y orina Dicloxina posee acción bactericida y particularmente útil en ionfecciones producidas por germenes patógenos granpositivos: S pneumoniae, Streptococcuspygeneos, Staphylococcusaureus y epidermis, incluyendo cepas de estafilococos productoras de penicilinasa, resistente a la penilina G. INDICACIONES TERAPEUTICAS.Funrunculoaia, carbunco, heridas infectadas, celulitis, abcesos, infecciones del tracto respiratorio(alto y bajo) amigdalitis, faringitis, otitis, bronquitis, neumonía 101 CONTRAINDICACIONES.Hipersensibilidad a la penicilinasa y/o cefaloporinas ADVERTENCIA.La Dicloxacilina puede generar reacciones alérgicas tipocas de la penicila, especialmente en pacientes con antecedentes de hipersensibilidad a las penicilinas PRECAUCIONES.No administrar en estado de gravidez. Para mejores resultados, administrar 1 o 2 horas antes de las comidas. Cuando el tratamiento con Dicloxina es prolongada, deberán evaluarse las funciones epaticas, renal y hematológica. 2) RELMEX NOMBRE GENERICO.- Nimesulide NOMBRE COMERCIAL.- Relmex PRESENTACIONES.Comprimidos: Caja por 20. Suspensión oral: Frasco por 60 mL, sabor a tuttifrutti. Gotas pediátricas: Frasco por 10 mL, sabor a tuttifrutti. COMPOSICIÓN.• Cada COMPRIMIDO contiene: o Nimesulide 100 mg 102 o Excipientes, c.s.p. 1 comprimido • Cada SUSPENSIÓN oral: o Cada 100 mL contienen: o Nimesulide1 g o Excipientes, c.s.p. 100 mL • Cada GOTAS pediátricas: Cada mL contiene: o Nimesulide 50 mg o Excipientes, c.s. DESCRIPCIÓN.RELMEX contiene nimesulide, un antiinflamatorio, analgésico y antipirético, que difiere de los AINES clásicos en su estructura y perfil farmacológico, pertenece a la clase química de las sulfonanilidas y se caracteriza por ser un inhibidor preferencial de COX-2 lo que le convierte en un potente antiinflamatorio, y muestra propiedades adicionales en términos de sus efectos sobre la síntesis y liberación de los mediadores de la inflamación. Además, posee escasa acción inhibidora de la ciclooxigenasa 1 (COX-1), lo que provee de una mejor tolerabilidad gastrointestinal y una mejor acción terapéutica, comparado con los AINES clásicos que inhiben significativamente la síntesis de prostaglandinas. Además, nimesulide es también un inhibidor no competitivo de la liberación de histamina desde los mastocitos tisulares, lo que le dota de actividades antianafilácticas y antihistamínicas, propiedad inusual para un AINE, de importancia terapéutica en pacientes con asma y sensibles al ácido acetilsalicílico. INDICACIONES.- El RELMEX está indicado en niños, adultos y ancianos, para una variedad de procesos dolorosos, inflamatorios y febriles de diverso origen en varias áreas de la medicina, y en pacientes intolerantes al ácido acetilsalicílico y otros AINES. 103 EFECTOS ADVERSOS.- El tratamiento con RELMEX se ha asociado con baja incidencia de efectos adversos. CONTRAINDICACIONES.-Hipersensibilidad al nimesulide. Embarazo y lactancia. PRECAUCIONES.No administrar a pacientes con severa falla renal, ni a pacientes con afecciones gastrointestinales. El paciente que durante el tratamiento con nimesulide presente alteraciones de las pruebas de función hepática o manifieste síntomas compatibles con daño hepático (anorexia, náusea, vómito, ictericia) debe ser atentamente controlado y el tratamiento interrumpido. Este paciente no deberá ser tratado nunca más con nimesulide. DOSIS Y ADMINISTRACIÓN.El RELMEX se administra por vía oral, 2 veces al día. Adultos: 100 mg 2 veces al día. Niños: 5 mg/kg/día dividida en 2 tomas. 7.12 Reconstrucción del diente 7.12.1 OBTURACIÓN DE LA CAVIDAD Hecho el corte de los conos, se limpió la cámara pulpar con una bolita de algodón embebida de suero fisiológico para eliminar todo remanente de material obturador y a continuación se coloca Ionómero de Vidrio a la entrada del conducto y luego se puso coltosol como material provisional consiguiendo con esto que no haya filtración ni recontaminación del conducto. 104 7.12.2 CONTROL DE OCLUSIÓN Eliminamos los excesos del material para que no haya molestias, con la ayuda de la turbina y papel de articular. 7.12.3 RADIOGRAFIA FINAL Finalmente se retiró el aislamiento absoluto y se tomó una última radiografía para controlar que haya un buen sellado del conducto y una correcta colocación del material provisional. 7.12.4 RECOMENDACIONES AL PACIENTE Cumplir con la receta administrada. Control posterior del tratamiento de conducto tomando radiografías a los 3 meses, 6 meses y al año para verificar si no existe complicaciones posteriores como problemas periapicales. El paciente no se debe exceder en el desgarramiento de alimentos duros ya que la duración de la restauración depende mucho del cuidado del paciente. No masticar con esa pieza los primeros días, hasta que la inflamación baje. Y la más importante mantener una buena higiene bucal. 105 Conclusiones Es indispensable que el operador tenga un amplio conocimiento en el tratamiento de endodoncia y en la rehabilitación de tal, de modo que sepa orientar el diagnóstico hacia la mejor alternativa en el plan de tratamiento, favoreciendo tanto a la función, como a la estética de las estructuras dentarias. Puedo concluir que la técnica endodóntica utilizada para el incisivo superior lateral derecho, fue favorable, se presentó un postoperatorio satisfactorio, que demuestra la inmediata respuesta orgánica normal y satisfactoria durante la observación de los controles predeterminado. Se detectó respuestas orgánicas satisfactorias en el plazo mediato mediante observaciones. Es importante que el profesional sepa que para lograr un buen tratamiento se debe de haber realizado un buen examen radiográfico, y clínico seguida de una biomecánica muy minuciosa irrigación constante para lograr un sellado óptimo y así el éxito de nuestro tratamiento. 106 Recomendaciones Las recomendaciones para realizar tratamientos de endodoncia es, verificar mediante exámenes radiográficos la correcta obturación de la pieza dentaria, con el fin de poder observar una buena condensación. El profesional debe asegurarse que durante la acción clínica tenga aislamiento adecuado, utilizando irrigación constante para eliminar los restos necróticos encontrados en el conducto acompañada de una excelente biomecánica además es necesario elegir acertadamente los materiales a emplearse en la obturación para así evitar alguna reacción de tipo desfavorable que de origen a un fracaso en el tratamiento. Y recomiendo que se debe sellar bien la entrada del conducto y cavidad coronal es decir una rehabilitación para evitar la contaminación a futuro 107 ANEXO 1 HISTORIA CLÍNICA 108 CASO DE TRATAMIENTO ENDODÓNTICO DE INCISIVO LATERAL SUPERIOR DERECHO 109 ANEXO 2 Paciente Operador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 110 ANEXO 3 Radiografía de Diagnostico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010 111 ANEXO 4 Presentación de caso clínico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 112 ANEXO 5 Operatoria: conformación cavitaria con aislamiento absoluto y clamp. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 113 ANEXO 6 Radiografía: Odontometria. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 114 ANEXO 7 Operatorio: última lima utilizada para biomecánica- Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 115 ANEXO 8 Operatorio: Cono principal. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 116 ANEXO 9 Radiografía: Conductometria. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 117 ANEXO 10 Operatorio: Condensación Lateral. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 118 ANEXO 11 Radiografía: Conducto obturado. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 119 ANEXO 12 Radiografías (diagnostico, odontometria, conductometría, y restauración final). Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 120 ANEXO 13 Preoperatorio: restauración final. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 121 ANEXOS GRAFICOS Fig. 1 Pieza dentaria y sus partes 122 Fig. 2: Partes de sostén del diente Fig. 3: Cara Vestibular, Palatina y oclusal 123 Fig. 4 Imágenes de cámara pulpar de incisivo lateral superior derecho Explicación de la imagen: A. Vista lingual de un incisivo recién calcificado con pulpa grande B. Vista distal del mismo diente C. Cortes transversales a tres niveles: tercio apical, tercio medio y tercio cervical D. Es necesaria una preparación coronal grande, triangular y de forma de embudo para efectuar el desbridamiento adecuado de la cámara 124 pulpar de todos los residuos pulpares (la pulpa se ha superpuesto en el fondo) E. Vista lingual en un incisivo adulto, con formación extensa de dentina secundaria F. Vista distal del mismo diente G. Cortes transversales a tres niveles: tercio apical, tercio medio y tercio cervical H. Preparación coronal ovoide en forma de embudo, deberá sesgarse en sentido mesial para presentar un mejor acceso a la región apicodistal. No es necesario extender la preparación para el desbridamiento coronal, aunque sí se requiere un bisel extenso hacia incisal para llevar la preparación más cerca del eje central y facilitar el acceso al tercio apical (Caso clínico, tomado de Atlas de Endodoncia. Editorial Masson, 2000) Fig. 5 Fig. 1 Fig. 2 Fig. 3 Radiografia inicial Conductometria 125 Conometría Fig. 4 Fig. 5 Fig. 5 Preparación Colocación del Condensación cemento sellador cono Principal Fig. 6 y 7 Fig. 7 Colocación de los conos accesorios, a la longitud del espaciador. Fig.8 Fig. 9 126 lateral Obturación completa Radiografia final Fig. 5 Endodoncia realizada con condensación lateral Fig. 6 Técnicas de bioseguridad 127 ANEXOS DE MATERIAL E INSTRUMENTALES Materiales utilizados : • Fresas • Limas primera y segunda serie • Conos de papel • Conos accesorios • Cucharillas • Hidróxido de calcio químicamente puro • Suero fisiológico • Hipoclorito de sodio • Jeringa descartable • Cavit. • Rx. • Espejo bucal • Explorador • Espátula de cemento • Loseta de Vidrio • Gutaperchero • Regla milimetrada • Clamp para incisivo • Arco de Young • Perforador de dique • Pinza porta clamps • Pinza algodonera • Jeringa Carpulle 128 • Limas y condensadores • Dique de Goma • Aguja corta • Guantes • Succionador • Jeringa insulina para irrigar • Mechero • Sealapex • Conos • Espaciadores • Gutaperchero • Rx. 129 OTROS CASOS CLÍNICOS REALIZADOS EN LA FORMACIÓN ACADÉMICA 130 CASO DE CIRUGÍA EXTRACCIÓN DEL TERCER MOLAR SUPERIOR DERECHO 131 FOTO #1 Paciente Operador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 132 FOTO #2 Radiografía de diagnostico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010 133 FOTO #3 Presentación de caso clínico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 134 FOTO #4 Operatorio luxación de pieza dental con elevador recto. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 135 FOTO #5 Operatorio pieza extraída completamente. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 136 FOTO #6 Foto #6. Postoperatorio Sutura. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 137 CASO DE OPERATORIA RESTAURACIÓN DE CUARTA CLASE DE INCISIVO LATERAL SUPERIOR IZQUIERDO 138 FOTO #1 Paciente Operador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 139 FOTO #2 Radiografía de Diagnostico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 140 FOTO #3 Presentación de caso clínico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 141 FOTO #4 Pieza en tratamiento con cavidad conformada con poste de fibra de vidrio y aislamiento absoluto. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 142 FOTO #5 Adaptación de Resinform con aislamiento absoluto y clamp. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 143 FOTO #6 Pieza con restauración: tallado, pulido y abrillantado. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 144 CASO DE PREVENCIÓN SELLANTES DE FOSAS Y FISURAS 145 FOTO #1 Paciente Operador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 146 FOTO #2 Presentación de Caso Clínico Arcada Superior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 147 FOTO #3 Presentación de Caso Clínico Arcada Inferior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 148 FOTO #4 Ameloplastia en Arcada Superior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 149 FOTO #5 Ameloplastia en Arcada Inferior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 150 FOTO #6 Arcada Superior con aislamiento relativo y aplicación de ácido grabador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 151 FOTO #7 Arcada Inferior con aislamiento relativo y aplicación de ácido grabador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 152 FOTO #8 Arcada Superior. Piezas Selladas. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 153 FOTO #9 Arcada Inferior. Piezas Selladas. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 154 FOTO #10 Toma de Arcada Superior y Arcada Inferior aplicando flúor. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 155 CASO DE PERIODONCIA PERIODONTITIS MODERADA 156 FOTO #1 Paciente Operador. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 157 FOTO #2 Radiografía de Diagnostico Panorámica. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010 158 FOTO #3 Presentación del Caso Clínico. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 159 FOTO # 4 Presentación del Caso Clínico Arcada superior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 160 FOTO #5 Presentación del Caso Clínico Arcada Inferior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 161 FOTO #6 Aplicación de Flúor en cubeta a la Arcada Superior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 162 FOTO #7 Aplicación de Flúor en cubeta a la Arcada Inferior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 163 FOTO #8 Postoperatorio: Arcada superior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 164 FOTO #9 Postoperatorio: Arcada Inferior. Fuente: Clínica de Internado Facultad Piloto de Odontología, Albán S, 2010. 165 166 167 168 169 170 171 172 173 174 175 176 177 178 179 180 181 182 183 184 185 186