- Ninguna Categoria
Teoria de grupos y simetria molecular
Anuncio
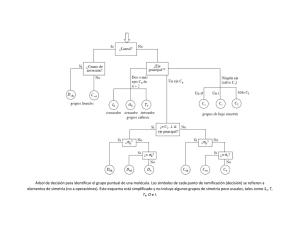
Curso de Química Inorgánica II Escuela de Ciencias Químicas Facultad de Ciencias UPTC PhD. Jovanny Arlés Gómez Castaño ¿Para qué sirve la teoría de grupos y la simetría en química? • La simetría gobierna las propiedades físicas y espectroscópicas de las moléculas. • Proporciona pistas acerca de cómo podrían estar ocurriendo las reacciones químicas. • Son esenciales para la construcción y análisis de los orbitales moleculares. • Sirven para analizar las vibraciones moleculares • Permite obtener información acerca de la estructura molecular y electrónica a partir de los datos espectroscópicos. ¿ Qué es eso de la teoría de grupos? El tratamiento sistemático y matemático de la simetría se denomina teoría de grupos. La teoría de grupos es un tema vasto y poderoso con grandes aplicaciones en ramas de la ciencia como la biología, la física y la química. Una introducción a la teoría de grupos Definición de grupo: Un grupo es una colección de elementos (miembros) que están interrelacionados por unas propiedades específicas matemáticas. En términos generales no es necesario especificar la naturaleza de los miembros de un grupo o la forma en que ellos están relacionados. Sin embargo, en las aplicaciones de la teoría de grupos a la química, el punto clave es la simetría. Una introducción a la teoría de grupos Para que un conjunto de elementos puedan formar un grupo desde un punto de vista matemático, las siguientes condiciones (o reglas) deben ser cumplidas: 1. El producto (la combinación*) de dos elementos del grupo y el cuadrado de cualquier elemento del grupo debe ser un elemento del grupo. *Nota: en teoría de grupos, la ley conmutativa (xy = yx) no es aplicativa en todos los casos. Por ejemplo, en teoría de grupos la combinación de miembros AB puede dar C, mientras que la combinación BA puede dar D, donde C y D son también dos miembros del grupo. Una introducción a la teoría de grupos ¡OJO! existen sin embargo algunos grupos en los cuales la combinación es conmutativa. Tales grupos son llamados grupos Abelianos. Debido al hecho que la multiplicación (en teoría de grupos) no es generalmente conmutativa, resulta conveniente especificar el sentido de la combinación; por ejemplo, si un elemento B esta siendo multiplicado por un elemento A, debe especificarse si la multiplicación es en sentido AB o BA. En el primer caso, podríamos decir que B esta siendo multiplicado por la izquierda por A, y en el segundo caso que B esta siendo multiplicado por la derecha por A. Una introducción a la teoría de grupos 2. Existe un elemento del conjunto que conmuta con todos los otros elementos del grupo dejándolos inmodificables. Este elemento es conocido como elemento identidad (E). EX XE X 3. La ley asociativa de la multiplicación es válida A( BC ) ( AB)C En general, la propiedad asociativa debe conservarse para productos continuos para cualquier números de elementos: ( AB)(CD)( EF )(GH ) A( BC)( DE)( FG) H ( AB)C( DE)( FG) H ... Una introducción a la teoría de grupos 4. Cada elemento del conjunto tiene un inverso (recíproco), que es también un miembro del conjunto A1 A AA1 E Demostración: Si A, B, y C son elementos del grupo, su producto, D, debe ser también un elemento del grupo, ABC D Si ahora multiplicamos por la derecha cada lado de la ecuación por C-1B-1A-1, obtendremos Una introducción a la teoría de grupos 1 1 1 1 1 ABCC B A DC B A 1 ABEB 1 A1 DC 1 B 1 A1 E DC 1 B 1 A1 Dado que D multiplicado por C-1B-1A-1 = E, C-1B-1A-1 es el recíproco de D, y dado que D = ABC, tenemos que 1 1 1 1 1 D ( ABC ) C B A lo cual prueba la regla Simetría molecular Operaciones de simetría y elementos de simetría Claves: • Las operaciones de simetría son acciones que dejan a la molécula sin cambios en su apariencia, por ejemplo una acción como la rotación a través de cierto ángulo que deja la molécula en apariencia sin cambios. • Asociado con cada operación de simetría se encuentra un elemento de simetría, un punto, línea o plano con respecto al cual se realiza la operación de simetría. Simetría molecular Operación de simetría Elemento de simetría Identidad “todo el espacio entero” Rotación de 360°/n Eje de simetría de orden n Reflexión Plano especular Inversión Centro de inversión Rotación de 360°/n seguida Eje de rotación impropia por una reflexión en un de orden n plano perpendicular al eje de rotación Símbolo E Cn i Sn Simetría molecular Operaciones de simetría y elementos de simetría 1) La operación de identidad, E. Consiste en no hacerle nada a la molécula. Cada molécula posee al menos esta operación, y algunas de hecho sólo ésta, de modo que le necesitaremos si pretendemos clasificar a todas las moléculas de acuerdo con su simetría. Operaciones de simetría y elementos de simetría 2) Rotación de orden n, Cn En general, una rotación de orden n será una operación de simetría si la molécula aparece sin cambios después de una rotación de 360°/n. Una molécula de H2O puede rotar en torno del bisector del ángulo de enlace HOH cualquier número de grados, pero solo una rotación de 180° (la operación C2) la deja sin cambios aparentes. Rotación triple o de orden 3 (C3) en la molécula NH3. Hay dos rotaciones asociadas con este eje: una de 120° (C3) y otra de 240° (C23) Operaciones de simetría y elementos de simetría 2) Rotación de orden n, Cn La molécula cuadrada plana XeF4 también posee ejes de rotación de orden 2 que son perpendiculares al eje C4,: un par C´2 pasa a través de cada unidad trans-FXeF y el otro par C´´2 pasa a través de los bisectores de los ángulos FXeF. Por convención, el eje rotacional de orden superior (eje principal), define el eje z. Algunos de los elementos de simetría de la molécula XeF2. Hay dos pares de ejes de rotación dobles al eje C4 principal. El plano de reflexión horizontal h está en el plano de la hoja y hay dos conjuntos de planos de reflexión verticales, v y d. Operaciones de simetría y elementos de simetría 3) Reflexión, Ejemplo: la molécula de H2O posee dos planos especulares que se cruzan en el bisector del ángulo HOH. Debido a que los planos son “verticales” en el sentido de que contienen al eje rotacional de la molécula, se les asigna un subíndice v, como v y ´v. Los dos planos especulares verticales v y ´v en la molécula del agua y las operaciones correspondientes. Ambos planos se cortan a través del eje C2. Operaciones de simetría y elementos de simetría 3) Reflexión, La molécula de XeF4 tiene un plano especular h en el plano de la molécula (el subíndice h significa que el plano es horizontal en el sentido de que el eje de rotación principal es perpendicular a él). Esta molécula también tiene dos conjuntos más de dos planos especulares que cruzan el eje cuádruple. Se denotan como v los planos que pasan a través de los átomos de F y d a los planos que bisectan el ángulo entre los átomos F. La d denota “diedro” y significa que el plano bisecta el ángulo entre dos ejes C´2 (los ejes FXeF). Operaciones de simetría y elementos de simetría 4) Inversión, i Para entender la operación de inversión, i, necesitamos imaginar que cada átomo es proyectado por una línea recta que pasa a través de un punto ubicado en el centro de la molécula y que también se encuentra proyectado en el otro lado a una distancia Ejemplo: en la molécula del SF6, con equivalente. Operación de inversión y centro de inversión en el SF6 el punto en el centro de la molécula, hay pares diametralmente opuestos de átomos de F que son intercambiables. El elemento de simetría, el punto a través de cual se hicieron las proyecciones, se denomina centro de inversión, i. Operaciones de simetría y elementos de simetría 4) Inversión, i ¡Ojo! aunque una inversión y una rotación de orden 2 pueden tener a veces el mismo efecto, éste no es el caso general y las dos operaciones deben de ser distinguidas: Debe ponerse atención para no confundir (a) una operación de inversión con (b) una rotación de orden 2. Operaciones de simetría y elementos de simetría 5) Rotación impropia, Sn Consiste en rotar a una molécula un cierto número de grados en torno a un eje seguido de una reflexión en el plano perpendicular a ese eje En este caso, la operación consiste en una rotación de 90° alrededor de un eje que bisecta dos ángulos de enlace HCH, seguida de una reflexión a través de un plano perpendicular al eje de rotación. Observe que ni la operación de 90° ni la reflexión por sí sola constituye una operación de simetría para el CH4, pero su efecto global sí lo es. Eje de rotación impropia de orden 4, S4, en la molécula de CH4. Operaciones de simetría y elementos de simetría 5) Rotación impropia, Sn Notas: (a) Un eje S1, que equivale a una rotación de 360° seguida de una reflexión en el plano perpendicular, es equivalente a una sola reflexión, de modo que S1 = h (el símbolo h suele utilizarse en vez de S1) (b) Un eje S2, una rotación de 180° seguida de una reflexión en el plano perpendicular, es equivalente a una inversión, de modo que S2 = i (el símbolo i se emplea en lugar de S2) Grupos puntuales de moléculas Las propiedades de simetría de una molécula que dejan a un punto sin cambio definen su grupo puntual y constituyen la base para la clasificación de su simetría. Un grupo puntual es caracterizado por su símbolo de Schoenflies. Punto clave: para identificar el grupo puntual de una molécula se observan sus elementos de simetría y se comparan con los elementos que definen cada grupo. Grupos puntuales de moléculas Árbol de decisiones para identificar el grupo puntual de una molécula. Los símbolos en cada punto se refieren a los elementos de simetría (no a las operaciones correspondientes) Grupos puntuales de moléculas Para asignar el grupo puntual a una molécula se requiere identificar a sus elementos de simetría y luego remitirse a esta tabla. Grupos puntuales de moléculas Ejemplo: Identificar los grupos puntuales a los cuales pertenecen las moléculas H2O y NH3 Aplicaciones de la simetría Moléculas polares: • Una molécula no podrá ser polar si tiene un centro de inversión. • Una molécula no puede tener un momento dipolar dirigido perpendicularmente a cualquiera de los planos especulares. • Una molécula no puede tener un momento dipolar perpendicular a cualquiera de sus ejes de rotación. Clave: una molécula no podrá ser polar si pertenece a un grupo que incluya un centro de inversión, a cualquiera de los grupos D y sus derivados, a los grupos cúbicos (T, O) al grupo icosaédrico (I) y a sus modificaciones. Un repaso del concepto de Momento dipolar () Desplazamiento de densidad de carga + - H-Cl H-Cl La magnitud del desplazamiento de la carga en un enlace covalente polar viene dada por el momento dipolar. El momento dipolar es el producto de una carga parcial () y una distancia (d) = d El momento dipolar generalmente se expresa en unidades debye (D), llamadas así por Peter Debye. El factor de conversión es: 1 D = 3,336 x 10-30 C m Un repaso del concepto de Momento dipolar () Un método experimental de determinación de momentos dipolares se basa en el comportamiento de las moléculas polares en un campo eléctrico Comportamiento de moléculas polares: en ausencia de un campo eléctrico externo (izquierda) y en presencia de un campo eléctrico externo. El campo eléctrico no afecta a las moléculas no polares. Un repaso del concepto de Momento dipolar () Ejercicio: Determinar la magnitud de la carga parcial () originada por el desplazamiento de la densidad de carga del átomo de hidrógeno hacia el átomo de cloro en el enlace H-Cl del cloruro de hidrógeno, sabiendo que el momento dipolar observado es de 1,03 D y que la longitud de enlace H-Cl es de 127,4 pm. Una vez calculada la magnitud de la carga, estimar el porcentaje de carácter iónico sabiendo que la carga del electrón es de 1,602 x 10-19 C. Un repaso del concepto de Momento dipolar () Ejercicio: Determinar la magnitud de la carga parcial () originada por el desplazamiento de la densidad de carga del átomo de hidrógeno hacia el átomo de cloro en el enlace H-Cl del cloruro de hidrógeno, sabiendo que el momento dipolar observado es de 1,03 D y que la longitud de enlace H-Cl es de 127,4 pm. Una vez calculada la magnitud de la carga, estimar el porcentaje de carácter iónico sabiendo que la carga del electrón es de 1,602 x 10-19 C. R/= 2,70 x 10-20 C; 17% iónico Un repaso del concepto de Momento dipolar () Ejemplo: la molécula de dióxido de carbono es no polar. Para entender esta observación, hace falta distinguir entre el desplazamiento de la densidad de carga electrónica en un determinado enlace y en la molécula como un todo. O=C=O =0 La diferencia de electronegatividades entre el C y el O ocasiona un desplazamiento de la densidad de carga electrónica hacia el átomo de O en los enlaces carbono-oxígeno y da lugar a un momento de enlace. Sin embargo, como los dos momentos de enlace son iguales en magnitud y dirección y de sentido opuesto, se cancelan entre sí y dan una resultante nula del momento dipolar para la molécula. Un repaso del concepto de Momento dipolar () Ejemplo: la molécula de agua es polar. Tiene momentos de enlace debido a la diferente electronegatividad del H y el O. Los momentos de enlace se combinan para dar un momento dipolar resultante de 1,84 D. La molécula de agua no puede ser lineal porque esto traería consigo una cancelación de los momentos de enlace al igual que para el CO2. Mediante la teoría RPECV se predice que la molécula de H2O es angular y la observación de que es una molécula polar simplemente confirma esta predicción. Un repaso del concepto de Momento dipolar () La molécula de tetracloruro de carbono es no polar. El valor nulo del momento dipolar resultante significa que los momentos de enlace deben estar orientados de tal manera que se cancelan. ¿Que sucedería si cambiáramos un átomo de Cl en la molécula de tetracloruro de carbono por otro átomo distinto, por ejemplo por un hidrógeno? Los momentos de enlace individuales se combinan dando un momento dipolar resultante (flecha roja) de 1,04 D. Aplicaciones de la simetría Moléculas quirales: • Una molécula quiral no puede tener un eje de rotación impropia, Sn. • Un plano especulares un eje S1 de rotación impropia y un centro de inversión es equivalente al eje S2; en consecuencia, las moléculas con un plano especular o con un centro de inversión poseen ejes de rotación impropia y no pueden ser quirales. • Los grupos en los que Sn está presente incluyen al Dnh (que comprende al Sn), al Dnd y algunos de los grupos cúbicos (de manera específica, Td y Oh) Aplicaciones de la simetría Orbitales moleculares: Ya sabemos que los orbitales moleculares de las moléculas diatómicas y lineales poliatómicas se designan como , . Estos descriptores hacen referencia a la simetría que exhiben los orbitales con respecto a la rotación de la molécula en torno a su eje principal, el cual en estos casos corresponde con el internuclear. Un orbital no cambiará de signo ante cualquier rotación; Un orbital cambia de signo cuando rota 180° alrededor del eje internuclear Estos mismos descriptores pueden utilizarse para especificar orbitales en moléculas poliatómicas no lineales tomando en cuenta la simetría local con respecto al eje de un determinado enlace, de modo que puede hablarse, por ejemplo, de orbitales y en una molécula más compleja como la de benceno. Aplicaciones de la simetría Orbitales moleculares: Los descriptores y se basan en la simetría rotacional de orbitales respecto a un eje internuclear. Sin embargo, los descriptores más elaborados a, a1, e, eg, etc., que se usan para clasificar orbitales moleculares en moléculas no lineales, se basan en el comportamiento de los orbitales bajo todas las operaciones de simetría del grupo puntual al cual pertenece la molécula en cuestión. Dichos descriptores se asignan consultando la tabla de caracteres del grupo, un listado de los diferentes tipos de simetría posible en un grupo. Tablas de caracteres Número total de operaciones de simetría de un grupo Cada carácter muestra la manera en la que se ve afectado un objeto o una función matemática – como un orbital atómico – por una operación de simetria del grupo. Cada renglón de caracteres está asociado a una representación irreducible (tipo fundamental de simetría) particular del grupo Especie de simetría (descriptor) de la representación irreducible Funciones que exhiben las caracteristicas de la especie de simetría Funciones definidas por un eje sencillo Funciones cuadráticas Tablas de caracteres Ejemplo 1: Encontrar la especie de simetría de los orbitales atómicos O2s, O2pz, O2px del átomo de oxígeno en la molécula de H2O. Tablas de caracteres Ejemplo 2: El orbital 2pz del nitrógeno en la molécula de amoniaco es simétrico para todas las operaciones del grupo puntual C3v y, por lo tanto, posee una simetría A1. Los orbitales 2px y 2py se comportan de manera idéntica con todas las operaciones (esto es, no pueden distinguirse) y están dados por le descriptor de simetría E. (!Ojo¡ no confundir la operación de identidad E con el descriptor de simetría E). Combinaciones lineales adaptadas por simetría Recordar que: un principio fundamental de la teoría del OM de moléculas diatómicas es que los orbitales moleculares se construyen a partir de orbitales de la misma simetría. Este mismo principio se aplica para las moléculas poliatómicas. Para éste último caso se requiere agrupar orbitales atómicos para formar combinaciones de una simetría particular para posteriormente construir orbitales moleculares permitiendo combinaciones de la misma simetría entre los diferentes átomos. Las combinaciones específicas de los orbitales atómicos que se usan para construir orbitales moleculares de una simetría dada se llaman combinaciones lineales adaptadas por simetría (CLAS). Combinaciones lineales adaptadas por simetría Ejemplo: Los tres orbitales H1s en el NH3 dan lugar 1 A1s B1s C1s a tres orbitales CLAS, uno de los cuales es 1 (de especie de simetría igual a A1 debido a que permanece sin cambios en una rotación C3 y en cualquiera de las 2 2 A1s B1s C1s reflexiones verticales) Las otras dos CLAS construirse son 2 y simetría E) que pueden 3 (ambas de 3 B1s C1s Construcción de orbitales moleculares Punto clave: sólo los orbitales atómicos o combinaciones de orbitales del mismo tipo de simetría pueden contribuir a un orbital molecular de un tipo de simetría dado. Ejemplo (construcción de orbitales moleculares para el NH3): Ya hemos visto que la CLAS 1 tiene simetría A1. Los orbitales N2s y N2pz también tienen la misma especie de simetría y, por tanto, los tres contribuyen a los orbitales moleculares de la forma: C1 N 2 s C2 N 2 p C31 z Note que la especie de simetría de este orbital molecular es también A1, como sus componentes, y se denomina a1 (en cursiva y en minúscula para diferenciarlo de las especies de simetría de los orbitales constituyentes). Solo tres de esas combinaciones lineales son posibles (ya que la combinación de los hidrógenos cuenta como un solo orbital) y se designan como 1a1, 2a1 y 3a1 en orden creciente de energía. Continuación Ejemplo (construcción de orbitales moleculares para el NH3): También hemos visto que las CLAS 2 y 3 tienen simetría E en C3v. La tabla de caracteres muestra que los mismo es cierto para los orbitales N2px y N2py, lo cual se confirma al notar que en conjunto los dos orbitales 2p se comportan exactamente como 2 y 3: De ello se infiere que 2 y 3 pueden combinarse con los orbitales N2px y N2py, para dar dos orbitales doblemente degenerados de enlace y dos de antienlace igualmente degenerados de la forma: C4 N 2 p C52 ; C6 N 2 p C73 x y Estos orbitales moleculares tiene simetría E y en consecuencia, se denominan orbitales e. El par de orbitales de energía más baja (de enlace) se designa 1e y el otro de 2e (de antienlace) Un orbital N2px en el NH3 cambia de signo en una reflexión v per un orbital N2py permanece sin cambio. Continuación Ejemplo (construcción de orbitales moleculares para el NH3): Un análisis de simetría no tiene nada que decir acerca de las energías de los orbitales más que identificar las degeneraciones (para calcular energías se requiere de la mecánica cuántica y para evaluarlas experimentalmente se requiere recurrir a técnicas físicas como la espectroscopia fotoelectrónica). Sin embargo, en casos sencillos podemos utilizar un conjunto de reglas generales par juzgar las energías relativas de los orbitales Puede esperarse que el orbital 1a1, al estar compuesto por el orbital N2s de baja energía, se ubique en nivel más bajo y que su contraparte antienlazante, 3a1, probablemente se halle en nivel más alto. El orbital de enlace 1e es el siguiente más alto en energía después de 1a1, seguido del orbital 2a1, que es pronunciadamente antienlazante. Simetría de las vibraciones moleculares El conocimiento de la simetría de una molécula puede ayudar en el análisis de los espectros IR y Raman. Es conveniente considerar dos aspectos de la simetría: • Uno es la información que puede obtenerse en forma directa al conocer a qué grupo puntual pertenece una molécula como un todo. • El otro es la información adicional que provienen de conocer la especie de simetría de cada modo normal. Recuerde que: la absorción de radiación infrarroja (IR) puede ocurrir cuando una vibración da como resultado un cambio en el momento dipolar eléctrico de una molécula, y una transición Raman puede tener lugar cuando la polarizabilidad de una molécula cambia durante una vibración. Simetría de las vibraciones moleculares a) Regla de exclusión Frecuentemente resulta sencillo inferir si los modos normales de vibración de una molécula son activos en IR, sin embargo es mucho más dificil determinar intuitivamente si un modo es activo para Raman (ya que no es facil saber si una distorsión en particular de una molécula da como resultado un cambio de polarizabilidad). Esta dificultad se supera en parte mediante la regla de exclusión: Si una molécula posee un centro de inversión, ninguno de sus modos podrá ser activo tanto para IR como para Raman. (Un modo podría ser inactivo en ambos) Simetría de las vibraciones moleculares b) Simetría de los modos normales Cuando la intuición no es confiable para reconocer si un modo vibracional es activo en IR (tal vez porque la molécula es compleja o el modo vibracional resulta dificil de visualizar) puede recurrirse a un análisis de simetría. Para aclarar el procedimiento tomaremos como ejemplo las dos especies planas cuadradas cis-[PdCl2(NH3)2] y trans-[PdCl2(NH3)2] Simetría de las vibraciones moleculares b) Simetría de los modos normales Para decidir qué modos son activos en IR y cuáles en Raman, consideraremos los caracteres de los modos mismos. De las propiedades de simetría de los momentos dipolares y de las polarizabilidades se infiere que: El descriptor de simetría vibracional debe ser el mismo que aquel para x, y o z en la tabla de caracteres para que la vibración sea activa en IR, y el mismo que el de la función cuadrática, como xy o x2, para que sea activa en Raman. Por consiguiente, la primera tarea consistirá en clasificar los modos normales de acuerdo con su especie de simetría y luego identificar cuáles de estos modos tiene la misma especie de simetría que x, etc, y xy, etc., para lo cual debemos de consultar las columnas finales de la tabla de caracteres del grupo puntual molecular. Simetría de moleculares las vibraciones b) Simetría de los modos normales Para clasificar los estiramientos Pd-Cl de acuerdo con la especie de simetría de sus respectivos grupos puntuales, se hará uso de un enfoque similar al análisis de simetría de orbitales moleculares en términos de las CLAS realizado. Estiramientos simétricos y antisimétricos de los enlaces Pd-Cl para cada isómero (los grupos NH3 se tratan como masas puntuales sencillas). Simetría de las vibraciones moleculares b) Simetría de los modos normales Para el estiramiento simétrico del isómero cis puede verse que el par de vectores de desplazamiento que representa la vibración permanece sin cambio aparente luego de aplicar cada operación del grupo puntual: E C2 v ´v 1 1 1 1 Por consiguiente, la simetría de esta vibración es A1. Simetría de las vibraciones moleculares b) Simetría de los modos normales Para el estiramiento antisimétrico, la identidad E deja sin cambio los vectores de desplazamiento y lo mismo es cierto para ´v, el cual se ubica en el plano que contiene a los dos átomos de Cl; sin embargo, tanto C2 como v intercambia los dos vectores de desplazamiento dirigidos de manera opuesta y así convierten el desplazamiento global en -1 veces el mismo: E C2 v ´v 1 -1 -1 1 Por consiguiente el descriptor de simetría para este modo corresponderá a B2. Simetría de las vibraciones moleculares b) Simetría de los modos normales Con un análisis similar para el isómero trans, pero usando el grupo D2h, se obtienen los descriptores A1g y B2u para los estiramientos Pd-Cl simétricos y antisimétricos, respectivamente Por ejemplo para el estiramiento E C2(x) antisimétrico tenemos que su especie de simetría es B2u: 1 -1 C2(y) C2(z) i (xy) (yz) (zx) 1 -1 -1 1 1 -1 Simetría de las vibraciones moleculares b) Simetría de los modos normales (Recuerde que un modo vibracional será activo en IR si tiene la misma especie de simetría que los desplazamientos x, y o z): En C2v, z es A1 y y es B2; en consecuencia, tanto las vibraciones A1 como B2 del isómero cis son activas en IR. Para determinar la actividad Raman de las vibraciones es esta molécula notamos que en el grupo C2v, las formas cuadráticas xy, etc., se transforman como todas las especies de simetría,y por lo tanto, en el isómero cis los modos de simetría A1, A2, B1 y B2 serán activos en Raman. Simetría de las vibraciones moleculares b) Simetría de los modos normales En D2h, x, y y z son B3u, B2u y B1u, respectivamente y sólo esas vibraciones pueden ser activas en IR. El estiramiento antisimétrico Pd-Cl del isómero trans tiene simetría B2u y es activo en IR. En D2h sólo Ag, B1g, B2g y B3g son activos en Raman. Simetría de las vibraciones moleculares b) Simetría de los modos normales Ahora entonces podemos distinguir experimentalmente entre los isómeros cis y trans: en la región del estiramiento Pd-Cl, el isómero cis (C2v) posee dos bandas en los espectros Raman y de IR. En contraste , el isómero trans (D2h) posee una banda en una frecuencia diferente en cada espectro. Espectros IR: Representaciones Matrices Como ya hemos visto las tablas de caracteres contienen información importante acerca de la simetría de un grupo puntual. Para comprender cómo se construye y el uso (desde un punto de vista más profundo) de las tablas de caracteres debemos conocer las propiedades de las matrices, las cuales son la base de la tablas. Por matriz se conoce a un conjunto de números organizados en forma rectangular (o cuadrada cuando el número de filas es igual al de las columnas), tal como 3 2 o 7 1 2 0 1 3 5 Representaciones Matrices Una matriz m x n tiene m filas y n columnas, así el orden de la matriz viene dado por (m, n) o m x n. La adición o sustracción de matrices puede solo ser realizada entre matrices del mismo orden. Por ejemplo: 4 7 Si A 3 5 8 2 4 y B 5 5 3 2 3 Representaciones Matrices 0 Luego A B 2 3 10 8 7 ; y A B 8 12 1 4 3 5 Representaciones Matrices La multiplicación de dos matrices (AB) es solo posible si la cantidad de columnas en A es igual al número de filas en B. Si A es una matriz m x n y B es una matriz n x o entonces el producto AB es una matriz m x o. Cada elemento (i, j) en la matriz AB es obtenido tomando cada valor n de la enésima fila de A y multiplicarlo por el correspondiente valor del enésima columna de B. Representaciones Matrices 3 Ejemplo: Si A 3 2 4 5 1 3x0 2 x 2 5 x1 AB 3x0 4 x 2 1x1 9 31 7 13 0 y B 2 1 3 4 6 3x3 2 x4 5 x6 3x3 4 x4 1x6 Representaciones Operaciones de simetría: representaciones matriciales Consideremos los efectos de las operaciones de simetría del grupo puntual C2v en el conjunto de coordenadas x, y y z. La molécula de agua es un ejemplo de una molécula de simetría C2v. (Para este ejercicio tomaremos el plano xz como el plano de la molécula) Representaciones Operaciones de simetría: representaciones matriciales Cada operación de simetría puede ser expresada como una matriz transformación de la siguiente forma: Nuevas coordenadas matriz transformacion coordenadas viejas Como ejemplos, consideremos cómo las matrices transformación pueden ser utilizadas para representar las operaciones de simetría del grupo puntual C2v. Operaciones de simetría: representaciones matriciales C2 : rota un punto de coordenadas (x, y, z) sobre el eje C2(z). Las nuevas coordenadas están definidas por x´ nueva x x y´ nueva y y z´ nueva z z En notación de matrices, 0 1 0 1 0 0 0 0 Matriz transformacion para C2 1 x x x´ x y = y o y´ y z z z´ z nuevas nuevas matriz viejas coordenadas coordenadas transformacion coordenadas en terminos de las viejas 0 x´ 1 y´ 0 1 z´ 0 0 0 0 1 Operaciones de simetría: representaciones matriciales v(xz) : refleja un punto con coordenadas (x, y, z) a través del plano xz. x´ nueva x x y´ nueva y y z´ nueva z z En notación de matrices, 1 0 0 0 0 Matriz transformacion para (xy ) 1 0 1 0 x´ 1 y´ 0 z´ 0 x x x´ x y = y o y´ y z z z´ z nuevas nuevas matriz viejas coordenadas coordenadas transformacion coordenadas en terminos de las viejas 0 1 0 0 0 1 Operaciones de simetría: representaciones matriciales Las matrices transformación para las cuatro operaciones de simetría del grupo C2v son: 1 E :0 0 0 1 0 0 1 0 ; C2 : 0 0 1 0 1 0 0 1 0 ; ( xz) : 0 0 1 0 1 0 0 1 0 ; ´( yz) : 0 0 1 0 1 0 0 0 1 Este conjunto de matrices satisfacen las propiedades matemáticas del grupo y es conocido como matriz representación del grupo puntual C2v. Cada una de las matrices del conjunto corresponden a una operación del grupo, estas matrices se combinan en la misma forma como las operaciones de simetría del grupo mismas. Operaciones de simetría: representaciones matriciales Por ejemplo, multiplicar dos de las matrices es equivalente a llevar a cabo las dos correspondientes operaciones. El resultado de dicha multiplicación de matrices es una matriz que corresponde al resultado de la operación (Nota: la operación debe ser llevada a cabo de derecha a izquierda, es decir, C2 x ) 1 C2 x ( xz ) 0 0 0 1 0 0 1 0 0 1 0 0 1 0 0 1 0 0 1 0 0 1 0 0 0 ´( yz ) 1 Caracteres 1 E :0 0 0 1 0 0 1 0 ; C2 : 0 0 1 0 1 0 0 1 0 ; ( xz ) : 0 0 1 0 1 0 0 1 0 ; ´( yz) : 0 0 1 0 1 0 0 0 1 Los caracteres, definidos solo para una matriz cuadrada, es la suma de los números de la diagonal de la matriz desde arriba a la derecha a abajo a la izquierda. Para el grupo puntual C2, los siguientes caracteres son obtenidos a partir de las matrices componentes de la matriz representación E C2 v ´v 3 -1 1 1 Podemos decir que este conjunto de caracteres también forma una representación. Esta es una versión recortada alternativa de la matriz representación. Sin importar si esta representación es expresada en forma de matriz o de caracteres la misma es conocida como una representación reducible, una combinación de representaciones irreducibles fundamentales. Las representaciones reducibles frecuentemente son designadas con una letra gamma en mayúscula (). Representaciones reducibles e irreducibles Cada matriz transformación del grupo C2 es “bloqueada diagonalmente”, esto es, que pueden ser reducidas a pequeñas matrices a lo largo de la diagonal, con todos los otros elementos igual a cero: 1 E : 0 0 0 1 0 1 0 0 ; C2 : 0 0 1 0 1 0 1 0 0 ; ( xz ) : 0 0 1 0 1 0 1 0 0 ; ´( yz ) : 0 0 1 0 1 0 0 0 1 Cuando las matrices son bloqueadas diagonalmente en esta forma, las coordenadas x, y y z son también bloqueadas diagonalmente. Como resultado, las coordenadas x, y y z son independientes una de la otra. Representaciones reducibles e irreducibles Los elementos de las matrices en las posiciones 1,1 (fila, columna) describen los resultados de las operaciones de simetría en la coordenada x, aquellos en las posiciones 2,2 describen los resultados de las operaciones en la coordenada y, y los de las posiciones 3,3 describen los resultados de las operaciones sobre la coordenada z. Los cuatro elementos para x forman una representación del grupo, aquellos para y forman una segunda representación, y los de z forman una tercera representación: E C2 v(xz) ´v(yz) 1 -1 1 -1 1 -1 -1 1 1 1 1 1 3 -1 1 1 Coordenada utilizada x y z Representaciones reducibles e irreducibles Cada fila corresponde a una representación irreducible (no puede ser simplificada mas), y los caracteres de estas tres representaciones irreducibles sumadas a través de cada columna dan como resultado los caracteres de la representación reducible , tal cual como la combinación de todas las matrices para las coordenadas x, y y, z hacen las matrices de las representaciones reducibles. Por ejemplo, la suma de los tres caracteres para x, y, y z bajo la operación C2 es -1, el carácter bajo esta misma operación. E C2 v(xz) ´v(yz) 1 -1 1 -1 1 -1 -1 1 1 1 1 1 3 -1 1 1 Coordenada utilizada x y z Tablas de caracteres Tres de las representaciones del grupo C2v, denominadas como A1, B1, y B2, ya han sido determinadas. La cuarta, denominada A2, puede ser hallada usando las propiedades de un grupo (ver siguiente diapositiva). Un conjunto completo de representaciones irreducibles para un grupo puntual es conocido como tabla de caracteres para ese grupo. La tabla de caracteres para cada grupo puntual es único. v(xz) ´v(yz) C2v E C2 A1 1 1 1 1 z x2, y2, z2 A2 1 1 -1 -1 Rz xy B1 1 -1 1 -1 x,Ry xz B2 1 -1 -1 1 y, Rx yz Propiedades de los caracteres de las representacione irreducibles en los grupos puntuales Propiedad Ejemplo: C2v 1. El número total de operaciones de simetría en el grupo Orden = 4 [4 operaciones de simetría, E, C2, es conocido como el orden (h) del grupo. v(xz) y ´v(yz)]. 2. Las operaciones de simetría son agrupadas en clases. Cada operación de simetría es una clase Todas las operaciones de una clase tienen caracteres separada; por lo tanto, hay 4 columnas en la idénticos para sus matrices transformación y son tabla de caracteres. agrupadas en la misma columna de la tabla de caracteres. 3. El número de representaciones irreducibles es igual al Debido a que hay 4 clases, debe haber número de clases. Esto significa que las tablas de también 4 representación irreducibles – y de caracteres tienen el mismo número de filas que de hecho así es. columnas (son matrices cuadradas) 4. La suma de los cuadrados de las dimensiones (caracteres 12 + 12 + 12 + 12 = 4 =h, el orden del grupo bajo E) de cada una de las representaciones irreducibles es igual al orden del grupo. h i E i 2 Propiedades de los caracteres de las representacione irreducibles en los grupos puntuales Propiedad Ejemplo: C2v 5. Para cada representación irreducible, la suma de los Para A2, 12 + 12 + (-1)2 + (-1)2 = 4 =h, el orden cuadrados de los caracteres multiplicados por el número del grupo de operaciones en la clase, es igual al orden del grupo. 6. Las representaciones irreducibles son ortogonales a (1)(1) + (-1)(-1) + (1)(-1) + (-1)(1) = 0 cada una de las otras. La suma de los productos de los E C2 v(xz) ´v(yz) caracteres (multiplicados juntos para cada clase) de cualquier par de representaciones irreducibles es 0. 7. Una representación totalmente simétrica esta incluida C2v tiene A1, con todos los caracteres = 1 en todos los grupos, con caracteres de 1 para todas las operaciones. Propiedades de los caracteres de las representacione irreducibles en los grupos puntuales Ahora la representación A2 del grupo C2v puede ser explicada: • La tabla de caracteres tiene 4 columnas, esta tiene 4 clases de operaciones de simetría (propiedad 2 de la tabla). • Debe tener por lo tanto 4 representaciones irreducibles (Propiedad 3). • La suma de los productos de los caracteres de cualquier dos representaciones debe ser igual a cero (ortogonalidad, propiedad 6). Por lo tanto, un producto de A1 y la representación faltante (A2) debe tener 1 para dos de los caracteres y -1 para los otros dos. • El carácter para la operación identidad de esta nueva representación debe ser 1 para tener la suma de los cuadrados de estos cuadrados igual a 4 (requerido para la propiedad 4). • Debido a que dos representaciones no pueden ser las mismas, A2 debe tener luego (E) = (C2) = 1, y (xz)= (yz) = -1 Esta representación es también ortogonal a B1 y B2. Aplicación de la reducción de una representación La siguiente fórmula se utiliza para calcular los coeficientes ci (cuántas veces aparece en la reducción cada especie de simetría) en términos de los caracteres i de la representación irreducible i y los correspondientes caracteres de la representación reducible original : 1 ci g (C ) i (C ) (C ) h C Aquí h es el orden del grupo puntual y la suma es sobre cada operación R del grupo. La forma de usar esta expresión se ilustra con el siguiente ejemplo. Aplicación de la reducción de una representación Ejemplo: considere la molécula de cis-[PdCl2(NH3)2], la cual, si ignoramos los átomos de hidrógeno, pertenece al grupo puntual C2v. ¿Cuáles son las especies de simetría comprendidas por los desplazamientos de los átomos? Para analizar este problema, consideraremos los 15 desplazamientos de los cinco átomos que no son de hidrógeno y obtendremos los caracteres de lo que llegará a ser un representación reducible al examinar lo que sucede cuando aplicamos las operaciones de simetría del grupo. Luego utilizaremos la ecuación anterior para identificar las especies de simetría de las representaciones irreducibles en las cuales puede reducirse esa representación reducible. Aplicación de la reducción de una representación Para identificar los caracteres cada desplazamiento que se mueve hacia una nueva ubicación bajo una operación de simetría particular contribuye con cero al carácter de esa operación; aquellos que permanezcan iguales contribuyen con 1; finalmente, los que se invierten contribuyen con -1 • De esta manera, como los 15 desplazamientos permanecen inamovibles por efecto de la identidad, (E) = 15. • Una rotación C2 deja sólo al desplazamiento z en el Pd sin cambio (contribuyendo con 1) pero invierte sus desplazamientos en x y y (contribuyendo con -2), de modo que (C2) = -1. Aplicación de la reducción de una representación • Con la reflexión , los desplazamientos en z y x del Pd no sufren cambio (contribuyendo con 2) mientras que su desplazamiento en y se invierte (y contribuye con -1), de modo que () = 1. • Por último, para cualquier reflexión en un plano vertical que pase a través del plano de los átomos, los cinco desplazamientos z en esos átomos permanecerán iguales (contribuyendo con 5), como también ocurre con los cinco desplazamientos y (otros 5), pero los cinco desplazamientos x se invierten (contribuyendo con -5); en consecuencia, (´) = 5. Por consiguiente, los caracteres de serán: E C2 v ´v 15 -1 1 5 Aplicación de la reducción de una representación • Ahora utilizaremos la ecuación, haciendo que h = 4 para este grupo. Para encontrar cuántas veces aparece la especie de simetría A1 en la representación reducible, escribimos 1 C1 1 x 15 1 x (1) 1 x 1 1 x 5 5 4 • Repitiendo este procedimiento para las otras especies, hallamos 5 A1 2 A2 3B1 5B2 Para C2v, las traslaciones de la molécula completa comprenden A1 + B1 + B2 (como lo dan las funciones x, y y z en la columna final) y las rotaciones comprenden A2 + B1 + B2. Al restar estas especies de simetría de las que acabamos de determinar, concluimos que las vibraciones de la molécula comprende 4A1 + A2 +B1 + 3B2 [modos normales = 3(5) – 6 = 9]. Aplicación de la reducción de una representación Muchos de los modos del cis-[PdCl2(NH3)2] son movimientos complejos que no son fáciles de visualizar: éstos incluyen alargamientos Pd-N y varios movimientos de flexión del plano; sin embargo, aún sin visualizarlos con facilidad, podemos inferir que los modos A1, B1 y B2 (debido a que las funciones x, y y z y, por tanto, los componentes del dipolo eléctrico, comprenden estas especies de simetría) son activos en IR y todos los modos son activos en Raman (porque las formas cuadráticas comprenden a las cuatro especies) Lecturas recomendadas • Cotton F. Albert. Aplicaciones químicas de la teoría de grupos. Tercera edición. • Atkins P. Physical Chemistry. Octava edición. Pags. 404 – 428. • Shriver and Atkins. Química inorgánica. Cuarta edición. Pags. 196 – 218. • Huheey James E. Inorganic Chemistry: Principles of Structure and Reactivity. Cuarta edición. Pags. 47-91. • Miessler Gary L. Inorganic Chemistry. Tercera edición. Pags. 72115. Notas personales • Para maestría incluir aplicaciones a sólidos (cristalografía).
Anuncio
Descargar
Anuncio
Añadir este documento a la recogida (s)
Puede agregar este documento a su colección de estudio (s)
Iniciar sesión Disponible sólo para usuarios autorizadosAñadir a este documento guardado
Puede agregar este documento a su lista guardada
Iniciar sesión Disponible sólo para usuarios autorizados