Alcalinos
Anuncio

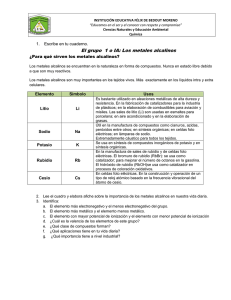
Litio, sodio, potasio, rubidio, cesio y francio Hidrogeno (H), Z = 1 Litio (Li), Z = 3 Sodio (Na), Z = 11 Potasio (K), Z = 19 Rubidio (Rb), Z = 37 Cesio (Cs), Z = 55 Francio (Fr), Z = 87 Introducción • Grupo de elementos extremadamente reactivos. • Sus propiedades físicas y químicas pueden interpretadas en base a su configuración ns1. ser • Han sido estudiados extensivamente, tanto experimental como teóricamente. • Compuestos de Na y K han sido usados desde tiempos remotos. Introducción • El Na y K son esenciales para la vida animal • El Li fue aislado a principios del siglo XIX, pero no tubo grandes aplicaciones industriales hasta mediados del siglo XX • Rb y Cs son elementos de interés académico pero hasta ahora tienen muy pocas aplicaciones en la industria. • El elusivo Fr, (de vida-media radiactiva corta) fue solo descubierto hasta 1939 Descubrimiento 1807 Humphry Davy aísla el K y el Na por electrolisis de KOH fundido 1817-18 Arfvedson descubre y aísla el Li (griego = piedra) en contraste con Na y K (vegetales) 1860-61 Bunse y Kirchhoff descubren el Cs y el Rb espectroscópic amente. (Latin Rubidus = rojo oscuro; caesius = azul cielo) 1939 Perey Marguerite identifica el Fr y le da el nombre en honor a su país. El Fr se encuentra en trazas en la naturaleza debido al mecanismo nuclear del Ac (227) en la serie del U(235) 227 89 (1,38%) Ac t1/ 2 21,77 y 223 87 Fr 21,8min 223 88 Ra 11,43 d La abundancia terrestre del Fr ha sido estimada en 2 x 10 -18 ppm, lo cual corresponde a un total de solo 15 g en 1 Km2 de la corteza terrestre. Propiedades de los metales alcalinos Coloración a la llama Reactividad • Estado de oxidación +1 (bajo valor de I1 y alto valor de I2) •Cuando son cortados, los metales presentan un alto lustre, que rápidamente desaparece debido a la acción del aire y la humedad. •Reaccionan con los halógenos violentamente, en algunos casos explosivamente. •Todos los metales alcalinos reacciona con el hidrógeno. •Reaccionan con sustancias dadoras de protones [ejemplo: alcoholes, NH3(g)]. Soluciones de metales alcalinos en amoniaco líquido Uno de los aspectos más sobresalientes de los metales alcalinos es su solubilidad en amoniaco líquido para formas soluciones metaestables, de color azul brillante con propiedades inusuales. La conductividad de estas soluciones diluidas es un orden de magnitud mayor que las soluciones de sales completamente ionizadas en agua. La densidad de la solución es menor que la densidad del amoniaco líquido. M am M am am e Equilibrio predominante a bajas concentraciones (alta conductividad, 280 veces mas grande que la solución del catión) M am am M am e Equilibrio que empieza a predominar a medida que la concentración aumenta (la conductividad cae debido a la remoción de e- móviles en forma del complejo M-am) ( M 2 ) am 2 M am Subsecuentemente con el aumento de la concentración la especie Mam empieza a dimerizar para dar (M2)am, en la cual la interacción entre los dos electrones es lo suficientemente fuerte para dar un sistema de spin diamangético Inestabilidad de las soluciones amoniacales de los metales alcalinos 1 M NH 3 MNH 2 H 2 2 Amida Sin embargo, bajo condiciones anhidras y en ausencia de impurezas catalíticas (como iones metálicos de transición) las soluciones pueden ser guardadas por varios días con solo un pequeño porcentaje de descomposición Aplicaciones de las soluciones amoniacales de los metales alcalinos Este tipo de soluciones actúan como poderosos y selectivos agentes reductores NH 3 / 33 C K 2 Ni CN 4 2 K K 4 Ni 0 CN 4 NH 3 / 33 C Pt NH 3 4 Br2 2 K Pt 0 NH 3 4 2 KBr NH 3 / 33 C Mn2 CO 10 2 K 2 K Mn1 CO 5 NH 3 / 33 C Fe CO 5 2 Na Na2 Fe 2 CO 4 CO Aplicaciones de las soluciones amoniacales de los metales alcalinos Muchas especies protónicas reaccionan liberando hidrógeno (H2) 1 RC CH e RC C H 2 2 1 GeH 4 eam GeH 3 H 2 2 1 NH 4 eam NH 3 H 2 2 1 AsH 3 eam AsH 2 H 2 2 1 EtOH eam EtO H 2 2 am Aplicaciones de las soluciones amoniacales de los metales alcalinos Reacciones que involucran el rompimiento de enlace por la adición de uno o dos electrones (éste último caso se forman 2 aniones o un dianión) am R2 S e 1 RS R2 2 Ge2 H 6 2eam 2Ge2 H 3 PhNHNH 2 2eam PhNH NH 2 PhN O 2eam PhN O am S8 2e S8 2 Compuestos y sus reacciones químicas Haluros alcalinos Los haluros alcalinos son sólidos cristalinos sin color de alto punto de fusión, que pueden ser preparados por reacción entre el correspondiente hidróxido (MOH) o carbonato (M2CO3) con el respectivo hidrácido (HX) MOH HX MX H 2O Haluros alcalinos Hidruros alcalinos Todos los elementos del Grupo I forman hidruros, sólidos iónicos blancos, por directa combinación con hidrógeno. Todos los hidruros son estables en aire seco pero reaccionan con agua, la fuerza de la reacción se incrementa con el aumento del peso molecular del hidruro. MH H 2O MOH H 2 Óxidos, peróxidos y superóxidos Cuando los metales alcalinos son quemados en presencia de aire los productos predominantes dependerán del metal: • Li forma Li2O (más algo de Li2O2) • Na forma Na2O2 (más algo de Na2O) • K, Rb y Cs forman el superóxido MO2 Óxidos, peróxidos y superóxidos Los óxidos “normales” M2O (Li, Na, K, Rb) son termicamente estables hasta una temperatura 500 °C y tienen todos la estructura de la antifluorita: Empaquetamiento cúbico compacto (CCP) de iones Ca2+(O2-) + iones F(Na+) en todos los huecos tetraédricos: estequiometria MX2(M2X) Óxidos, peróxidos y superóxidos Li2O puro puede ser preparado más convenientemente por descomposición térmica del Li2O2. Na2O puede ser obtenido por reacción del Na2O2, NaOH o preferiblemente NaNO2 con sodio metálico: Na2O2 2 Na 2 Na2O 1 NaOH Na Na2O H 2 2 1 NaNO2 3Na 2 Na2O N 2 2 Hidróxidos Los hidróxidos de los metales alcalinos se pueden preparar a partir del óxido M2O con agua. Por ejemplo: Na2O H 2O 2 NaOH Todos los hidróxidos de los metales alcalinos son solubles en agua, en donde se comportan como bases fuertes. Por ejemplo: KOH K OH H 2O Los hidróxidos de los metales alcalinos reaccionan CO2 del aire: H 2O 2OH CO2 CO32 H 2O Con un exceso de CO2 los hidróxidos forma el correspondiente hidrogenocarbonato: OH CO2 HCO3