RECURSOS ... Motores térmicos. Circuitos frigoríficos Unidad 6
Anuncio
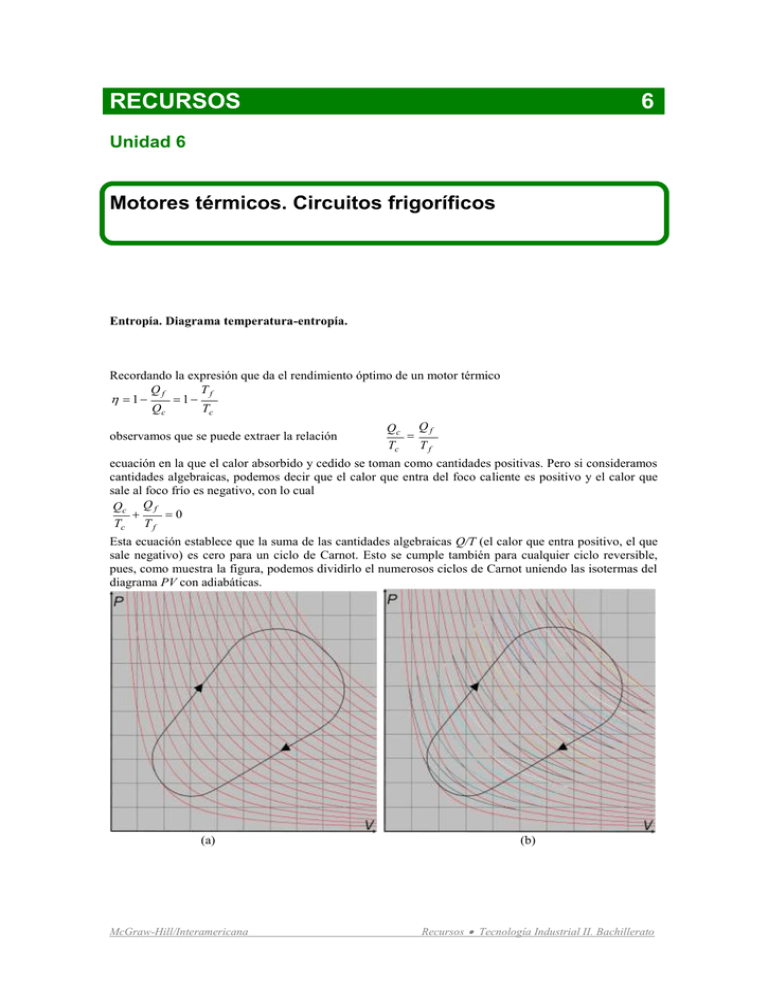
RECURSOS 6 Unidad 6 Motores térmicos. Circuitos frigoríficos Entropía. Diagrama temperatura-entropía. Recordando la expresión que da el rendimiento óptimo de un motor térmico Qf Tf 1 1 Qc Tc observamos que se puede extraer la relación Qc Q f Tc Tf ecuación en la que el calor absorbido y cedido se toman como cantidades positivas. Pero si consideramos cantidades algebraicas, podemos decir que el calor que entra del foco caliente es positivo y el calor que sale al foco frío es negativo, con lo cual Qc Q f 0 Tc Tf Esta ecuación establece que la suma de las cantidades algebraicas Q/T (el calor que entra positivo, el que sale negativo) es cero para un ciclo de Carnot. Esto se cumple también para cualquier ciclo reversible, pues, como muestra la figura, podemos dividirlo el numerosos ciclos de Carnot uniendo las isotermas del diagrama PV con adiabáticas. (a) McGraw-Hill/Interamericana (b) Recursos Tecnología Industrial II. Bachillerato (b) Figura (a) ciclo reversible sobrepuesto sobre una familia de isotermas. (b) Las isotermas, en rojo, se unen con adiabáticas para formar una agrupación de ciclos de Carnot. (c) El ciclo lo podemos descomponer en dos tramos de 1 a 2 y de 2 a 1. De esta forma, en un ciclo cerrado reversible se cumple Qi T 0 i Si solamente tenemos una transformación entre dos estados inicial (1) y final (2), podemos considerar en la figura (c), que un ciclo cerrado reversible lo descomponemos en dos tramos reversibles, de tal forma, que según la igualdad anterior: 2 Qj 1 j T 1 2 Qk Tk Los subíndices j indican los tramos en que dividimos la transformación de 1 a 2, los subíndices k la división de 2 a 1. Esta división en tramos, como en el caso anterior se hace con isotermas y con adiabáticas (podría ser cualquier otro tipo de transformación reversible, pero, como unos párrafos más adelante se verá, resulta muy sencillo el tomar éstas). Al cociente entre la cantidad de calor intercambiada y la temperatura se le conoce como entropía (proviene del griego y significa girar o evolucionar) y la igualdad anterior se conoce como teorema de Clausius. Q S T La unidad de medida de la entropía en el S.I. es el clausius 1 clausius = 1 julio 1º kelvin Es decir, un clausius será la variación de entropía que experimenta un sistema cuando absorbe el calor de 1 julio a la temperatura de 1ºK. Como se ha visto, la variación de la entropía, en un proceso reversible, no depende del camino recorrido, pues hemos obtenido el mismo valor absoluto desde el estado 1 al 2 por el camino a que del 1 al 2 por el camino b. Ello es importante, pues de forma indirecta podemos determinar el valor de la cantidad de calor intercambiado para pasar de un estado inicial a otro final: Q12 T j S j La cantidad de calor intercambiada es igual al producto de la temperatura por la variación de la entropía. Como quiera que la temperatura puede ir variando es por lo que se ha dividido el camino en trozos en los que se supone que la T se mantiene constante. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Observamos que nos sucede algo parecido a lo que teníamos con la expresión del trabajo cuando la fuerza era variable en el capítulo anterior ( W Fi xi ) La utilidad, para nosotros, de lo que acabamos de definir radica en que es posible utilizar otro tipo de diagramas, además de la gráfica PV o Fx, para representar un proceso que conduzca de un estado inicial a otro final. Es el diagrama TS. Si en el eje de abcisas representamos la entropía S y en el de ordenadas la temperatura T, el área bajo la línea que une dos estados 1 y 2 representa el calor intercambiado. Como al realizar un ciclo el trabajo coincide con el calor intercambiado, el área encerrada en un ciclo representado en el diagrama TS coincidirá con el área encerrada cuando se representa el ciclo en el diagrama PV, (a) (b) Figura. (a)El área marcada en el diagrama TS representa el calor intercambiado para ir de 1 a 2. (c) Ciclo de Carnot en el diagrama TS. Véase como las transformaciones isotermas y adiabáticas tienen una representación muy simple en el diagrama TS, son líneas rectas paralelas a los ejes, por lo que el cálculo de las áreas es muy sencillo (rectángulos). Además es de gran aplicación las máquinas que emplean vapor como fluido energético, ya la propiedad entropía del vapor de agua se encuentra en tablas para diferentes condiciones. El rendimiento del ciclo de Carnot será: Q Q F (T1 T2 )(S B S A ) T1 T2 C Tal como ya habíamos deducido. QC T1 ( S B S A ) T1 También afirmamos que en todo proceso real, por tanto irreversible el rendimiento era inferior al del ciclo de Carnot, es decir, en el caso de un motor que intercambia calor entre un foco caliente T 1 y un foco frío a temperatura T2 Q Q F T1 T2 C QC T1 QC Q F 0 T1 T2 si consideramos el calor tomado como positivo y el cedido como negativo (con sus signos algebraicos) podemos poner la desigualdad anterior como una suma de entropías. Además, como hicimos anteriormente, superponemos el ciclo del motor en sobre un diagrama de isotermas que unimos con adiabáticas, tenemos y en consecuencia Qi T 0 i Como antes, se debe tener en cuenta que T no es la temperatura del sistema, sino que corresponde a la temperatura de los recintos en que hemos dividido el ciclo y donde se intercambia calor. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato La anterior desigualdad se conoce como desigualdad de Clausius, y viene a indicar que los procesos se realizan de tal forma que la entropía final es siempre mayor que la inicial. Es decir, la evolución de los procesos apunta en la dirección de aumento de entropía. Observar también que, de alguna manera, la entropía marca la energía no utilizable. Efectivamente, la energía utilizable será T Energiautilizable QC 1 2 T1 El signo igual se aplica a los procesos reversible y el menor a los irreversibles. Se observa, que puesta así la ecuación del rendimiento (se despeja simplemente la energía o trabajo útil), del calor QC que se toma T del foco caliente, parte de esa energía QC 2 no puede utilizarse, y como QC/T1 representa el incremento T1 de entropía del sistema en un proceso reversible, tendremos Energía no utilizable=T2 S Si es irreversible esta energía no utilizable será mayor. Se concluye afirmando que la entropía va asociada a la degradación de la energía. B. Motor rotativo de combustión externa. Turbina. Otra posible solución es la expansión del vapor en una turbina . El vapor pasa a través de unas toberas en las cuales pierde presión y gana velocidad, a la vez que se orienta el flujo de manera que incida tangencialmente sobre la turbina. La turbina está formada por un rodete que tiene insertados un conjunto de álabes (paletas), los cuales absorben la energía de la corriente produciendo la rotación del eje. Figura. Turbina y sección de un álabe. Sobre el álabe se originan una serie de fuerzas resultado del choque del vapor con el mismo y, sobre todo, de la acción hidrodinámica debida a la forma del álabe que hace que el vapor circule por el extradós a más velocidad que por el intradós. Esto produce una depresión (por aplicación del teorema de Bernuoilli que se verá en el tema dedicado a los circuitos oleohidráulicos) en la zona en la que el fluido va a más velocidad, con lo que el álabe hace girar la rueda en dicho sentido. La forma de las diferentes secciones del álabe está normalizada y su inclinación radial o ángulo de hélice varía según la distancia al centro, siendo mayor cerca de éste. Actualmente, las turbinas de vapor son ampliamente utilizadas en las grandes centrales de producción de energía eléctrica. Otras aplicaciones de la turbina de vapor son la propulsión de buques o las instalaciones soplantes de altos hornos. Un tipo particularmente importante de aplicación de las turbinas de vapor es el de aquellas industrias que necesitan vapor para el proceso y electricidad para el funcionamiento de los equipos, como las industrias McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato que producen papel o las que procesan alimentos. En estos casos puede implantarse un esquema de cogeneración en el que se produce el vapor necesario para el proceso y el resto se expande en la turbina para obtener, mediante un alternador, energía eléctrica. C. Diagramas p-V de un fluido condensable. Balance energético. En los ciclos termodinámicos que sirven de base a las máquinas que utilizan vapor hay que tener en cuenta que las diferentes transformaciones no las realiza un gas perfecto. Se trata de un fluido condensable: es decir, se produce un cambio de estado de vapor a líquido (además del sólido). Por lo tanto, de alguna forma debemos recurrir a diagramas en los que aparecen las diferentes fases, semejantes a los de las aleaciones. En nuestro caso, solamente vamos a tratar las fases de líquido, vapor y gas. Distinguimos el vapor del gas, pues el primero puede tener fase líquida en suspensión, el segundo cumple más aproximadamente las leyes de los gases perfectos. Además, entre la fase de vapor y gas existirá una intermedia que llamaremos vapor recalentado, en ella no se cumplen las leyes de los gases perfectos. La figura siguiente nos ayudará a comprender la evolución de un fluido condensable, en nuestro caso vapor de agua (en las máquinas frigoríficas, que veremos más adelante, se emplean otros fluidos, como el vapor de amoniaco o el CO2). En el eje de abcisas en lugar de representar el volumen de una masa cualquiera, se representa el volumen específico o volumen de la unidad de masa; o sea el volumen que ocupa 1 kg. Debemos recordar que, mientras se realiza el cambio de estado, la temperatura permanece constante y, en este caso, al no ser un gas perfecto, las isotermas no serán hipérbolas. Así tenemos: Figura. Isotermas de un fluido condensable. - La curva, aproximadamente parabólica, CKS se denomina curva de Andrews. La rama C1C2K representa la transición de la fase líquida a la zona donde coexisten el vapor y el líquido, es la curva de condensación. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato - La rama KS2S1 representa la transición a la fase de vapor, donde ya no hay líquido, es la curva de saturación. En los puntos de esta rama se dice que el vapor está saturado. - Puesto que durante la transición de líquido a vapor la temperatura permanece constante, cuando la transformación también se realiza a presión constante (por ejemplo, una cacerola en la que hierve agua está a la presión de 1 Atm y a 100ºC), resulta que la isoterma es horizontal en la zona C1S1. O sea, en el interior de la curva de Andrews las isotermas son horizontales, pues es donde se realiza la transición líquido a vapor y viceversa. - Un punto dentro de la curva de Andrews tal como el D1, representa un vapor húmedo cuyo grado o título (tanto por uno o por ciento de vapor saturado seco en la mezcla) es: x C1 X 1 (observa que es en todo semejante a la ley de la palanca de las aleaciones). C1 S1 La cantidad de líquido será 1 x X 1 S1 . C1 S1 - Se pueden unir todos los puntos X1, X2, etc. interiores a la curva de Andrews que tengan el mismo título, obteniendo así las curvas de igual título. - A medida que la temperatura se eleva (subimos de isoterma) el segmento horizontal SiCi va disminuyendo (S1C1>S2C2>...) hasta convertirse en un punto K donde la isoterma es tangente a la curva de Andrews. La línea MN es la isoterma crítica y K el punto crítico. - Las curvas de saturación, la de condensación y la isoterma crítica dividen al plano en cuatro regiones representadas en color en la figura de arriba. Ejemplo Una caldera cuyo volumen es de 6,6 m3 contiene 95 kg de vapor húmedo a 135ºC. Determinar la cantidad de agua y el volumen de cada una de las fases (datos facilitados en tablas: presión de saturación a 135ºC es 3,1305 bar; volumen específico del líquido a esa temperatura vC=1,0747 l/kg; volumen específico del vapor a esa temperatura vS=582,00 l/kg). Solución: V 6,6 m 3 m3 m3 0.06947 69,47 m 95kg kg kg Llevando los datos y este resultado a una curva de Andrews podemos tener el título del vapor húmedo según la figura siguiente: El volumen específico del vapor húmedo es v X Figura. Ejemplo 6.2 x C1 X 1 v X vC 69,47 1,0747 68,3953 0,1177 11,77% C1 S1 v S vC 582 1,0747 580,9253 McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Las masas de líquido y de vapor saturado se pueden calcular ahora mC 1 x m 1 0,1177 95 83.8185kg mS x m 0,1177 95 11.1815kg El volumen que ocupan estas masa es fácil calcularlo al disponer del volumen específico VC mC vC 83,8185 1,0747 90.08 l 0,09 m3 VS mS vS 11,1815 582 6507.633l 6,5 m3 Para realizar el balance energético en este tipo de máquinas donde conviven la fases de vapor y de líquido es muy útil emplear la ecuación a la que se llegó en la ampliación del tema anterior: 1 1 m v12 m g z1 H1 Q m v2 2 m g z 2 H 2 W 2 2 Si se considera que la diferencia de alturas es despreciable, la ecuación queda 1 1 m v12 H1 Q m v2 2 H 2 W 2 2 Si, como es habitual, se realizan los cálculos para la unidad de masa, al dividir los dos miembros entre m tendremos lo que se denominan valores específicos: 1 2 1 v1 h1 q v 2 2 h2 w 2 2 Por último, en este apartado vamos a determinar la entalpía de un vapor de título x ya que su valor nos permitirá realizar cálculos energéticos. Así, una masa m de vapor húmedo de título x, en el interior de la campana de Andrews, sabemos que contendrá mC kg de agua condensada y mS kg de vapor saturado, por lo que la entalpía específica (por unidad de masa) es: hx Hx mC mS hC hS 1 x hC x hS hC xhS hC m mC m S mC m S Análogamente se puede hacer con la entropía del vapor sx Sx mC mS sC s S 1 x sC x s S sC xs S sC m mC m S mC m S Donde el primer sumando, de la igualdades centrales, corresponde a la proporción de agua en estado líquido y el segundo a la proporción de agua en estado de vapor. Ejemplo En un condensador de la instalación de una turbina entra vapor húmedo a la presión de 0,04 bar y un título de 0,82 y sale como líquido saturado a la misma presión. Calcular la cantidad de calor cedida al circuito de refrigeración. (Datos: Entalpías del vapor de título 0,82 a la presión de 0,04 bar h C=121,31 kJ/kg para el líquido y hS=2553,82 kJ/kg para el vapor). Solución: Por el primer principio de la termodinámica el calor que absorbe el refrigerante será la diferencia entre las entalpías de salida y entrada. En efecto, en la última ecuación se considera que las velocidades a la entrada y salida son iguales y que no se produce trabajo útil: 1 2 1 v1 h1 q v2 2 h2 w h1 q h2 q h2 h1 2 2 Observa que esta expresión se dedujo para a una aportación de calor, luego si el signo sale negativo es que el calor sale del sistema. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Figura. Sección de un tubo de condensador (refrigerador). La entalpía de entrada será la suma de la del líquido y la del vapor húmedo h1 hC xhS hC 121,31 0,822553,82 121,31 2115,97kJ/kg La entalpía de salida coincide con la del líquido h2 121,31kJ/kg Luego el calor cedido por el vapor a condensar es q h2 h1 2115,97 121,31 1993.66kJ/kg (el signo menos indica que es un calor que sale del sistema, en este caso al refrigerante) Ejemplo La bomba de alimentación de una caldera hace que el agua que entra en estado líquido saturado a 86ºC salga a 35 bar. Si la compresión es adiabática y reversible calcular: a) El trabajo realizado por la bomba b) La entalpía de salida del agua. c) La potencia del motor acoplado al eje de la bomba si son bombeados 30 m3/h. Datos: Para una temperatura de saturación de 86ºC la presión de saturación es 0,60107 bar y la entalpía del agua líquida 360,11 kJ/kg. Tomar como unidad de masa para los cálculos el kg de fluido. Solución: Como no nos dan datos acerca del volumen específico (o de su inversa, la densidad) del agua a las diferentes presiones consideramos el valor de 1 kg/dm3 (en realidad a la presión de 35 bar el volumen específico es 1,2163 dm3/kg y a 0,60107 bar son 1,0331 dm3/kg). Figura a) En este caso no hay transferencia de calor (proceso adiabático, aunque siempre la bomba tendrá unas perdidas por fricción del fluido y de los elementos mecánicos) y las velocidades a la entrada y la salida son iguales y también los volúmenes (el agua es prácticamente incompresible), luego con la ecuación del balance energético w h1 h2 y como la entalpía es el producto del volumen por la presión y el volumen m3 J N permanece constante w h1 h2 v p1 p2 103 0,60107 35105 2 3439,893 kg kg m Observar que el signo menos indica que es un trabajo realizado en contra del sistema, pues la expresión se dedujo con la condición de que el sistema realizaba un trabajo utilizable exteriormente. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato b) De la primera parte de las igualdades anteriores kJ kJ kJ h2 h1 w 360,11 3,44 363,55 kg kg kg c) Si sabemos la cantidad de agua bombeada, como hemos calculado el trabajo para la unidad de masa, al multiplicar por la masa movida en la unidad de tiempo tendremos la potencia kJ kg Pot 3,44 30000 28,7 kw (ya sabemos que es la potencia de un motor externo al kg 3600s sistema, por eso no se ha colocado el signo menos). Hasta ahora hemos estudiado lo que sucede en diferentes zonas de una instalación de vapor, seguidamente conoceremos el comportamiento en la propia máquina de vapor o en la turbina. D. Ciclo de un motor de combustión externa. El ciclo básico que realizan las máquinas de vapor, sean alternativas o rotativas, se ilustra en la figura.a en un diagrama PV y en la figura b en un diagrama TS, pero tomando la unidad de masa de vapor (1 kg), con lo que el volumen y la entalpía son específicas (por la unidad de masa). Para explicar mejor lo que sucede en el diagrama, en la figura c se han colocado los elementos que debieran realizar cada una de las etapas. (a) (b) (c) Figura a) Ciclo Rankine realizado por una máquina térmica de combustión externa en diagrama PV. b) Ídem en diagrama TS. c)Elementos de instalación precisos para realizar el ciclo. 1º. Vamos a comenzar con el líquido que sale de la bomba (estado 5). Como de forma horizontal (presión constante) ha de pasar al estado 2 del líquido saturado, observamos que atraviesa dos isotermas, la que McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato pasa por 5 y la que pasa por 1 (que dentro de la curva de Andrews coincide con la isocora, pues el cambio de estado se realiza a presión constante). Ésta es la tarea del precalentador, calentar el agua a la presión existente en la caldera hasta la saturación (estado 1 sobre la curva de condensación). 2º. Seguidamente, se calienta en la caldera hasta el estado 2, donde todo el agua es vapor saturado. 3º. En el interior del motor (turbina o cilindro) cede energía mediante una transformación adiabática, con lo que se alcanza el estado 3 a menor presión (la del condensador) y el vapor ahora es húmedo. 4º. En el condensador, el vapor húmedo condensa hasta la saturación el intercambiador de calor (condensador). 5º. Ahora, el líquido saturado se comprime adiabáticamente desde la presión del condensador hasta la presión de la caldera. Ello trae como consecuencia un ligero aumento de temperatura T 5-T4, ya que se observa que hemos cambiado de isoterma. Si se considera que el agua es prácticamente incompresible (lo que no es exactamente cierto) esta línea sería vertical, es decir una isocora. El calor en el ciclo de Carnot estudiado al principio se absorbía en una sola etapa, aquí lo hace en dos 5→1 y 1→2. Por ello para calcular el rendimiento podemos emplear la misma fórmula, pero considerando la temperatura media del foco caliente y la temperatura media del foco frío que son respectivamente Tbm y Tam. Rankine 1 Tbm Tam Como existen buenas tablas que facilitan las entalpías y entropías así como otras características referentes a agua en diversas condiciones, es más interesante emplear la expresión del rendimiento en función de los calores absorbidos y cedidos: Rankine q abs q ced h2 h5 h3 h4 q abs h2 h5 El trabajo que debe realizar la bomba es wbomba h5 h4 v pb p a Observando, en este último caso, que se ha considerado al agua líquida como un fluido incompresible, lo que implica que la adiabática 4→5 es también una isocora (vertical). Ejemplo Un ciclo Rankine de una pequeña turbina, semejante al expuesto, trabaja entre las presiones de 0,20 bar y 45 bar. Calcular el rendimiento térmico del mismo y el trabajo realizado por la bomba. Si la cantidad de agua movida por la bomba es de 5 m3/h, determina a potencia que suministra la turbina y la consumida por la bomba. Completar, asimismo, la tabla de datos. Datos: Estado p (bar) hC hS x h sC sS s (kJ/kg) (kJ/kg) (kJ/kgºK) (kJ/kgºK) 1 45 1122,1 2797,8 2,885 6,001 2 45 3 0,20 251,46 2609,1 0,8321 7,907 4 0,20 5 45 Solución: De la tabla podemos completar bastantes celdas teniendo en cuenta que sobre la curva de condensación el título del vapor es 0 (puntos 4 y 1) y sobre la curva de saturación el título es 1 o 100% (punto 2): Estado p hC hS x h=hC(1-x)+hSx sC sS s=sC(1-x)+sSx 1 45 1122,1 2797,8 0 1122,1 2,885 6,001 2,885 2 45 1122,1 2797,8 1 2797,8 2,885 6,001 6,001 3 0,20 251,46 2609,1 0,8321 7,907 6,001 McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato 4 5 0,20 45 251,46 1122,1 2609,1 2797,8 0 251,46 No está dentro de la campana 0,8321 2,885 7,907 6,001 0,8321 No está dentro de la campana, pero es isoentrópico con 4. s=0,8321 La tabla de datos es sencilla de completar excepto en el punto 3 del diagrama de la figura anterior en el que hay que averiguar el título del vapor que no podemos calcular como en el ejemplo 2. Ahora bien, nos dan la entropía, por el diagrama TS y aplicando la ecuación en la que interviene el título, teniendo en cuenta que el punto 3 tiene la misma entropía que el 2 (la del 2 se conoce por estar en la curva de saturación): s3 s2 6,001 sC 1 x sS x 0,83211 x 7,907x x 6,001 0,8321 0,731 7,907 0,8321 Ahora podemos determinar la entalpía en el punto 3 kJ h3 hC (1 x) hS x hC xhS hC 251,46 0,7312609,1 251,46 1974,895 kg Los valores del título y de la entalpía del punto 3 se pueden llevar a la tabla, quedando así completa. El trabajo realizado por la bomba es lo más sencillo de determinar, considerando que el volumen específico (el volumen de 1 kg) del agua líquida no varía con la presión m3 kJ Pa wbomba v pb pa 0,001 45 0,20bar105 4,48 kg h5 h4 kg bar con ello podemos determinar la entalpía del punto 5 que está fuera de la curva de Andrews kJ h5 h4 wbomba 251,46 4,48 255,94 kg El calor absorbido por el agua de la caldera y precalentador es: kJ qabs h2 h5 2797,8 255,94 2541,86 kg El trabajo realizado por la turbina es la diferencia entre las entalpías del punto 2 y el 3 (parte de este trabajo se empleará en mover el compresor) kJ wturbina h2 h3 2797,8 1974,9 882,9 kg kJ El trabajo utilizable (tras mover el compresor) es wútil 882,9 4,5 878,4 kg Como mueve 5 m3/h de agua es lo mismo que 5000 kg/3600 s, con lo que podemos determinar la potencia suministrada al exterior de la instalación (se considera que la presión no tiene influencia en el volumen específico del agua líquida, lo que no es cierto). kJ kg P 878,4 5000 1220kw 3600s kg La potencia que consume la bomba es kJ kg P 4,5 5000 6,25 kw 3600s kg w El rendimiento es útil qabs kJ 878,4 kg 0,346 kJ 2541,86 kg Sobre este ciclo básico habitualmente se realizan modificaciones con el objeto de mejorar el rendimiento global de la instalación. Algunas de éstas son relativamente sencillas, pero otras no lo son tanto. A continuación mencionamos las más importantes: McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato - Recalentamiento del vapor antes de entrar en la turbina.- Puesto que además es imposible parar el calentamiento del vapor justamente en el punto 2 de la curva de saturación, el vapor se recalienta al salir de la caldera con lo que se baja su humedad y corroe menos los álabes. Figura siguiente. Figura Recalentamiento del vapor antes de entrar en la turbina. - Aumentar la presión pb de expansión.- Lo que equivale a llevar hacia arriba la línea 5122’ de la figura 6.17, con lo que aumenta el área que expresa el trabajo útil. - Disminuir la temperatura T4 de inicio de la expansión.- Lo que equivale a llevar hacia abajo la línea 34 de la figura 6.17. También aumenta el área del trabajo útil. - Recalentamiento del vapor de salida de la turbina.- El vapor de salida de la turbina se vuelve a calentar y se hace pasar por una segunda turbina, lo que sucede a una presión inferior que en la primera. En la figura siguente puede verse también el aumento del área del trabajo útil. En las figuras siguientes, para facilitar su comprensión se ha omitido el precalentador y el recalentamiento del vapor de la caldera, de hecho se puede considerar que todo ello se realiza en una caldera moderna. Tampoco se dibuja el diagrama pV y solamente aparece el diagrama TS. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Figura Ciclo con recalentamiento intermedio del vapor - Precalentamiento del agua a la entrada de la caldera mediante la extracción de una parte del vapor antes de su total expansión. Ciclo regenerativo.- Esta operación se realiza extrayendo vapor de la turbina en diferentes etapas. Es decir, la turbina está dividida en etapas y en cada una de las que interese se extrae parte del vapor. Dicho vapor se lleva a unos intercambiadores de calor que realizan el calentamiento del agua que sale licuada del condensador y, además, licuan el vapor utilizado para el calentamiento de forma que siempre tengamos líquido saturado. La figura a muestra los diversos saltos de temperatura a lo largo del lateral de líquido saturado de la curva de Andrews. En la figura b se observa la relaciones de masas de agua que resultan en cada extracción y cada vez que sale de los intercambiadores. Figura. Ciclo regenerativo de una turbina de vapor y esquema de instalación. - Ciclo regenerativo con recalentamiento intermedio.- Es la combinación de las dos mejoras anteriores y es lo utilizado en la instalaciones modernas, tanto de centrales térmicas (queman un combustible como carbón o derivados del petróleo) y las nucleares (la caldera es parte del sistema de refrigeración del reactor). La figura siguiente muestra el resultado con una sola etapa McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Figura. Ciclo regenerativo con recalentamiento intermedio. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato E. Ciclos termodinámicos de los motores de encendido provocado (MEP) y de encendido por compresión (MEC). Rendimiento. MOTOR V6 CORTESÍA DE JAGUAR. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Para explicar, desde el punto de vista termodinámico, el funcionamiento de los motores de encendido por chispa se utiliza un ciclo termodinámico teórico llamado ciclo Otto, en el que se supone que introducimos aire al que consideramos como un gas perfecto. Este ciclo está representado en el diagrama p-v de la figura siguiente (recuerda que en estos diagramas venimos utilizando el volumen de la unidad de masa, es decir, el volumen específico). Figura. Ciclo Otto ideal. Los procesos termodinámicos que tienen lugar según este diagrama son los siguientes: Tramo 0-1. Tiene lugar la admisión. • Tramo 1-2. Se realiza la compresión adiabática del fluido de trabajo. El área que delimitan las líneas 12, 2-A, A-B y B-1 es el trabajo introducido para realizar esta compresión. • Tramo 2-3. Absorción instantánea de calor en el momento de la explosión. Tiene lugar a volumen constante y su valor es: q 2,3 q abs cV T3 T2 (Nota: recuerda que las letras minúsculas significan valores específicos, es decir para la unidad de masa. Por lo tanto, si multiplicamos por la masa m tendremos en calor total). • Tramo 3-4. Expansión adiabática del pistón. El trabajo cedido es el área delimitada por las líneas 4-3, 3A, A-B, B-4. • Tramo 4-1. Cesión instantánea del calor a volumen constante al abrirse la válvula de escape, con lo que hay un descenso brusco de la presión y el calor cedido es: q 4,1 qced cV T4 T1 Tramo 1-0. Expulsión de los gases. Como puede observarse, se han realizado seis etapas, pero que en la realidad se producen en cuatro carreras del pistón (dos vueltas). El trabajo neto que se extrae del ciclo es la resta de las dos áreas anteriores, es decir, el área interior al ciclo, o bien la diferencia entre el calor que entra y el que sale, por lo que el rendimiento es: McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato q q ced q c T 4 T 1 w T 4 T1 abs 1 ced 1 v 1 q abs q abs q abs c v T 3 T 2 T3 T2 Por ser adiabáticas las líneas 3-4 y 1-2, podemos relacionar las temperaturas y los volúmenes: Otto T3 V4 T4 V3 1 V B VA 1 T3 T2 T3 T2 VB T4 T1 T4 T1 V A T2 V1 T1 V2 1 V B VA 1 , es decir 1 Comparando esta expresión con la del rendimiento y como hemos definido la relación de compresión volumétrica como el volumen barrido por el pistón (VB) entre el volumen de la cámara de combustión (VA) VB , luego el rendimiento queda exclusivamente como una función de la relación de compresión VA volumétrica. r Otto 1 1 1 r ------------------------------------------------------------------------------------------------------Se debe observar que no es lo mismo la relación de compresión volumétrica que la relación de presiones. Solamente coinciden cuando la transformación es isotérmica y se aplica la ley de Boyle. En el caso del ciclo Otto y, posteriormente, el Diesel, la transformación se considera sin cesión o absorción de calor (se supone muy rápida), es decir, adiabática o isoentrópica, con lo que la ecuación que la define en función del volumen y de la presión es: V p p A V A p B VB B A r r p pB VA Así, en un motor de relación de compresión 9,5 (observa que es volumétrica), la relación de presiones sería rp 9,51,4 23,4 ---------------------------------------------------------------------------------------------------------Ejemplo El ciclo teórico para el estudio de los motores de encendido por compresión es el ciclo Diesel. Este ciclo termodinámico se muestra en el diagrama de la Figura siguiente. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Figura. Ciclo diesel teórico. Las fases de este ciclo son las siguientes: Tramo 0-1. Tiene lugar la admisión. • Tramo 1-2. Compresión adiabática, es decir, sin introducción ni extracción de calor. Al finalizar la compresión se llegan a alcanzar temperaturas próximas a 900ºK (más de 6000ºC) lo que provoca la ignición del combustible que se añade en el tramo siguiente. • Tramo 2-3. Absorción de calor que se realiza manteniendo la presión constante. Dicho calor lo aporta la combustión progresiva del combustible que se inyecta y se encuentra con el aire comprimido a elevada temperatura. Su valor es: q 2,3 q abs c p T3 T2 • Tramo 3-4. Expansión adiabática . • Tramo 4-1. Cesión de calor manteniendo el volumen constante. Este calor se queda en los gases de escape que serán arrastrados al abrirse la correspondiente válvula. Este calor es: q 4,1 qced cV T4 T1 Tramo 1-0. Expulsión de los gases. El trabajo neto que se extrae del ciclo es la resta de las dos áreas anteriores, es decir, el área interior al ciclo, o bien la diferencia entre el calor que entra y el que sale, por lo que el rendimiento es: c p T4 T1 q q ced q W 1 T4 T1 Diesel abs 1 ced 1 1 q abs q abs q abs cV T3 T2 T3 T2 pues como recordarás cp cV Multiplicando y dividiendo el numerador por T 1 y el denominador por T2 McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato T4 1 1 T1 T1 Diesel 1 T 2 T3 1 T2 En las adiabáticas se cumple tramo 1-2 T1v1 1 T 2v 2 1 Tramo 3-4 T 4v 4 1 T 3v3 1 De la primera obtenemos el primer cociente de temperaturas T1 v 2 T 2 v1 1 1 r 1 T 4 T 3 v3 T1 T 2 v2 v2 v3 T 3 v3 Y, en el proceso a volumen constante 2-3 se verifica T 2 T 3 T 2 v2 1 Dividiendo miembro a miembro y teniendo en cuenta que v4=v1 La relación de compresión volumétrica ya nos apareció en el ciclo Otto, ahora, además, aparece otra v3 relación de volúmenes que se denomina relación de combustión rc . v2 Así, los cocientes de temperaturas se pueden poner: T 4 T 3 v3 T1 T 2 v2 1 v3 v3 v2 v2 1 v3 rc v2 T 3 v3 rc T 2 v2 Con esto último podemos dejar la fórmula del rendimiento teórico de un motor Diesel rc 1 r 1 rc 1 Si lo comparamos con el ciclo Otto vemos que además de la relación de compresión volumétrica aparece el coeficiente adiabático y la relación de combustión Diesel 1 1 La diferencia entre los ciclos Otto y Diesel es, fundamentalmente, la forma en que se introduce el calor en ellos. Pero cuál de los dos posee mejor rendimiento. La respuesta no es sencilla, pues hay que tener en cuenta varias consideraciones: - Si la relación de compresión volumétrica es igual y también lo fuera la cantidad de calor que da el combustible en el ciclo (los dos emplearan el mismo combustible) la fórmula que da el rendimiento teórico es favorable al ciclo Otto, pues como rc>1 la segunda fracción también es mayor que la unidad. - Pero, como la relación de compresión del ciclo Diesel es en la realidad el doble que en el Otto, ya que este último está limitado por la detonación del combustible. Además, si bien el poder calorífico de gasóleo es ligeramente inferior al de la gasolina, sin embargo hay una diferencia en el dosado que es de 1/14,9 y 1/14,5, con lo que la misma cantidad de aire quema más combustible (14,9/14,5=1,028 a favor del gasóleo) lo que compensa el menor poder calorífico (43700/43200=1,012 a favor de la gasolina). Con todas estas consideraciones, que se han tenido en cuenta al realizar la gráfica de la figura siguiente, se observa que un ciclo Diesel tiene mayor rendimiento y, por tanto, proporciona más trabajo útil. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato Figura. Comparación de lo ciclos teóricos Otto y Diesel de relaciones de compresión volumétricas 10 y 20 respectivamente (se ha tenido en cuenta el dosado y el poder calorífico del combustible). Sin embargo, como ya te puedes imaginar, los ciclos reales difieren notablemente de los teóricos. Estos ciclos reales se obtienen mediante la medición directa de las variables utilizando complejos dispositivos indicadores, sin tener en cuenta ninguna de las simplificaciones que hemos mencionado anteriormente. McGraw-Hill/Interamericana Recursos Tecnología Industrial II. Bachillerato
