100 COMPUESTOS CH3 METILBENCENO OH
Anuncio
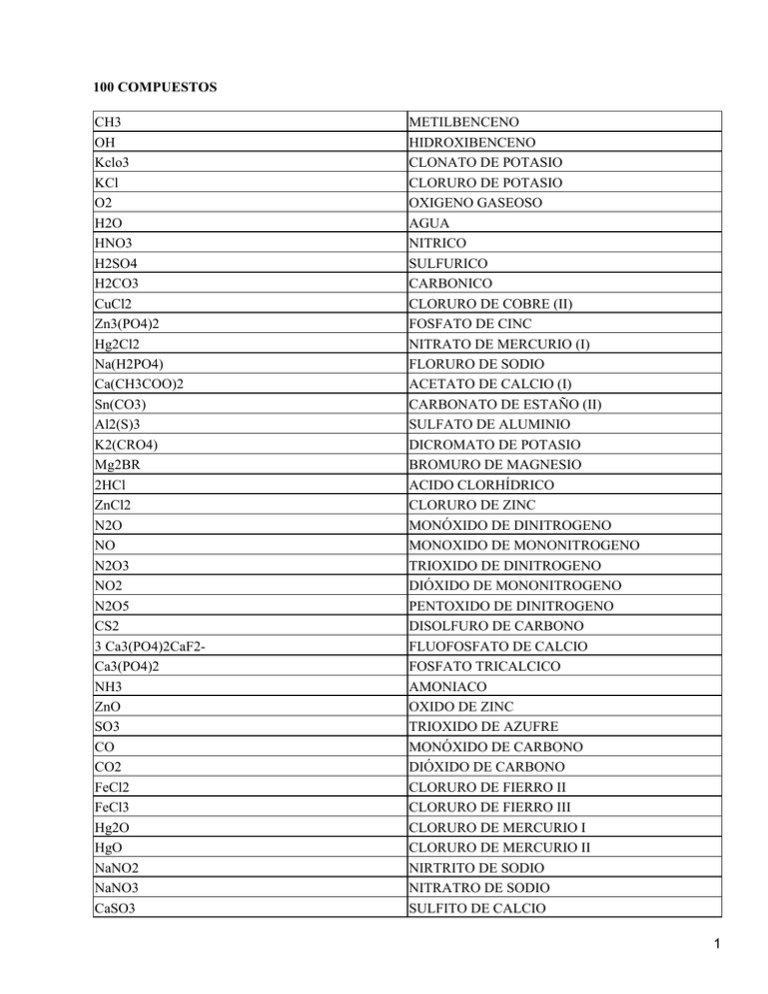
100 COMPUESTOS CH3 OH Kclo3 KCl O2 H2O HNO3 H2SO4 H2CO3 CuCl2 Zn3(PO4)2 Hg2Cl2 Na(H2PO4) Ca(CH3COO)2 Sn(CO3) Al2(S)3 K2(CRO4) Mg2BR 2HCl ZnCl2 N2O NO N2O3 NO2 N2O5 CS2 3 Ca3(PO4)2CaF2Ca3(PO4)2 NH3 ZnO SO3 CO CO2 FeCl2 FeCl3 Hg2O HgO NaNO2 NaNO3 CaSO3 METILBENCENO HIDROXIBENCENO CLONATO DE POTASIO CLORURO DE POTASIO OXIGENO GASEOSO AGUA NITRICO SULFURICO CARBONICO CLORURO DE COBRE (II) FOSFATO DE CINC NITRATO DE MERCURIO (I) FLORURO DE SODIO ACETATO DE CALCIO (I) CARBONATO DE ESTAÑO (II) SULFATO DE ALUMINIO DICROMATO DE POTASIO BROMURO DE MAGNESIO ACIDO CLORHÍDRICO CLORURO DE ZINC MONÓXIDO DE DINITROGENO MONOXIDO DE MONONITROGENO TRIOXIDO DE DINITROGENO DIÓXIDO DE MONONITROGENO PENTOXIDO DE DINITROGENO DISOLFURO DE CARBONO FLUOFOSFATO DE CALCIO FOSFATO TRICALCICO AMONIACO OXIDO DE ZINC TRIOXIDO DE AZUFRE MONÓXIDO DE CARBONO DIÓXIDO DE CARBONO CLORURO DE FIERRO II CLORURO DE FIERRO III CLORURO DE MERCURIO I CLORURO DE MERCURIO II NIRTRITO DE SODIO NITRATRO DE SODIO SULFITO DE CALCIO 1 CaSO4 H2CO3 H2SO3 H2SO4 KCl KClO KClO2 KClO3 KClO4 H2CO3 H2SO3 H2SO4 CaS CaO SO2 Ca(OH)2 H2SO3 CaSO3 ZnO FeO Fe2O3 Hg2O HgO Mg(OH)2 Cu(OH)2 2CuOH CO2 SO2 H2CO3 H2SO3 H2SO4 H2S HBr H2CO3 HNO2 HClO HClO2 H3BO3 HNO3 HClO3 HClO4 NaHCO3 K2HPO4 SULFATO DE CALCIO ACIDO CARBONICO ACIDO SULFUROSO ACIDO SULFURICO CLORURO DE POTASIO HIPOCLORITO DE POTASIO CLORITO DE POTASIO CLORATO DE POTASIO PERCLORATO DE POTASIO ACIDO CARBONICO ACIDO SULFUROSO ACIDO SULFURICO SULFURO DE CALCIO OXIDO DE CALCIO DIÓXIDO DE AZUFRE HIDROXIDO DE CALCIO ACIDO SULFUROSO SULFURITO DE CALCIO OXIDO DE ZINC OXIDO DE FIERRO II OXIDO DE FIERRO III OXIDO DE MERCURIO I OXIDO DE MERCURIO II HIDROXIDO DE MAGNESIO HIDROXIDO DE COBRE II HIDROXIDO CUPROSO ANHÍDRIDO CARBONICO ANHÍDRIDO SULFUROSO ACIDO CARBONICO ACIDO SULFUROSO ACIDO SULFURICO ACIDO SULFHIDRICO ACIDO BROMHIDRICO ACIDO CARBONICO ACIDO NITROSO ACIDO HIPOCLOROSO ACIDO CLOROSO ACIDO BORICO ACIDO NITRICO ACIDO CLORICO ACIDO PERCLORICO CARBONATO ACIDO DE SODIO FOSFATO MONOACIDO DE POTASIO 2 KH2PO4 NaHSO3 Na2SO3 NaHSO4 Na2SO4 H3PO4 KH2PO4 K2HPO4 K2PO4 NO N2O3 NO2 N2O5 CS2 3 Ca3(PO4)2CaF2Ca3(PO4)2 NH3 FOSFATO DIÁCIDO DE POTASIO SULFITO ACIDO DE SODIO SULFITO DE SODIO BISULFATO DE SODIO SULFATO DE SODIO ACIDO FOSFORICO FOSFATO MONOPOTASICO FOSFATO DIPOTASICO FOSFASTO TRIPOTASICO MONOXIDO DE MONONITROGENO TRIOXIDO DE DINITROGENO DIÓXIDO DE MONONITROGENO PENTOXIDO DE DINITROGENO DISOLFURO DE CARBONO FLUOFOSFATO DE CALCIO FOSFATO TRICALCICO AMONIACO OXIDOS METALICOS Los oxido metálicos son compuestos químicos binarios formados por la combinación del oxigeno con un metal; su característica primordial es que tiene que existir el oxigeno para poder formar un oxido metálico. Ej. Cu + O CuO Fe + O FeO Nomenclatura: Los oxido metálicos tienen una manera especifica para poder darles un nombre correcto, por lo cual se da la siguiente explicación de como dárselo: Se coloca la palabra OXIDO enseguida el nombre del metal y por ultimo él número de la valencia con numero romano. Ej. CuO Oxido de cobre II FeO Oxido de fierro II En la nomenclatura antigua se pondría oxido más el nombre del metal y agregando como un sufijo la terminación ICO para los compuesto con valencia mayor y la terminación OSO para los compuestos con valencia menor. Ej. 3 Compuesto Nom. Stock Antigua FeO Oxido de fierro II Oxido Ferroso Fe2O3 Oxido de fierro III Oxido Férrico OXIDOS NO METALICOS Los oxido no metálicos también conocidos como anhídridos son compuestos químicos binarios formados por la combinación del oxigeno con un no metal; su característica primordial es que tiene que existir el oxigeno para poder formar un oxido no metálico. Ej. C + O CO2 Nomenclatura: Los oxido no metálicos tienen una manera especifica para poder darles un nombre correcto, por lo cual se da los siguientes pasos de como dárselo: • Se anteponen los prefijos, MONO (1), DI (2), TRI (3), TETRA (4), HEPTA (5), etc., dependiendo la cantidad de oxígenos que contenga. • Enseguida del prefijo se pondrá la palabra OXIDO". • Por ultimo se coloca los prefijos MONO (1), DI (2), TRI (3), TETRA (4), HEPTA (5), etc., antes del nombre del no metal dependiendo de la cantidad de este y enseguida el nombre del no metal. Ej. CO2 Dióxido de carbono N2O3 Trióxido de dinitrógeno P2O5 Heptaoxido de difosforo En la nomenclatura antigua se pondría la palabra Anhídrido seguido del no metal y agregando como un sufijo la terminación ICO para los compuesto con valencia mayor y la terminación OSO para los compuestos con valencia menor. Ej. Compuesto Antigua CO Anhídrido carbonoso CO2 Anhídrido carbonico HIDROXIDOS Los Hidróxidos también conocidos como Bases son compuestos químicos formados por la combinación del oxido metálico mas el agua (H2O); siempre estará formado por un radical que es el OH el cual trabaja con valencia −1. 4 Ej. CA + OH Ca(OH)2 Nomenclatura: La nomenclatura de los Hidróxidos es un poco mas sencilla ya que solo se coloca la palabra Hidróxido mas el nombre del metal y la valencia con que trabaja con numero romano: Ej. Ca(OH)2 Hidróxido de calcio II NaOH Hidróxido de sodio I KOH Hidróxido de potasio I En la nomenclatura antigua se pondría la misma palabra Hidróxido seguido del metal y agregando como un sufijo la terminación ICO para los compuesto con valencia mayor y la terminación OSO para los compuestos con valencia menor. Ej. Compuesto Antigua CaOH Hidróxido calcioso Ca(OH)2 Hidróxido calcico ACIDOS BINARIOS Los Ácidos binarios también conocidos como Hidrácidos son compuestos ya antes mencionados como binarios esto es que se conforman por 2 elementos cuya molécula principal es de (H) hidrógeno y su formula general es HA (A significa el elemento que lo acompaña). Ej. H + F HF Nomenclatura: La nomenclatura de los hidrácidos es la siguiente; primero se pondrá la palabra ACIDO mas la raíz del nombre del elemento y por ultimo la terminación HÍDRICO. Ej. HCl Ácido clorhídrico HF Ácido fluorhídrico NO LOGRE ENCONTRAR LA NOMENCLATURA ANTIGUA. 5 ACIDOS OXIGENADOS Los Ácido oxigenados los cuales también llevan el nombre de Oxácidos son compuestos terciario esto es que se conforman por 3 elementos cuyas moléculas principales son el (H) hidrógeno y el (O) oxígeno. Ej. H3 + CO2 H2CO3 Nomenclatura: Un Oxácido se designa terminando en ICO el nombre del elemento que acompaña al oxigeno y al hidrógeno; pero si ese elemento forma dos ácidos diferentes, se emplea la terminación OSO para que el que tiene menos oxigeno, e ICO para el que tiene menos oxígeno. En el caso de existir cuatro ácidos diferentes con el mismo elemento, se recurre al prefijo HIPO que significa aún menos oxigeno, y PER que indica aún más que oxígeno. Ej. H2CO3 Ácido carbónico HNO2 Ácido nitroso HClO Ácido hipocloroso HClO2 Ácido cloroso H3BO3 Ácido bórico HNO3 Ácido nítrico HClO3 Ácido clórico HClO4 Ácido perclórico NO LOGRE ENCONTRAR LA NOMENCLATURA ANTIGUA. SALES BINARIAS Las sales binarias las cuales también son conocidas por Sales en URO o Sales Haloideas son aquellos compuestos que dan como resultado de la reacción de un ácido binario y una base. Ej. HCl + NaOH NaCl + H2O Nomenclatura: La nomenclatura de las sales binarias se forma agregándole el sufijo URO mas la raíz del nombre del elemento electronegativo y siguiéndole se anota el nombre del elemento positivo seguido si es necesario la valencia con numero romano. 6 Ej. NaCl Cloruro de sodio KCl Cloruro de potasio CaCl2 Cloruro de Calcio II NO LOGRE ENCONTRAR LA NOMENCLATURA ANTIGUA. SALES OXIGENADAS Este tipo de sales tiene el nombre mas conocido de Oxisales las cuales se forman con el resultado de la solución parcial o total de los hidrógenos de los oxácidos. Ej. Na + S + H + O NaHSO4 Nomenclatura: El nombre de las oxisales se formas con la terminación ITO y ATO en lugar de las terminaciones OSO e ICO de los oxácidos correspondientes, que indican respectivamente con menos oxigenos y con mas oxigenos. Ej. NaHSO3 Bisulfito de sodio Na2SO3 Sulfito de sodio NaHSO4 Bisulfato de sodio Na2SO4 Sulfato de sodio. 7