L7-Quim-2º
Anuncio

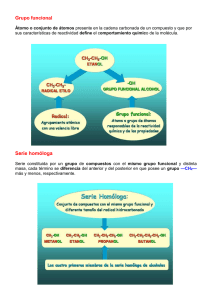
Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V Guía de Actividades Química N° 3 Hidrocarburos Alifáticos SEGUNDO AÑO MEDIO Nombre alumna Curso Profesora Establecimiento Fecha de recepción 2° año A – C – F 2° B – D - E M Cristina Díaz y Loreto Valenzuela Liceo N° 7 de Providencia 27/10 [email protected] con copia a [email protected] lore [email protected] con copia a [email protected] Unidad 2: Química Orgánica Tema: Hidrocarburos Alifáticos Objetivos: Reconocer la presencia de compuestos orgánicos en el contexto cotidiano Aplicar el concepto de hidrocarburo a la identificación de compuestos Diferenciar entre alcanos, alquenos, alquinos Instrucciones generales: “LEER” -La siguiente guía consta de 3 partes 1. Claves de Autoevaluación 2. Apoyo informativo: segmento que corresponde a información bibliográfica que te servirá para responder las actividades propuestas, por si no cuentas con tu texto de 4° Medio. 3. Actividades propuestas: segmento que te propone diversas actividades, las que deberás resolver según las indicaciones señaladas en cada una de ellas. 4. Evaluación: en esta parte deberás realizar las acciones señaladas, que luego deberás enviar a tu profesora según instrucciones dadas en instructivo general, como también en la guía anterior. - Desarrollo de la guía: En forma individual - Tiempo: 4 horas cronológicas - Lugar: Casa Recursos a utilizar para el trabajo Texto Química 2° Medio Informativo incluido en la misma guía Interactivo PRIMERA PARTE CLAVES DE AUTOEVALUACIÓN Resuelve las actividades y envía tus respuestas según instrucciones 1.- Enumera 4 características del C que hayas aprendido del texto a) Es tetravalente b) Forma enlaces covalentes c) Tiene la capacidad de formar largas cadenas carbonadas y anillos o ciclos de C d) Forma una cantidad muy grande de compuestos 2.- Completa el siguiente cuadro, con respecto al átomo de carbono ÁTOMO DE CARBONO Configuración electrónica Electrones desapareados Electrones de valencia N° de enlaces covalentes ESTADO FUNDAMENTAL 1s2,2s22px1 2py1 2pz0 2 2 2 ESTADO HIBRIDADO 1s2,2s12px1 2py1 2pz1 4 4 4 Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V 3.-CUADRO RESUMEN Tipo de hibridación sp3 Orbitales Geometría 4 orbitales hibridados Tetraédrica (sigma) Ángulos 109,5° Enlace 4 enlaces simples sp2 2 orbitales hibridados sigma y 1 enlace pi Trigonal plana 120° 2 enlaces simples y 1 enlace doble sp 1 orbital hibridado sigma y 2 enlaces pi lineal 180° 1enlace simple y 1enlace triple 4.- ¿Cuál de las afirmaciones es verdadera? a) la geometría molecular de la hibridación sp2 es tetraédrica b) la hibridación sp forma ángulos de 120° c) de la hibridación sp es lineal d) la hibridación sp3forma ángulos de 180°) la geometría molecular 5.- La hibridación corresponde a: a) la transformación mediante el cual el átomo de C, presenta una nueva configuración electrónica por la excitación producida en los niveles de energía b) la transformación en que el átomo de C entrega sus electrones a otro átomo de C c) la transformación mediante el cual el átomo de C, presenta igual configuración electrónica a pesar de ceder sus electrones d) la transformación en que el átomo de C, pierde energía por la pérdida de electrones 6.- El átomo de C tiene la capacidad de formar enlace(s): a) dobles, iónicos y simples b) dobles, simples y covalentes c) simples, dobles y triples d) simples, covalentes y iónicos 7.- Los compuestos orgánicos que presentan enlaces covalentes simples se denominan: a) insaturados b) sobresaturados c) transaturados d) saturados ¡No olvides que una vez que hayas revisado tu evaluación mandar tu puntaje obtenido¡ SEGUNDA PARTE APOYO INFORMATIVO. HIDROCARBUROS. Los hidrocarburos están constituidos fundamentalmente por átomos de carbono e hidrógeno, son los compuestos orgánicos más básicos y la fuente principal de ellos es el petróleo. El petróleo, la hulla y el gas natural son las principales fuentes de energía y se conocen como combustibles fósiles. Todos estos se han formado a lo largo de millones de años por descomposición de plantas y animales. El gas natural consiste en una mezcla de hidrocarburos de bajo peso molecular, fundamentalmente metano, con pequeñas cantidades de otros gases como etano, propano y butano, El petróleo es un líquido oscuro y viscoso formado por cientos de productos, que se encuentra en los intersticios de las rocas porosas formando grandes bolsas entre capas de rocas impermeables. El petróleo es una mezcla de hidrocarburos líquidos en los que están disueltos otros hidrocarburos sólidos y gaseosos; el petróleo crudo debe ser sometido a una separación de la mezcla que lo forma mediante un proceso de destilación que se realiza en las refinerías, dando origen a una serie de fracciones (gasolina, keroseno, aceites y otros) La hulla es sólida, contiene hidrocarburos de alta masa molar y contiene además azufre, oxígeno y nitrógeno, la hulla constituye el 90% de las reservas de combustibles fósiles. Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V CLASIFICACIÓN DE LOS HIDROCARBUROS: Los hidrocarburos se subdividen en: Alicíclicos Hidrocarburos a) alcanos b) alquenos c) alquinos Cíclicos Aromáticos Los hidrocarburos alicíclicos son todos aquellos de cadena abierta que pueden presentar enlaces simples, dobles o triples entre los átomos de carbono. a) NOMENCLATURA DE LOS ALCANOS Fórmula General: CnH2n +2 Son aquellos compuestos que solo presentan enlaces simples entre carbono – carbono. También éste tipo de compuestos se denominan hidrocarburos saturados. El alcano más simple es el formado por solo un átomo de C y rodeado de 4 átomos de hidrógeno, ya que debemos recordar que el C es tetravalente Ejemplo: Fórmula estructural Fórmula molecular H Metano H − C − H CH4 H Alcanos lineales. o Se nombran mediante un prefijo que indica el número de átomos de carbono de la cadena y el sufijo -ano. Nº de C Prefijo Nº de C Prefijo Nº de C Prefijo 1 met 6 hex 11 undec 2 et 7 hept 12 dodec 3 prop 8 oct 13 tridec 4 but 9 non 14 tetradec 5 pent 10 dec 15 pentadec Ejemplos: 1.- CH3 –CH2 - CH2 – CH3 = cadena de 4 C , en la tabla el prefijo es but + terminación ano = butano 2,- Una cadena de un alcano lineal formada por 8 C se llamará = oct + terminación ano = octano 3,- Otra forma de representar la estructura es dibujar con líneas las formas geométrica del esqueleto carbonado correspondiente, así cada uno de los vértices nos indicará la presencia de un átomo de C unido a los átomos de hidrógeno correspondiente, en el caso expuesto el dibujo posee 6 vértices por lo tanto es un hexano. b) NOMENCLATURA DE LOS ALQUENOS Fórmula General: CnH2n Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V Se busca la cadena más larga que contenga el doble enlace y tomando como base ese número de carbonos se nombra utilizando el sufijo -eno. Se numera la cadena principal de forma que se asigne el número más bajo posible al doble enlace. La posición del doble enlace se indica mediante el localizador del primero de los átomos que intervienen en el doble enlace. Si hay más de un doble enlace se indica la posición de cada uno de ellos y se emplean los sufijos -dieno, -trieno, -tetraeno, etc. Ejemplos: 1 2 3 4 5 1,- CH2 = CH – CH2 – CH2 – CH3 = La cadena es de 5 C , tiene un doble enlace en el C 1 , por lo tanto se llamará = n penteno o penteno normal 1 2 3 4 5 6 2,- CH3 – CH = CH – CH2 - CH2 – CH3 6 5 4 3 2 1 Debo ubicar donde se encuentra el doble enlace, de izquierda a derecha en el C dos y de derecha a izquierda en el C cuatro, por lo tanto este compuesto se llama 2 penteno. c) NOMENCLATURA DE LOS ALQUINOS Fórmula General: CnH2n-2 Se busca la cadena más larga que contenga el triple enlace y tomando como base ese número de carbonos se nombra utilizando el sufijo -ino. Se numera la cadena principal de forma que se asigne el número más bajo posible al triple enlace. La posición del triple enlace se indica mediante el localizador del primero de los átomos que intervienen en el triple enlace. Si hay más de un triple enlace se indica la posición de cada uno de ellos y se emplean los sufijos -dieno, -trieno, -tetraeno, etc. Si en una molécula existen dobles y triples enlaces se les asigna los localizadores más bajos posibles. Al nombrarlos se indican primero los dobles enlaces y después los triples. Si un doble y triple enlace están en posiciones equivalentes se empieza a numerar por el extremo que da el localizador más bajo al doble enlace. Bibliografía; Texto Química 2° Medio Ministerio de Educación Yo estudio (Ministerio de Educación) AHORA QUE YA LEÍSTE LA GUÍA, TOMA TU TEXTO DE QUÍMICA Y REALIZA EN TU CUADERNO LOS EJERCICIOS PROPUESTOS EN ÉL, VERÁS QUE PUEDES TODOS LOS DÍAS APRENDER UN POQUITO MÁS ¡SUERTE! Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V TERCERA PARTE ACTIVIDADES DE EVALUACIÓN I.- Selección Única 1,- ¿Qué concepto explica el hecho que el metano tenga todos sus enlaces iguales siendo que sus electrones provienen de orbitales distintos? C = 1s2 2s2 2p2 a) hibridación b) tetravalencia c) fisión atómica d) enlace covalente e) electronegatividad 2,- Los ángulos de enlace del etano, etino y eteno son respectivamente: a) 109,5º - 120º - 180º b) 90º - 120º - 180º c) 120º - 180º - 109,5º d) todos son de 109,5º e) 109,5º - 180º - 120º 3,- ¿Cuál es el nombre de la siguiente molécula? a) isopenteno b) 2-etilpropano c) pentano d) tercepentano e) 2-metilbutano 4,- ¿Cuál es el nombre de la siguiente molécula? a) b) c) d) CH3 – CH2 – CH2 – CH = CH – CH3 n hexano 4 hexeno 3 hexeno n hexano 5.I.II.III.- Los alcanos son hidrocarburos que: presentan solo enlaces dobles entre carbono-carbono presentan solo enlaces simples entre carbono-carbono son saturados por tener la cantidad máxima de átomos de hidrogeno enlazados con carbono. a.- solo I III. b.- solo II c.- solo III 6.- La hibridación sp 2 resulta de la combinación: a) del orbital 2s con tres orbítales 2p b) del orbital 2s con un orbital 2p c) del orbital 1s con un orbital 2p d) del orbital 2s con dos orbítales 2p 7.- La fórmula general de los hidrocarburos llamados alcanos es: a) C n H 2n b) C n Hn c) C n H2n + 2 d.- II y III e.- I y Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V d) C n H 2n – 2 8,- El hidrocarburo hexano normal, posee como fórmula estructural abreviada, la siguiente: a.) CH3 - C H2 - C H2 - C H2 - C H3 b) C H 3 - C H2 - C H2 - C H3 c) C H3 - C H3 - C H3 - C H3 - C H3 - C H 3 d) C H3 - C H2 - C H2 - C H2 - C H2 - C H3 9.- El nombre más correcto del compuesto dado a continuación C H2 = C H2 – C H2 = CH2 nomenclatura IUPAC es: a) 1,3 pentano b) 1,3 butano c) 1,3 buteno d) 1,3 butadieno según, la 10.- La fórmula C H2 = CH – CH2 – C H2 – C H2 – CH2 –C H 3 de este compuesto orgánico , se denomina: a) 1 heptano b) 1 hepteno c) 6 heptano d) 6 hepteno II,- Resuelva a) Escriba la fórmula estructural de: a) eteno b) buteno c) 3 buteno d) 1,3 pentadieno e) 4 octino f) 2,4 heptadieno g) octano h) nonano b) Escriba la fórmula molecular de: a) pentino b) butano c) deceno d) propino e) 4 octeno f) 3 eteno g) 2 pentino h) 3- noneno Liceo 7 de Niñas. Departamento de Química Guía de Aprendizaje Nº 03. 2º Medio. M.C.D-L.V HOJA DE RESPUESTA N° 3 Nombre alumna Curso Profesora Establecimiento Fecha de recepción 2° año A – C – F 2° B – D - E I. Selección Única 1 2 3 M.Cristina Diáz – Loreto Valenzuela Liceo N° 7 de Providencia 27/ [email protected] con copia a [email protected] lore [email protected] con copia a [email protected] 4 5 6 7 8 9 10 II. a) Escriba la fórmula estructural de: a) b) c) d) e) f) g) h) b). Escriba la fórmula molecular de: a) b) c) d) e) f) g) h) NO OLVIDES REALIZAR LA IDENTIFICACION COMO CORRESPONDE, TANTO AL GUARDAR EL DOCUMENTO COMO AL ENVIARLO POR CORREO. ¡HASTA LA PRÓXIMA!