rvr resumen qumica 2012
Anuncio

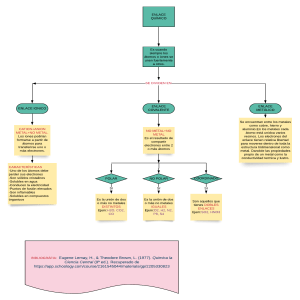
Resumen Química 2012 Enlace Químico: Es el enlace que se forma entre dos o más átomos. Es divisible en tres categorías: Enlace Iónico: Se forma entre dos átomos de electronegatividades muy diferentes, que son un metal y un no metal. El metal dona el electrón, y el no metal lo recibe, habiendo una transferencia de electrones. La diferencia de E.N. varía entre 1,7 y 3,3. Para equilibrar los átomos, se tiene que llegar a una cantidad de electrones de valencia de 8 (ley del octeto), o en algunos casos de 2 (ley del dueto). Son usualmente solidos cristalinos muy frágiles. Tienen altos puntos de fusión y de ebullición. Conducen la electricidad cuando están fundidas y cuando están disueltas. Solo se disuelven en compuestos polares, como el agua. Enlace Covalente: Se forma cuando se unen dos no metales (electronegatividades cercanas) por medio de un enlace. Hay dos tipos de enlace covalente. Están en los tres estados, y varían según el grupo en el que estén. No tienen estructura definida. o Covalente Apolar: Se forma entre dos no metales iguales, con una diferencia de electronegatividades de 0. o Covalente Polar: Se forma entre dos no metales diferentes, con una electronegatividad que varía desde 0 a 1,7. Covalente Dativo o Coordinado: Se forma cuando en un enlace entre dos no metales, uno de los dos átomos dona el par electrónico completo. Enlace Metálico: Es el enlace que se forma entre dos átomos metálicos. Su principal característica es que es un mar de electrones deslocalizados, con algunos átomos positivos entremedio. Son solo metales únicos, como una lamina de cobre. Notación de Lewis: La notación de Lewis se usa para átomos, moléculas e iones. Es una manera grafica de representar el átomo y los electrones de valencia. Hay algunos pasos que hay que seguir para dibujar la estructura de Lewis: 1. Se suman los electrones de valencia, para la molécula. Si es un anión (-), se le suma un electrón por cada carga negativa, y por cada catión (-), se le resta un electrón por cada carga positiva. 2. Se calculan los electrones del octeto (o del dueto). 3. Se calculan los electrones que forman el enlace. (Paso 2-Paso 1) 4. Se calculan la cantidad de enlaces. (Paso 3/2) 5. Se calculan los electrones sin compartir. (Paso 1-Paso3)