Tarjetas 903 para la recogida de muestras de sangre Noviembre 2006
Anuncio

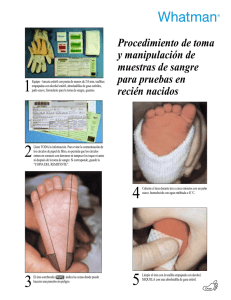
Tarjetas 903 para la recogida de muestras de sangre Noviembre 2006 Tarjetas 903 para la recogida de sangre de recien nacidos Aspectos de Calidad y Reglamentación Noviembre 2006 Reglamentación resumida y concentrada • IndicacionesEl destino que se ha de dar al dispositivo tiene que ser el que ha sido definido por el fabricante. Cualquier otro uso no es válido. Si se requiese un cambio de las indicaciones, ello estaría sujeto al correspondiente proceso de Control y Validación del Diseño • Uso pretendido Lo que el dispositivo hará para el paciente/usuario. Cualquier pretensión tiene que sustanciarse en base a una evidencia ¿A qué se refiere el termino “IVD”? IVD = dispositivo médico para el diagnostico In vitro In vitro quiere decir fuera del cuerpo vivo IVD se puede referir a : • Reactivos y productos reactivos para la determinación del grupo sanguíneo • Reactivos y productos reactivos para la confirmación de marcadores de infección por VIH • Reactivos y productos reactivos para la detección de infecciones congenitas como p.ej. la Rubeola • Y productos mucho mas sencillos como p.ej. el 903 ¿Por qué el 903 es un IVD? . 903 es un receptaculo para muestras en términos de la directiva IVD Union Europea Los dispositivos medicos para el diagnostico in-vitro se consideran receptaculos para muestras. Que son aquellos dispositivos, de tipo vacío o no, cuyo uso pretendido especificamente por el fabricante es el de contenedor primario para la preservación de muestras derivadas del cuerpo humano con el proposito de un exámen de diagnostico in-vitro” “ . 903 como IVD • USO PRETENDIDO Las tarjetas 903 ® para la recogida de sangre de recien nacidos (903® Cards) estan destinadas a ser utilizadas por profesionales de la Salud para la recogida y conservación in-vitro de sangre neonatal humana 903 como IVD CARACTERISTICAS DEL DISPOSITIVO: • Las tarjetas 903® estan especialmente diseñadas para la recogida y el almacenamiento in-vitro de sangre neonatal para los programas de cribado neonatal. El dispositivo consiste en una pequeña “tarjeta” portadora que presenta un recorte de papel de linteres de algodón adherido a un formulario para recoger la información demográfica del recién nacido. • Para utilizar el dispositivo, se aplica sobre el area de recogida de muestra un pequeño volumen de sangre capilar obtenida a partir de la punción en el talón del recién nacido y se permite su secado a temperatura ambiente durante almenos 3 horas. Despés la tarjeta se empaqueta para su envío al laboratorio de analisis. El envío al laboratorio de analisis deberá realizarse dentro de las 24 horas de la toma de muestra. 903 como IVD ¿En qué consiste un dispositivo 903? 1) Una tarjeta portadora que contiene el papel 903 para la deposición de las manchas de sangre, adherido a un ... 2) Formulario para recoger la información demográfica del recién nacido 3) Instrucciones de Uso El papel 903 junto con el Formulario de Información Demografica constituyen el dispositivo médico Las Instrucciones de Uso proporcionan a los usuarios la información necesaria para utilizar el dispositivo de una forma segura y efectiva ¿Qué regulaciones son aplicables para nuestro dispositivo? • Dispositivo médico – EUROPA: marcado CE como dispositivo medico para Diagnostico In Vitro – USA: Class II Medical Device – Resto del Mundo: dependiendo del mercado El proposito de la Regulación de los Dispositivos medicos es • La Regulación de dispositivos medico DEMANDA que el producto sea SEGURO y que el producto FUNCIONE COMO ES REQUERIDO • Se requiere que la seguridad y eficacia está comprovada, frecuentemente utilizando referencias a estandares en provado cumplimiento. • Eliminar barreras comerciales También • Se requiere un Sistemas de Calidad que ayuda a asegurar que el producto se ajusta a su propósito de forma documentada y consistente. • Se tienen que proporcionar Procedimientos de Vigilancia que proporcionen un entendimiento compartido y que limiten los problemas. • Se requiere la Gestión de Riesgos, para mejorar el producto. Implantación de las Regulaciones Las Regulaciones son requerimientos legales Las autoridades comunitarias de la EU tienen amplios poderes para manejar las transgresiones de las regulaciones y pueden • Forzar a una empresa a interrumpir la venta y comercialización de un producto • Forzar a una empresa de retirar un producto del mercado • Forzar a una empresa a informar a sus clientes de la existencia de un problema • Sanciones y Reclusión Proceso de Regulación Control de Diseño Cambios significativos Analisis de Riesgos Vigilancia Seguimiento Post Venta Declaración de Conformidad Reclamaciones CAPA Accesorios Sistema de Calidad Control de Documentación etc… DISPOSITIVO Funcionamiento o Evaluación Clínica Marcado CE Dosier Tecnico -Requerimientos Esenciales -Analisis de Riesgos –Ficha Tecnica (A + B) –Etiquetado/IFU –Protocolos de evaluación Registro frente la Autoridad Competente Definición de ‘El Fabricante’ Unión Europea ‘El fabricante’ quiere decir la persona fisica o legal, responsable del diseño, de la fabricación, del empaquetado y etiquetado de un dispositivo antes de ‘ lanzarlo al mercado bajo su propio nombre, independientemente si estas operaciones son realizadas por esta misma persona o por un tercero en su nombre. WHATMAN es el ‘fabricante’ de las Tarjetas 903 neonatales TODAS las responsabilidades regulatorias para el 903 recaen en Whatman Whatman es el responsable de asegurar que el producto cumple con los requerimientos regulatorios y que es seguro y eficaz al mismo tiempo 903 Diagrama de Flujo 903 Diagrama de Flujo Aprobación de un nuevo Diseño Proceso de Fabricación del papel 903 • La fabricación del papel es supervisada en el molino de papel a pie de maquina • Se hace un primer ensayo en los laboratorios de Whatman en Sanford, Maine-USA • Ensayo en un Laboratorio externo en un Hospital local en Sanford, Maine-USA • Ensayo en un Laboratorio Externo en el CDC, Centro de Control de Enfermedades Infecciosas, de AtlantaUSA Solamente después se libera el Lote de papel para el mercado Requerimientos para Tarjetas impresas • Tarjetas impresas – Requerrimientos del cliente / del País – Los Requerrimientos mínimos de Whatman – Caducidad 2 Años (Inicio: en el momento de la impresión de las tarjetas) Requerrimientos Whatman - EU EU Información Demográfica Mínima EU Información demográfica Opcional Nombre del recién nacido Nombre de la madre Sexo Fecha de nacimiento Fecha de la recogida de la muestra Peso al nacer Tutor o Representante Legal y Dirección Información adicional (e.g. medicación, alimentación etc…) Nombre del programa Fuente : Whatman 1 Aug 2006 Fuente : Whatman 1 Aug 2006 Requerimientos Whatman - EU Información Símbolos e Iconos Requerimientos minimos Marca CE Minimo Testo asociado con los Símbolos ó mínimo texto requerido Ninguno Altura mínima 5 mm Fabricante Nombre del producto Whatman GmbH Hahnestraße 3 37586 Dassel Germany Ninguno Whatman 903® Número de referencia Numero de catalogo del producto relevante (texto fijo) Número de lote Número del lote de fabricación relevante (texto variable) Caducidad Fecha de Caducidad relevante año-mes (texto variable) Dispositivo medico para diagnostico in vitro Ninguno Requerimientos Whatman - EU Consultar las instrucciones antes de usar Ninguno Un sólo uso Ninguno Riesgo biologico Ninguno Númeración secuencial Número secuencial único y no repetible Opcional relativo a la numeración secuencial Ninguno Código de barra con número secuencial único y no repetible (el código de barra debería contener un dígito contro) Avisos Ninguno 1)NO tocar el area de muestra 2)NO usar si está dañada Código de diseño Ninguno Código de diseño de Whatman único (texto fijo) Fuente : CFR 809.10, NCCLS LA4-A4, Risk Analysis, EU Directive 98/79/EC Trámites para que la imprenta pueda liberar y entregar una tarjeta impresa • La imprenta emite una declaración / certificado + muestras de las tarjetas impresas • El departamento de Control de Calidad recopila todos los resultados de los ensayos que se realizan en los laboratorios de Whatman, Sanford, Maine-USA • Se comprueba si el 903 impreso sigue cumpliendo con las especificaciones internas para el papel 903 (la impresión no debe modificar las especificaciones) • Si todo resulta positivo entonces se produce la liberación y asignación del numero de lote para su comercialización Liberación definitiva de las tarjetas impresas • Se encarga el Departamento de Calidad: • de Whatman Dassel, Alemania para los mercados de: – Europa Norte y Sur, Oriente Medio, Africa y America del Sur • de Whatman Sanford, Maine-USA para los mercados de : – USA, Canadá, Ásia, Pacifico Vigilancia & Seguimiento Post Venta Los requisitos: El fabricante debe: • mantener un procedimiento sistematico para revisar la experiencia adquerida en la fase de post producción, • Implementar cualquier acción correctora • notificar al Cuerpo Regulatorio de cualquier ‘incidente’ serio (¿Para qué?) • para mejorar la protección de la salud y seguridad reduciendo la probabilidad de la repetición de incidentes adversos ‘incidentes’ Plazos de tiempo para reportar Incidente ( Muerte o Daños serios ) Europa Report antes de 10 días Incidentes potenciales Europa Report antes de 30 días