CALOR Y TEMPERATURA
Anuncio

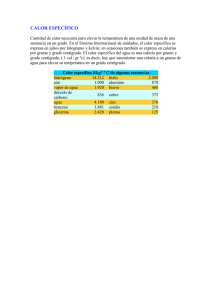
CALOR Y TEMPERATURA • El calor es una de las formas de energía con la que estamos más familiarizados, ya que la encontramos constamente en las más diversas actividades de nuestra labor cotidiana. • En la Química, su importancia es considerable ,por ser el calor la forma energética que se representa asociada a los cambios químicos y que se aprovecha para hacer las mediciones de energía. • El concepto de calor inmediatamente produce en nosotros una asociación con el de temperatura, pero éstos dos términos tienen significados diferentes. • El calor: La energía que se transmite de un cuerpo a otro más frio: está transmisión se realiza hasta que los dos cuerpos estén a la misma temperatura. • La temperatura: Es el concepto de que nos valemos para expresar la intensidad del calor. La podemos entender com la propiedad que determina el flujo de calor: Este siempre fluye en el sentido de mayor a menor temperatura. • Los siguientes ejemplos nos permiten aclarar aún más la diferencia que existe entre éstos dos conceptos: • a. Consideramos la llama de un fósforo o cerilla y la de una hoguera ambas llamas pueden tener la misma temperatura, pero el calor que se desprende de la hoguera es notablemente mayor que el que suministra el fósforo. • b. Se tiene un vaso y un balde, ambos con agua a la misma temperatura, y se desea calentarlos hasta que el agua alcance su punto de ebullición. A cuál de los dos habrá que agregarle más calor?. La experiencia nos indica que aunque las temperaturas • inicial y final son las mismas para ambos recipientes, es necesario suministrar más calor al balde, dado que contiene una mayor cantidad de agua. • ¿Cómo se expresa el calor? • La unidad que se utiliza comúnmente para medir el calor es la caloría, (Cal )que se define como la cantidad de calor requerida para elevar la temperatura de 1g de agua en 1 grado centígrado. • La caloría es una unidad pequeña, por lo cual es frecuente el uso de su múltiplo, la kilocaloría, Kcal, también conocida como caloría grande o C que equivale a 1.000 calorías .- La caloría que se emplea en el campo de la nutrición para expresar el potencial energético de los elementos es la kilocaloría. • De esta manera, cuando se dice que 1 g de grasa suministra 9 calorías, debe entenderse que son 9 kilocalorías osea 9000 calorías. • En toda la literatura química científica se empleaba la caloría para expresar la cantidad de calor o de cualquier otro tipo de energía. La adopción del sistema internacional de unidades, sin embargo, hizo que se reconociera el julio J como unidad patrón de energía. • El julio tiene su origen en estudios de energía cinética y no en la energía térmica, pero se relaciona íntimamente con la caloría .- puesto que la energía cinética puede transformarse en calor. El julio se define como la energía cinética que posee un cuerpo de 2 kg de masa que se mueve a una velocidad de 1 m/s esto es: • • • • • • • • • • • • Ec=1/2m.v2 1J=1/2(2kg)(1m/s)2 1J=1Kg.m2/s2 1 caloría equivale a 4.184 julios 1 cal=4.184 J Ej. Calcula la energía cinética de un atleta que corre a una velocidad de 25 km/hora, si su peso es de 70 kg¿A cuántas calorías equivale esta energía? Sln: Ec=1/2(70Kg)( 25KM/HORA)(1000/1KM)(1 HORA/3.600s)2= 1.687kg.m2/s2 Ec=1.687j 1.687J(1Cal/4.184J)=403.2 cal Rta la energía cinética es 1.687 Julios o 403,2 calorías. ¿CÓMO SE MIDE LA TEMPERATURA? • Para medir la temperatura de un cuerpo se emplea el termómetro que es un dispositivo que , al ponerse en contacto con el cuerpo recoge el calor desprendido por éste. Dicho calor produce un cambio en algunas de las partes del termómetro, cambio que se puede observar y medir. Por ejemplo en el termómetro de mercurio Hg, el cambio producido es la dilatación de dicho metal dentro de un tubo capilar; mientras mayor sea la temperatura mayor será la dilatación producida. • Si la ,temperatura disminuye, el mercurio se contrae y la columna de mercurio desciende. La escala Celsius ºC • La escala más común es la Celsius, denominada escala centígrada. En esta escala, los valores de referencia son 0 y 100 para las temperaturas de congelación y de ebullición del agua. De esta manera, un grado Celsius o centígrada ºC, es la centésima parte de la diferencia de temperatura que existe entre los puntos de congelación y de ebullición del agua • ºC=ºK-273 • °C=5/9(°F-32) La escala Kelvin • Existen razones teóricas que conducen a pensar que 273.15ªC es la mínima temperatura que puede llegar alcanzarse. Esta temperatura -273.15ªc se denomina cero absoluto y se utiliza para establecer otra escala de temperatura conocida como escala Kelvin. • La escala kelvin es la aceptada en el S.I y se emplea en el trabajo científico. • En esta escala la temperatura se expresa en kelvin, los cuales se simbolizan por la letra K. El tamaño de un kelvin es igual al de un grado centígrado, de tal manera que el punto de congelación del agua es 2734.15k y de ebullición es 373.15 k. • ºk=ºc+273.15 • ºK=ºc+273 La escala Fahrenheit ºF • El agua se congela a 32ºF y ebulle a 212ºF. De este modo la diferencia entre estos dos puntos de referencia es de (212-32), está dividida en 180ºF lo que quiere decir que el tamaño de un grado Fahrenheit es 1,8 veces menor que el de un grado • centígrado o un kelvin. • °F= 9/5°C+32 • La escala Rankine • Se denomina Rankine (símbolo R) a la escala de temperatura que se define midiendo en grados Fahrenheit sobre el cero absoluto, por lo que carece de valores negativos. Esta escala fue propuesta por el físico e ingeniero escocés William Rankine en 1859. • El grado Rankine tiene su punto de cero absoluto a −459,67 °F, y los intervalos de grado son idénticos al intervalo de grado Fahrenheit.