Éteres y epóxidos
Anuncio

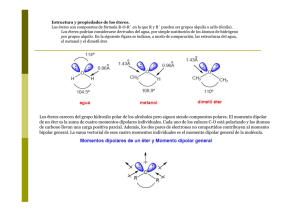
Centro Cultural Chino−Panameño Instituto Sun Yat Sen "Propiedades de la Funciones Orgánicas ÉTERES & EPÖXIDOS Integrantes: Grado: XII − D Profesora: Asignatura: Química Fecha de entrega: Panamá, 23 de Septiembre de 2003 INTRODUCCIÓN Un grupo funcional en química orgánica es el átomo o grupo de átomos unidos de manera característica y que determinan, preferentemente, las propiedades del compuesto en el que están presentes. Los compuestos orgánicos que poseen un mismo grupo funcional y que difieren sólo en un número entero de grupos metileno, −CH2−, se clasifican como miembros de una misma serie homóloga y se pueden representar por una fórmula molecular general. La progresiva introducción de grupos metileno en los miembros de una serie homóloga produce una suave variación de las propiedades determinadas por el grupo funcional. Lo cual en este trabajo veremos lo que es un éteres y epóxido. Sus grupo funcionales, método de obtención, propiedades física como química, su nomenclatura, usos y aplicaciones en la vida cotidiana. ÉTERES Los compuestos en los cuales dos grupos hidrocarburo [alquilo (R) y arilo (Ar), igual o diferente] están unidos a un átomo de oxígeno se llaman éteres. Las formulas generales de los éteres son: ROR ROAr ArOAr El grupo funcional es el átomo de oxígeno (−O−). Los éteres pueden considerarse compuestos en los cuales un grupo alquilo (R) o un grupo arilo (Ar) reemplazaron a los dos átomos de hidrogeno del agua (H−O−H). El éter más compón es el éter dietílico, o simplemente éter (CH3−CH2−O−CH2−CH3) : FH || F C C Br 1 || F Cl Método De Obtención: Los éteres se pueden obtener: 1− A partir de un haluro: reacción llamada síntesis de Williamson; es la reacción entre un haluro de alquilo y un alcóxido: RX + NaOR ROR + NaX Haluro Alcóxido Éter 2− Por deshidratación de alcoholes: se utiliza como catalizador H2SO4 diluido y las condiciones de la reacción deben ser adecuadas: 2ROH H2SO4 ROR + H2O −−−−−−−−− Calor Para obtener éter etílico se calienta a 140° C. Propiedades Físicas: Los éteres son compuestos con una polaridad muy débil, son solubles en compuestos orgánicos poco polares, su solubilidad en agua disminuye al aumentar el peso molecular debido a la formación de puentes de hidrogeno entre H2O y el éter. Son menos densos que el agua. Propiedades Química: Los éteres son bastantes inertes y muy estables frente a bases, agentes reductores y oxidantes. Los éteres son solubles en H2SO4 concentrado ya que se protonan formando una especie iónica soluble en H2SO4: H+ | ROR + H2SO4 R ORHSO4 La degradación por ácidos concentrados (HI ó HBr) a temperaturas elevadas es una reducción de los éteres: ROR + HX RX + R OH El alcohol puede seguir reaccionando y formar otra mol de haluro de alquilo. Nomenclatura: 2 Según la IUPAC se pueden nombrar como alcoxiderivados, utilizando el sufijo oxi unido al nombre de uno de los radicales; el otro radical se considera como grupo sustituyente. CH3 O CH3 Metoximetano Fenoxibenceno H3C CHCH2CH3 2−Metoxibutano | OCH3 También se nombran indicando los grupos unidos al oxígeno seguidos por la palabra éter: H3COCH2CH3 Metil−etil−éter Difenil−éter Isopropil−fenil−éter Uso & Aplicaciones: El éter es uno de los disolventes orgánicos más importantes y se usa con frecuencia en el laboratorio como disolvente de grasas, aceites, resinas y alcaloides, entre otros compuestos. La mezcla de vapor de éter y aire es muy explosiva; además, con el tiempo el éter puede oxidarse parcialmente formando un peróxido explosivo. Por lo tanto, el éter debe almacenarse y manejarse con mucho cuidado. Se usa principalmente como disolvente, como materia prima para fabricar productos químicos y como anestésico EPÓXIDOS Son éteres cíclicos que contienen un anillo de tres átomos. Este anillo posee ángulos de enlace de 60° y debido a su gran tensión, los epóxidos tienen una elevada reactividad. 3 El epóxido más importante es el Óxido de etileno. Método de Preparación: • Los epóxidos se obtienen: por oxidación catalítica del etileno: CH2 = CH2 Etileno 250° Oxido de etileno • A partir de halohidrinas: las halohidrinas casi siempre se obtiene de alquenos por adición de agua y halógeno al doble enlace. La halohidrina presencia de un hidróxido genera un éter cíclico: |||| C = C + X2/H2O CC +HX Alquenos | | X OH Halohidrina 4 Halohidrina Epóxido • Por peroxidación de dobles enlaces carbono−carbono: se oxida el doble enlace directamente a epóxido por medio del ácido peroxibenzoico: Propiedades Físicas: Son compuestos polares con puntos de ebullición menores que los de los alcoholes y más altos que los éteres; son solubles en agua. Propiedades Químicas: Los epóxidos sufren con gran facilidad reacciones catalizadas por ácidos y pueden ser degradados por bases; los enlaces resultan más débiles que un éter ordinario y la molécula menos estable, por lo que generalmente se produce la apertura del anillo. 1− Reacción con ácidos. 5 Epóxido Glicol Los epóxidos se protonan por medio de ácidos y así ser atacados por reactivos nucleofílicos formando compuestos con dos grupos funcionales, en este caso un glicol. 2− Reacción con un alcohol: se forma una sustancia que es éter y alcohol a la vez. 3− Reacción con bases: el epóxido puede reaccionar con un reactivo básico y fuertemente nucleofílico como alcóxido, fenóxido, NH3. Epóxido 2−amino−etanol 2−fenoxietanol • Reacción con reactivos de Grignard: se utiliza para preparar alcoholes primarios con dos carbonos más que el grupo alquilo o arilo del reactivo de Grignard. 6 Epóxido Alcohol Primario Reactivo de Grignard Uso & Aplicaciones: Sustancia química que polimerizada se usa como plástico para estructuras, revestimientos y adhesivos. Según su campo de aplicación pueden ser clasificadas en tres grandes grupos: • Se utilizan para: abrasivos, materiales de fricción, textil, fundición, filtros, lacas y adhesivos. • Para madera y aislantes (RFMA) tienen su campo de aplicación en: lanas minerales, impregnaciones, materiales de madera, espumas. • Para polvos de moldeo (PM), que son suministradores de las industrias eléctrica, automovilística y electrodoméstica. CONCLUSIÓN • Los éteres son grupo de compuestos orgánicos que responden a la fórmula general R−O−R, en donde O es un átomo de oxígeno, y R y R representan los mismos o distintos radicales orgánicos. Véase Química orgánica. • La mayoría de los éteres son líquidos volátiles, ligeros e inflamables, solubles en alcoholes y otros disolventes orgánicos. Desde el punto de vista químico, son compuestos inertes y estables; los álcalis o los ácidos no los atacan fácilmente. Están estrechamente relacionados con los alcoholes, y se obtienen directamente de ellos. • Los epóxidos son éteres cíclicos que contienen un anillo de tres átomos. Este anillo posee ángulos de enlace de 60° y debido a su gran tensión, los epóxidos tienen una elevada reactividad. • Los epóxidos son sustancia química que polimerizada se usa como plástico para estructuras, revestimientos y adhesivos. Bibliografía • Enciclopedia Microsoft Encarta 2001 • Química 11: Química Orgánica Pág: 91,94 − Santillana Media • Química 7tima Edición. Autores: Daub & Seese − Pág.: 539−541 • http://www.sc.ehu.es/iawfemaf/archivos/materia/00017126.htm • http://132.248.56.130/organica/qo2/eteres/eter11.htm 7 • http://www.geocities.com/Colosseum/Slope/1616/Organica/eteres.htm • Investiguemos 11 edición ÍNDICE Introducción. 01 Éteres 02 Epóxidos... 06 Conclusión 11 Bibliografía 12 8