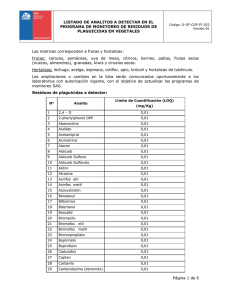
6. Consideraciones en la validación de los métodos analíticos para la determinación de Residuos en matrices biológicas de origen animal. Dr. Gonzalo Suárez.
Anuncio
30-Apr-15 Sistemas de Aseguramiento de calidad en laboratorios CONTENIDO Consideraciones en la validación de los métodos analíticos para la determinación de residuos en matrices biológias de origen animal ¿Que es un residuo de medicamento veterinario? Requisitos en validación en métodos analíticos para determinación residuos Caracteristicas paticulares de cada parámetro evaluado Consideraciones particulares para la evaluación de residuos Gonzalo Suárez, DMTV, PhD ÁREA FARMACOLOGIA, FACULTAD DE VETERINARIA Montevideo, 30 de abril de 2015 [email protected] Que entendemos por un residuos de medicamentos veterinario? ETIQUETA (MATRIZ BIOLÓGICA) ▪ “Toda sustancia farmacológicamente activa, ya sean ingredientes, excipientes o productos de degradación y sus metabolitos que permanecen en los productos alimenticios obtenidos de animales a los que se administró el medicamento veterinario en cuestión” Camevet 2013 Amplia relación con la TOXICIDAD POTENCIAL (ADI = NOEL / SF) Tiempo de espera Intervalo de tiempo desde la ultima administración del medicamento a la especie destino, en condiciones normales de uso, hasta que los tejidos destinados al consumo humano alcanzan niveles iguales o inferiores al LMR fijado. Validación de métodos Farmacocinética del medicamento MEDICAMENTO VETERINARIO Sustancia activa RESIDUO Límites máximos de residuo - LMR (gestión riesgo) Especie / Posología Criterios de validación “Demostrar que un método analítico cumple con lo requerimientos para un determinado propósito” Abril 2011 Revisión: Mayo 2013 GUÍA PARA LA VALIDACIÓN DE LOS MÉTODOS ANALÍTICOS PARA LA DETERMINACIÓN DE RESIDUOS EN MATRICES BIOLÓGICAS DE ORIGEN ANIMAL Habilidad para detectar, identificar y cuantificar un analito en una matriz en particular (inter-laboratorio / intra-laboratorio) Desarrolla el método Valida el método Implementa el método CAMEVET (Comité de las Américas de Medicamentos Veterinarios) REPRESENTACIÓN REGIONAL DE LA OIE PARA LAS AMÉRICAS. VICH no49; 2015 International Cooperation on Harmonisation of Technical Requirements for Registration of Veterinary Medicinal Products PROSAIA, 2013 1 30-Apr-15 Rango analítico Incluir el LMR Criterios de validación LINEALIDAD Linealidad – rango analítico Exactitud APLICAN Precisión reproducibilidad Estudios Farmacocinéticos, de eliminación de residuos o de bioequivalencia repetibilidad Sensibilidad límite de detección límite de cuantificación Especificidad Matrices biológicas Porcentaje de recuperación Estabilidad VICH no49; 2015 • DEMOSTRAR UNA RELACIÓN LINEAL DENTRO DEL RANGO DE CONCENTRACIONES ESPERADAS EN LA MATRIZ ESTUDIADA Matriz fortificada con el estándar y posteriormente procesada (extracción) 5 concentraciones diferentes (mínimo) (tres repeticiones) Demostrar linealidad LOQ a 120% de la concentración que se pretende analizar Evaluar la homocedasticidad (heterocedasticidad= evaluar ponderar) CRITERIO DE ACEPTACIÓN Determinación del coeficiente de correlación (r2). Distribución de los residuales Ordenada en el origen (Intersección eje Y) REPETIBILIDAD desvíos ≤ 15% (LOQ ≤ 20%) Guía para la validación de los métodos analíticos para la determinación de residuos en matrices biológicas de origen animal. PROSAIA, 2013 EXACTITUD y PRECISIÓN CRITERIO DE ACEPTACIÓN EXACTITUD / VERACIDAD Desviaciones aleatorias y sistemáticas Exactitud = [ experimental ] – [ teórica ] * 100 [ teórica ] • EXPRESA COMO % DE RECUPERACIÓN O % DE ERROR. preciso y exacto preciso pero inexacto o Se relaciona con el error sistemático (método analítico) y a recuperación del analítico (porcentaje de recuperación) impreciso pero exacto Requiere un mínimo de 5 reproducciones en tres concentraciones diferentes. Muy dependiente de las concentraciones del analito: impreciso e inexacto Concentración de analito Rango aceptable < 1 µg/kg -50% a +20% ≥ 1 µg/kg < 10 µg/kg -40% a +20% ≥ 10 µg/kg < 10 µg/kg -30% a +10% ≥ 100 µg/kg -20% a +10% Codex µg/kg = ng/g = ppb CRITERIO DE ACEPTACIÓN PRECISIÓN Coeficiente de Variación (CV) CV= Desvío estándar * 100 media • EXPRESA EN TÉRMINOS DE REPETIBILIDAD Y PRECISIÓN INTERMEDIA (reproducibilidad interna). Reproducibilidad interlaboratorio hace parte del sistema de calidad propio del laboratorio. Requiere un mínimo de 5 reproducciones en tres concentraciones diferentes. Dentro del rango de validación (incluyan LOQ) (baja, media y alta) Realizarse en tres días de análisis Concentración de analito Repetibilidad para cada punto ≤ 20% CV (15%) 35% ≥ 1 µg/kg < 10 µg/kg 30% ≥ 100 µg/kg Coeficiente de Variación (CV) CV= Desvío estándar * 100 media • EXISTEN VARIAS MANERAS VÁLIDAS DE DETERMINAR EL LOD y LOQ. IUPAC (International Unien of Pure and Applied Chemistry) Criterio utilizando 20 muestras blanco (6 fuentes distintas) Calcula la media y desvió estándar LOD = 3 veces el desvío estándar / LOQ = 6 veces el desvío estándar Aceptación de los criterios de exactitud (80-120%) y precisión (≤20%) en el LOQ (%CV). Relación Señal / Ruido Reproducibilidad interna CV% < 1 µg/kg ≥ 10 µg/kg < 10 µg/kg CRITERIO DE ACEPTACIÓN LÍMITE DE DETECCIÓN Y CUANTIFICACIÓN 20% 15% µg/kg = ng/g = ppb VICH Gráfico de concentración esperada vs. agregada (intervalo de confianza) Calculamos CCα (menor concentración a la cual un método puede discriminar, con una certeza estadística de 1-α que el analito esta presente) (probabilidad 1% - falso positivo) Calculamos CC (concentración mínima a la cual el método es capaz de detectar muestras realmente contaminadas con una certeza estadística de 1- ) (probabilidad 5%- falso negativo) No se detecta LOD Se detecta LOQ Se cuantifica 2 30-Apr-15 SELECTIVIDAD • SE EXPRESA EN RELACIÓN A LAS SUSTANCIAS ENDÓGENAS PRESENTES EN LA MATRIZ Requiere que la respuesta de las muestras control NO superen el 20% LOQ. Requiere determinar cuanto tiempo se puede mantener una muestra en condiciones de almacenamiento sin sufrir degradación excesiva antes del análisis Fortifica muestras control (blanco) con concentraciones conocidas Dos concentraciones cercanas a los extremos, por triplicado Mantiene las muestras en similares condiciones a las experimentales Análisis periódico en intervalos específicos Inicio Intermedio (semanas) Valido considerar Final (meses) utilizar muestras reales Estudios de congelamiento / descongelamiento 3 ciclos, considerando un ciclo por día como mínimo • SE EXPRESA EN RELACIÓN A LA VARIABILIDAD DEL CV% EN TODAS LAS CONCENTRACIONES (mínimo tres: baja, media y alta), MAS QUE UN MÍNIMO DE RECUPERACIÓN (70% ???) CRITERIO DE ACEPTACIÓN Rango de variación (CV) ≤ 20% en todas las concentraciones MUETRA PROCESADA Rango de variación ≤ 15% • CONSIDERAR QUE LAS MUESTRAS SUFREN PROCESOS DE CONGELADO, ALMACENAMIENTO Y DESCONGELADO PORCENTAJE DE RECUPERACIÓN ESTABILIDAD CRITERIO DE ACEPTACIÓN MATRIZ ESTABILIDAD CRITERIO DE ACEPTACIÓN Protocolo para la Validación I Rango de variación ≤ 15% • CONSIDERAR QUE LAS MUESTRAS PUEDEN PROCESARCE UN DÍA Y ANALIZARCE AL SEGUNDO DÍA • Requiere determinar cuanto tiempo se puede mantener una muestra procesada sin sufrir degradación excesiva antes del análisis Fortifica muestras control (blanco) con concentraciones conocidas Dos concentraciones cercanas a los extremos, por triplicado Procesan las muestras en similares condiciones a las experimentales Análisis periódico en intervalos específicos Horas (4 – 24 horas) Temperatura (temperatura ambiente o 4oC) Valido considerar utilizar muestras Seguir los requisitos del método de trabajo reales Primer Día / Segundo Día / Tercer Día (3 días diferentes una jornada analítica) 6 niveles de fortificación / 3 - 6 muestras control (18 – 36 muestras) Calcula repetibilidad intradía e interdía, LOD y LOQ Recuperación porcentual (R%) (A’ / A*100) Reproducibilidad Repetibilidad CV% para cada nivel CV% para cada nivel de fortificación y de fortificación y global global LOD y LOQ Límites de decisión (IC90%) Error α (falso positivo) Error (falso negativo) Distintos días Un mismo día VICH no49; 2015 Recuperación % • por nivel / día • Global Repetibilidad (R%) • por nivel / día Reproducibilidad • por nivel • global α Concentración hallada Límite de decisión LOD y LOQ Límites de decisión (IC90%) Error α (falso positivo) Error (falso negativo) LOD LOQ Concentración de fortificación Protocolo para la Validación II VICH no49; 2015 Protocolo para la Validación III VICH no49; 2015 3 30-Apr-15 Sistemas de Aseguramiento de calidad en laboratorios CONSIDERACIONES FINALES Distintos ámbitos de aplicación: Registro Medicamentos – Alimentos Sustancias Prohibidas y Sustancias con MLR Variabilidad de Matriz de acuerdo a la sustancia en cuestión ÁREA FARMACOLOGIA, FACULTAD DE VETERINARIA GRACIAS por su ATENCIÓN Gonzalo Suárez, DMTV, PhD Montevideo, 30 de abril de 2015 4