Catabolismo aerobio. CdeK y CTE.
Anuncio
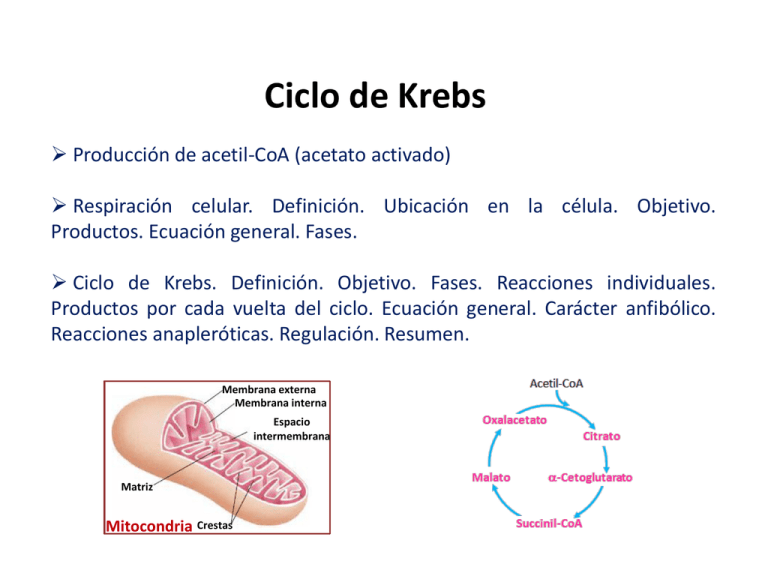
Ciclo de Krebs Producción de acetil-CoA (acetato activado) Respiración celular. Definición. Ubicación en la célula. Objetivo. Productos. Ecuación general. Fases. Ciclo de Krebs. Definición. Objetivo. Fases. Reacciones individuales. Productos por cada vuelta del ciclo. Ecuación general. Carácter anfibólico. Reacciones anapleróticas. Regulación. Resumen. Membrana externa Membrana interna Espacio intermembrana Matriz Mitocondria Crestas RUTAS GENERADORAS DE ACETIL CoA PROTEÍNAS H2O Aminoácidos ALMIDÓN O GLUCOGENO H2O TRIACILGLICERIDO H2O Ác. grasos+Glicerol Glucosa Glucólisis Desaminación Transaminación Piruvato Descarboxilación oxidativa ACETIL-COA CICLO DE KREBS β-oxidación Respiración celular Transferencia de electrones desde las moléculas combustibles (Carbohidratos, Ácidos Grasos y Proteínas) hasta el oxígeno molecular. Este flujo electrónico es el impulsa la mayor producción de ATP Procesos moleculares mediante los que las células consumen O2 y producen CO2. Amino ácidos Glucosa Ácidos grasos Glucólisis Fase I: Producción de Acetil CoA Piruvato Complejo de la (3C) piruvato edeshidrogenasa CO2 Acetil CoA (2C) eee- Respiración celular Fases Fase I • Oxidación de moléculas combutibles orgánicas (glusidos, ácidos grasos y algunos aminoácidos) hasta fragmentos de dos átomos de carbono en forma de grupo acetilo del Acetil-Coenzima A. Fase II Fase II: Oxidación del Acetil CoA Citrato Oxalacetato Ciclo edel Ácido eCítrico eCO2 eCO2 Incorporación de los grupos acetilo al Ciclo del Ácido Cítrico para su oxidación enzimática hasta CO2. Fase III: Transferencia de electrones y fosforilación oxidativa NADH+H+ FADH2 e- Fase III Cadena Respiratoria (transferencia de electrones) ADP + Pi • 2H+ + ½ O2 H2 O • Los electrones transportados por NADH y FADH2 se Transfieren a los transportadores conocidos como Cadena Respiratoria, liberándose una gran cantidad de energía que se conserva en forma de ATP ATP Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Origen metabólico del Acetil-CoA citoplasma Proteínas Carbohidratos Glucolisis Piruvato Piruvato mitocondria Reacción Preparatoria Acetil-CoA Triacilglicéridos Reacción preparatoria al Ciclo de Krebs Descarboxilación oxidativa del piruvato a acetil coenzima A (punto de control metabólico). TPP Lipoato FAD Piruvato Complejo de la piruvato deshidrogenasa (E1 + E2 + E3) + Acetil CoA ΔG’°= -33,4 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Objetivo Oxidación total de los sustratos para la obtención de energía. Acetil-CoA Mitocondria ① Ciclo autocatalítico Oxalacetato →biosíntesis ⑧ Anfibólico Citrato ②a cis-Aconitato Malato NADH+H+ ⑦ ②b FADH2 Fumarato ⑥ ③ ⑤ Succinato GTP (ATP) Succinil -CoA Isocitrato CO2 ④ α-Cetoglutarato →biosíntesis CO2 Ruta cíclica de reacciones enzimáticas para la oxidación del Acetil Coenzima A en condiciones aeróbicas Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 1: Formación del citrato (punto de control metabólico). + Acetil CoA Citrato sintasa Oxalacetato Citrato ΔG’°= -32,2 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 2: Formación del isocitrato a partir del citrato. Aconitasa Aconitasa Citrato Cis-Aconitato Isocitrato ΔG’°= 13,3 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 3: Descarboxilación oxidativa del isocitrato a α‒cetoglutarato y CO2 (punto de control metabólico). NAD(P)HH + H+ NAD(P)+ Isocitrato deshidrogenasa ② ③ ① Isocitrato Oxalsuccinato α‒Cetoglutarato ΔG’°= -33,5 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 4: Descarboxilación oxidativa de α‒cetoglutarato a succinil-CoA y CO2 (punto de control metabólico). TPP Lipoato FAD + Complejo de la α‒Cetoglutarato deshidrogenasa α‒Cetoglutarato Succinil-CoA ΔG’°= -33,5 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 5: Fosforilación a nivel de sustrato (Conversión del succinil-CoA en succinato) a) Succinil-CoA sintasa Succinil-CoA Succinato ΔG’°= -2,9 kJ/mol b) GTP + ADP Profa. Audrey Suárez. Bioquímica Nucleósido difosfato quinasa GDP + ATP ΔG’°= 0 kJ/mol Ciclo de Krebs Reacción N° 6: Oxidación del succinato a fumarato Succinato deshidrogenasa Succinato Fumarato ΔG’°= 0 kJ/mol ¿Por qué no se utiliza NAD en esta reacción de oxidación? Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Reacción N° 7: Hidratación del fumarato a malato OH- Fumarasa Fumarato H+ Fumarasa Malato ΔG’°= -3,8 kJ/mol Profa. Audrey Suárez. Bioquímica.. Ciclo de Krebs Reacción N° 8: Oxidación del malato a oxalacetato L - Malato Malato deshidrogenasa Oxalacetato ΔG’°= 29,7 kJ/mol Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs 1.Condensación Citrato sintasa Acetil-CoA ① Oxalacetato 8.Deshidrogenación Malato deshidrogenasa 2.a.Deshidratación Aconitasa Citrato ⑧ ②a cis-Aconitato Malato NADH+H+ 7.Hidratación Fumarasa ⑦ NADH+H+ NADH+H+ ②b 2.b.Hidratación Aconitasa FADH2 Isocitrato Fumarato ⑥ ③ 6.Deshidrogenación Succinato deshidrogenasa ⑤ Succinil -CoA Succinato GTP (ATP) 5.Fosforilación a nivel de sustrato Succinil-CoA sintetasa 3.Descarboxilación oxidativa Isocitrato dehidrogenasa CO2 ④ α-Cetoglutarato CO2 4.Descarboxilación oxidativa Complejo de la α‒cetoglutarato dehidrogenasa Productos por vuelta del Ciclo de Krebs Acetil-CoA 2 CO2 Ciclo de Krebs 3 NADH + H+ 1 FADH2 1 GTP (1 ATP) Ecuación general Acetil-CoA + 3 NAD+ + FAD + GDP + Pi + 3H2O 2 CO2 + 3 NADH + 3H+ + FADH2 + GTP + CoASH Profa. Audrey Suárez. Bioquímica. Ciclo de Krebs Carácter anfibólico Reacciones anapleróticas malato deshidrogenasa Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Ác. α-cetoglutárico Alanina E: Transaminasa biosíntesis reacción anaplerótica CH2 CH2 COOH l l l C=O COOH + H l H2N – C – COOH l CH3 C=O CH3 Ác. pirúvico H H2N – C – COOH l CH2 Alanina + Ác. glutámico COOH + C=O l COOH CH2 l l 2. reacción anaplerótica COOH l l l Ác. oxalacético E: Transaminasa biosíntesis l l C=O + CH2 COOH H l H2N – C – COOH l CH3 H l H2N – C – COOH l CH2 l COOH Ác. aspártico l COOH l 1. Carácter anfibólico l Ciclo de Krebs CH3 Ác. pirúvico Ciclo de Krebs Reacciones anapleróticas Reacción Tejido(s) / Organismo(s) Piruvato + HCO3- + ATP ↔ Oxalacetato + ADP+ Pi Piruvato carboxilasa Hígado, riñón Fosfoenolpiruvato + CO2 + GDP ↔ Oxalacetato + GTP Corazón, músculo esquelético PEP mm carboxilquinasa Fosfoenolpiruvato + HCO3- + ATP ↔ Oxalacetato + Pi PEP carboxilasa Plantas superiores, levaduras y bacterias Piruvato + HCO3- + NAD(P)H + H+ ↔ Malato + NADP+ Enzima málica Ampliamente distibuido en procariotas y eucariotas Piruvato Complejo piruvato deshidrogenasa ATP, Acetil-CoA, NADH, Ácidos grasos AMP, CoA, NAD+, Ca2+ Acetil-CoA Complejo piruvato deshidrogenasa • Enzima alostérica • Modulada covalentemente forma activa desfosforilada forma inactiva fosforilada NADH, Succinil-CoA, Citrato, ATP ADP Citrato sintasa Oxalacetato Regulación del Ciclo de Krebs Citrato Isocitrato Malato deshidrogenasa NADH+H+ Malato Isocitrato deshidrogenasa ATP α‒cetoglutarato Complejo α‒cetoglutarato deshidrogenasa FADH2 Succinato deshidrogenasa Enzimas del Ciclo de Krebs Ca2+, ADP • • Succinil-CoA, NADH • Ca2+ Succinil-CoA GTP (ATP) Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Disponibilidad de sustratos Inhibición por acumulación de producto Inhibición por retroalimentación de enzimas alostéricas que catalizan las primeras reacciones del ciclo. Ciclo de Krebs Resumen Catabólico o anabólico? Ubicación en la célula Anfibólico Mitocondria (matriz) Objetivo Oxidación total de los sustratos Productos por vuelta por cada Acetil-CoA que ingresa Reacciones que representan el proceso 2 CO2 3 NADH + H+ Autocatalítico 1 FADH2 1 GTP (1 ATP) Descarboxilación oxidativa (CO2 + NADH + H+) Fosforilación a nivel de sustrato (GTP = ATP) Oxidación (NADH+H+ y FADH2) + + FAD + GDP + Pi + 3H O Acetil-CoA + 3 NAD 2 Ecuación general del proceso + 2 CO2 + 3 NADH + 3H + FADH2 + GTP + CoASH Profa. Audrey Suárez. Bioquímica Feliz día Cadena de transporte de electrones Cadena de transporte de electrones. Definición. Ubicación en la célula. Complejos constituyentes. Objetivo. Componentes de la cadena respiratoria. Teoría Quimiosmótica de Mitchell. Fosforilación oxidativa. Ecuación general. Reacciones que la caracterizan. Aceptor electrónico final. Productos. Balance energético de la respiración celular. Energética de la cadena respiratoria. Membrana externa Membrana interna Espacio intermembrana Cadena de Transporte de Electrones • Ruta final común por la que fluyen hasta el oxígeno los electrones obtenidos de diferentes combustibles (carbohidratos, ácidos grasos, aminoácidos). Matriz Mitocondria Crestas • Rutas y/o reacciones que suministran potenciales de reducción: Ciclo de Krebs, β‒oxidación, Glucólisis, reacción preparatoria del ciclo de Krebs. • Ubicación: Membrana mitocondrial interna. • Organizada en 5 complejos proteicos: I : NADH deshidrogenasa II : Succinato deshidrogenasa →Transporte de electrones III: Citocromo bc1 IV : Citocromo c oxidasa V : ATP sintasa → Cataliza la síntesis de ATP Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. v Cadena de Transporte de Electrones • Reacciones de óxido reducción: Dador electrónico e- + Aceptor electrónico v • Incluye: 1.-Transporte de electrónico desde los sustratos hasta el O2 , mediado por 4 complejos proteicos → Liberación escalonada de energía (ΔG’°) 2.-Síntesis de ATP (fosforilación oxidativa) en el complejo proteico V (ATP sintasa) → Acoplada al transporte electrónico • Objetivo: Oxidación total de los sustratos para la obtención de energía (ATP). • Productos: H2O + ATP. Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Cadena de Transporte de Electrones Componentes Enzimas deshidrogenasas piridín dependientes Coenzimas: NAD+/NADH; NADP+/NADPH Ej.: Gliceraldehído 3P deshidrogenasa, complejo de la piruvato deshidrogenasa, α‒cetoglutarato deshirogenasa, malato deshidrogenasa. Enzimas Grupos prostéticos FAD+/FADH2, FMN+/FMNH2 deshidrogenasas flavín dependientes Ej.: Succinato deshidrogenasa. Coenzima Q (CoQ) o Ubiquinona Benzoquinona con cadena isoprenoide larga (iposoluble). Portador móvil. Citocromos Proteínas con Fe asociado al grupo hemo. Transfieren electrones. Fe3+ / Fe2+ Cit b, c1, c (portador móvil) , a, a3 Proteínas ferro sulfuradas (Fe-S) Proteínas con Fe asociado al S (inorgánico o al de la Cis). Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Producto (oxidado) Sustrato (reducido) Piruvato Isocitrato α‒cetoglutarato Malato Cadena de Transporte de Electrones (transportadores elctrónicos) NAD+ FMNH2 NADH+H+ FMN CoQ Complejo I NADH deshidrogenasa Fumarato Succinato Aceptor electrónico final Fe2+ Fe3+ Fe2+ Cit bc1 Cit c Cit aa3 Fe3+ Fe2+ Fe3+ ½ O2 FADH2 FAD CoQH2 Complejo II Succinato deshidrogenasa Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Complejo III Cit bc1 Complejo IV Citocromo c oxidasa H2O Modelo Quimiosmótico de Mitchell El flujo de electrones a través de los complejos I, III y IV Bombeo de protones a través de la membrana mitocondrial interna desde la matriz hacia el espacio intermembrana. Espacio intermembrana espacio intermembrana Membrana mitocondrial interna Fosforilar v matriz Matriz Gradiente de pH ΔpH (interno alcalino) Energía generada por el gradiente de protones se acopla a la Síntesis de ATP (Complejo V) ADP + Pi ATP ATP sintasa (membrana interna) Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Gradiente eléctrico Δψ (interno negativo) Fosforilación oxidativa Mecanismo por el cual la disminución de la energía libre que acompaña la transferencia de electrones a lo largo de la cadena respitaroria, se acopla a la formación de los grupos fosfatos de contenido energético elevado del ATP ADP + Pi ATP Importancia: Fundamental para todos los organismos aeróbicos porque constituye su principal fuente de energía. Cadena de Transporte de Electrones, Síntesis de ATP ADP + Pi ATP ΔG’°= 30,2 kJ/mol Energía + ≥ 30,5HkJ/mol Energía ≥ 30,5 kJ/molH+ Energía + ≥ 30,5HkJ/mol Cit c CoQ ++ NADH NADH+ +HH Piruvato Isocitrato α‒Cetoglutarato Malato NAD+ ½ O2 + 2H+ FADH2 FAD+ Succinato Gliceraldehído 3P* (*lanzadera) NADH extramitocondrial 1 NADH + H+ (mitocondrial) 1 FADH2 1 NADH + H+ (extramitocondrial) Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. CteCteCte- 3 ATP 2 ATP 2 ATP H2O Balance energético Degradación de una molécula de glucosa en la respiración celular Glucosa 1ra fase glucólisis 2 ATP 2 Gliceraldehído 3P 2 NADH+H+ CTe- citosol 4 ATP* 4 ATP 2da fase glucólisis 2 Piruvato 1 NADH+H+* extramitocondrial 1 NADH+H+ 1 FADH2 1 GTP CTeCTeCTe- 4 CO2 2 ATP 2 NADH+H+ 6 NADH+H+ CTe- 6 ATP Reacción preparatoria 2 Acetil CoA 3 ATP 2 ATP 1 ATP 2 FADH2 CTeCTe- 4 CO2 2 GTP 18 ATP 4 ATP Ciclo de Krebs 2 ATP mitocondria ATP netos= 38 ATP producidos - 2 ATP consumidos = 36 ATP/glucosa 32 Profa. Audrey Suárez. Bioquímica. Unidad II. Metabolismo de Carbohidratos Cadena de Transporte de Electrones Liberación de energía durante el transporte de electrones 1.- Par redox 2.- Potencial de reducción estándar 3.- ΔG’° está relacionado con ΔE’° 4.- ΔG’° del ATP Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. 1.- Pares redox NADH+H+ NAD+ NADH+H+ FMN + 2e- + 2H+ FMN FMNH2 Reacción de óxido reducción general (donador y aceptor de electrones) NAD+ + 2e- + 2H+ Par redox E’°= -0,32 V FMNH2 Par redox E’°= -0,22 V Componentes de las reacciones redox 2.- Potencial de reducción estándar (E’°) Los pares redox difieren de su tendencia a perder electrones y se especifica por el potencial de reducción estándar (E’°) Tabla 19-2. Potenciales de reducción estándar (pH 7) de la cadena respiratoria y transportadores de electrones relacionados Reacción redox (media reacción) E’° (V) 2H+ + 2e- → H2 NAD+ + H+ + 2e- → NADH NADP+ + H+ + 2e- → NADPH NADH deshidrogenasa (FMN) + 2H+ + 2e- → NADH deshidrogenasa (FMNH2) Ubiquinona + 2H+ + 2e- → Ubiquinol Citocromo b (Fe3+) + e- → Citocromo b (Fe2+) Citocromo c1 (Fe3+) + e- → Citocromo c1 (Fe2+) Citocromo c (Fe3+) + e- → Citocromo c (Fe2+) Citocromo a (Fe3+) + e- → Citocromo a (Fe2+) Citocromo a3 (Fe3+) + e- → Citocromo a3 (Fe2+) ½ O2 + 2H+ + 2e- → H2O -0,414 -0,320 -0,324 -0,30 0,045 0,077 0,22 0,254 0,29 0,35 0,8166 aceptor electrónico final >> ceder e- >> aceptar e- 3.- ΔG’° está relacionada con ΔE’° El cambio de energía libre está directamente relacionado con la magnitud del cambio del potencial estándar ΔG’° = -n F ΔE’° ΔG’° = Variación de la Energía Libre Estándar de Gibbs (pH 7) n = Número de electrones transferidos (2) F = Constante de Faraday (95, 5 kJ mol-1 V-1 o 23, 062 kcal mol-1 V-1) Calcular la energía ΔE’° = Diferencia de Potencial Estándar (Voltios) desprendida durante el = (E° aceptor – E° dador) transporte electrónico. Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. 4.- ΔG’° del ATP Energía libre estándar de formación del ATP ∆G’°= 30,5 kJ /mol 30,2 kJ mol-1 ADP + Pi → ATP + H2O E: ATP sintasa Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Energética de la Cadena de Transporte de Electrones ΔG’° = -n F ΔE’° 1.-Cálculo de ΔG’° desde el NADH + H+ hasta el O2 Transferencia de un par de equivalentes electrónicos desde el NADH + H+ (E’°= -0,32 V) hasta el O2 (E’°= 0,82 V). NADH + H+ + ½ O2 NAD+ + H2O ΔG’°= – 2 x 95,5 KJ mol-1 V-1 x (0,82 V – (– 032 V) ΔG’° = – 217,7 KJ mol-1 2.-Energía libre estándar de formación del ATP ADP + Pi ATP + H2O ΔG’° = 30,5 KJ mol-1 Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. Eficacia en la recuperación de la energía durante la fosforilación oxidativa NADH + H+ + 1/2O2 ADP + Pi %Eficacia= NAD+ + H2O ATP + H2O 3 x 30,5 KJ mol-1 217,7 KJ mol-1 ΔG°= – 217,7 KJ mol-1 ΔG° = 30,5 KJ mol-1 * 100 = 42% Ecuación global de la respiración Glucosa + 6O2 + 36 Pi + 36ADP 6CO2 + 36ATP + 42H2O ΔG° = – 2861,1 KJ mol-1 Eficacia global en la recuperación de la energía en la oxidación completa de la glucosa Glucosa + 6O2 6CO2 + 6H2O 36Pi + 36ADP 36ATP + 36H2O ΔG° = 36 x 30,5 KJ mol-1 = 1098 KJ mol-1 %Eficacia= 1098 KJ mol-1 2861,1 KJ mol-1 * 100 = 38% ΔG° = – 2861,1 KJ mol-1 ECUACIONES DE LAS RUTAS CATABÓLICAS AERÓBICAS Cadena de Transporte de Electrones NADH + H+ + ½ O2 NADH + 2H2O Reacción que representa el proceso → oxidaciones Ej.: Cit b-Fe2+ Cit c1-Fe3+ Cit b-Fe3+ Cit c1-Fe2+ Profa. Audrey Suárez. Bioquímica. Objetivo 2. Carbohidratos. Metabolismo. Cadena de Transporte de Electrones Resumen Catabólico o anabólico? Catabólico Ubicación en la célula Mitocondria (membrana mitocondrial interna) Objetivo 1.-Transferencia de e- hasta el O2 mediado por proteínas y un compuesto lipídico. 2.-Síntesis de ATP (fosforilación oxidativa) acoplada al transporte de e- Rutas que suministran potenciales de reducción (carbohidratos) Reacciones que representan el proceso Equivalencias de los potenciales de reducción en términos de ATP Ecuación general del proceso • Ciclo de Krebs (NADH + H+ y FADH2 en la mitocondria) • Glucólisis (NADH + H+ extramitocondrial) Oxidaciones 1 NADH+H+ (mitocondrial) 1 FADH2 1 NADH+H+ (extra mitocondrial) NADH + H+ + ½ O2 *Lanzadera glicerol 3P Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. CTeCTeCTe- 3 ATP 2 ATP 2 ATP* NADH + 2H2O Feliz día CICLO DE KREBS Y CADENA DE TRANSPORTE DE ELECTRONES Objetivo -Transferencia de electrones hasta el oxígeno molecular -Síntesis de ATP (Fosforilación Oxidativa) → procesos de biosíntesis, mecánico y de transporte celular. Membrana externa Membrana interna Espacio intermembrana Matriz Ciclo de Krebs Matriz mitocondrial Mitocondria Crestas H+ NAD+ FADH2 NADH+H+ II eI e- e- ee- ADP+Pi e- ATP ATP ADP +Pi FAD e- CoQ e- Citc e- e- e- IV V e- ATP ATP ATP/ADP translocasa V III ½ O2 + 2H H2O Espacio intermembrana H+ H+ H+ H++ Fosforilación oxidativa Teoría Quimiosmótica de Mitchell ADP Transporte electrónico se acopla a la síntesis de ATP (fosforilación oxidativa). Reacciones que representan el proceso reacciones de óxido reducción. Profa. Audrey Suárez. Bioquímica. Unidad II. Carbohidratos. Metabolismo. NADH par e- O2 → ΔG°= (-) escalonada 42 SÍNTESIS DE ATP (MODELO QUIMIOSMÓTICO) El flujo de electrones a través de los complejos I, III y IV da lugar al bombeo de protones a través de la membrana mitocondrial interna. La matriz se hace alcalina con respecto al espacio intermembrana. Se crea un gradiente de protones que sumistra la energía (fuerza protón motriz) para la síntesis de ATP a partir de: ADP + Pi ATP ATP sintasa (membrana interna) matriz 2H+ Espacio intermembrana IV + + + + + 4H+ Cit c 4H+ + + + + + Q I - NADH+H+ NAD+ II - Fumarato Succinato Matriz III ½O2 + H2O 2H+ ADP+Pi ATP -- F1 H+ + F0 + + + + --- espacio intermembrana Fuerza protón motriz + ---43 Profa. Audrey Suárez. Bioquímica. Unidad II. Metabolismo de Carbohidratos. Potencial de reducción estándar (E°) • Los pares redox difieren de su tendencia a perder electrones y se especifica por el potencial de reducción estándar (E°) • Cuanto más negativo es el potencial de reducción estándar (E°) de un par redox, mayor es la tendencia a perder electrones del miembro reductor de ese par • Cuanto más positivo es el potencial de reducción estándar (E°) de un par redox, mayor es la tendencia a aceptar electrones del miembro oxidante de ese par. Potencial de reducción estándar Menor afinidad por los e- Mayor afinidad por los e- Tabla 19-2. Potenciales estándar de reducción (pH 7) de la cadena respiratoria transportadores de electrones relacionados Reacción redox (media reacción) 2H+ + 2e- → H2 NAD+ + H+ + 2e- → NADH NADP+ + H+ + 2e- → NADPH NADH deshidrogenasa (FMN) + 2H+ + 2e- → NADH deshidrogenasa (FMNH2) Ubiquinona + 2H+ + 2e- → Ubiquinol Citocromo b (Fe3+) + e- → Citocromo b (Fe2+) Citocromo c1 (Fe3+) + e- → Citocromo c1 (Fe2+) Citocromo c (Fe3+) + e- → Citocromo c (Fe2+) Citocromo a (Fe3+) + e- → Citocromo a (Fe2+) Citocromo a3 (Fe3+) + e- → Citocromo a3 (Fe2+) ½ O2 + 2H+ + 2e- → H2O aceptor electrónico final Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. E’° (V) -0,414 -0,320 -0,324 -0,30 0,045 0,077 0,22 0,254 0,29 0,35 0,8166 y Fosforilación oxidativa → Síntesis de ATP en la Cadena de Transporte de electrones Modelo Quimiosmótico de Mitchell El flujo de electrones a través de los complejos I, III y IV da lugar al bombeo de protones a través de la membrana mitocondrial interna. La matriz se hace alcalina con respecto al espacio intermembrana. Se crea un gradiente de protones que sumistra la energía (fuerza protón motriz) para la síntesis de ATP a partir de: ADP + Pi ATP ATP sintasa (membrana interna) matriz 2H+ 4H+ Cit c 4H+ + + + + + Q I - NADH+H+ NAD+ II - Fumarato Succinato Matriz III ½O2 + Espacio intermembrana IV + + + + + H2O 2H+ ADP+Pi ATP -- F1 H+ Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. + F0 + + + + --- espacio intermembrana Fuerza protón motriz + ---- 2.- Potencial de reducción estándar (E°) • Los pares redox difieren de su tendencia a perder electrones y se especifica por el potencial de reducción estándar (E°) GTP century GTP GTP Tabla 19-2. Potenciales estándar de reducción (pH 7) de la cadena respiratoria y transportadores de electrones relacionados Reacción redox (media reacción) E’° (V) 2H+ + 2e- → H2 NAD+ + H+ + 2e- → NADH NADP+ + H+ + 2e- → NADPH NADH deshidrogenasa (FMN) + 2H+ + 2e- → NADH deshidrogenasa (FMNH2) Ubiquinona + 2H+ + 2e- → Ubiquinol Citocromo b (Fe3+) + e- → Citocromo b (Fe2+) Citocromo c1 (Fe3+) + e- → Citocromo c1 (Fe2+) Citocromo c (Fe3+) + e- → Citocromo c (Fe2+) Citocromo a (Fe3+) + e- → Citocromo a (Fe2+) Citocromo a3 (Fe3+) + e- → Citocromo a3 (Fe2+) ½ O2 + 2H+ + 2e- → H2O -0,414 aceptor electrónico final Profa. Audrey Suárez. Bioquímica. Objetivo 2. Metabolismo de Carbohidratos. >> ceder e- -0,320 -0,324 -0,30 0,045 0,077 0,22 0,254 0,29 0,35 0,8166 >> aceptar e-