Boletin_modelos atomicosII_config_elec_gybu
Anuncio
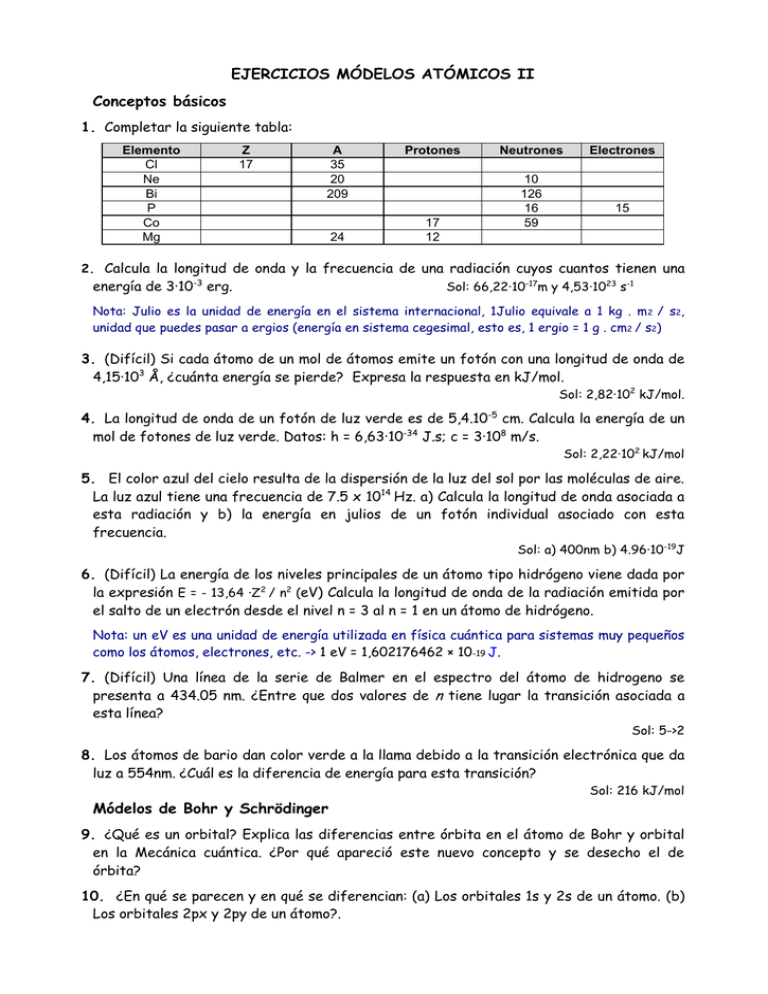
EJERCICIOS MÓDELOS ATÓMICOS II Conceptos básicos 1. Completar la siguiente tabla: Elemento Cl Ne Bi P Co Mg Z 17 A 35 20 209 24 Protones 17 12 Neutrones 10 126 16 59 Electrones 15 2. Calcula la longitud de onda y la frecuencia de una radiación cuyos cuantos tienen una energía de 3·10-3 erg. Sol: 66,22·10-17m y 4,53·1023 s-1 Nota: Julio es la unidad de energía en el sistema internacional, 1Julio equivale a 1 kg . m 2 / s2, unidad que puedes pasar a ergios (energía en sistema cegesimal, esto es, 1 ergio = 1 g . cm2 / s2) 3. (Difícil) Si cada átomo de un mol de átomos emite un fotón con una longitud de onda de 4,15·103 Å, ¿cuánta energía se pierde? Expresa la respuesta en kJ/mol. Sol: 2,82·102 kJ/mol. 4. La longitud de onda de un fotón de luz verde es de 5,4.10-5 cm. Calcula la energía de un mol de fotones de luz verde. Datos: h = 6,63·10-34 J.s; c = 3·108 m/s. Sol: 2,22·102 kJ/mol 5. El color azul del cielo resulta de la dispersión de la luz del sol por las moléculas de aire. La luz azul tiene una frecuencia de 7.5 x 1014 Hz. a) Calcula la longitud de onda asociada a esta radiación y b) la energía en julios de un fotón individual asociado con esta frecuencia. Sol: a) 400nm b) 4.96·10-19J 6. (Difícil) La energía de los niveles principales de un átomo tipo hidrógeno viene dada por la expresión E = - 13,64 ·Z2 / n2 (eV) Calcula la longitud de onda de la radiación emitida por el salto de un electrón desde el nivel n = 3 al n = 1 en un átomo de hidrógeno. Nota: un eV es una unidad de energía utilizada en física cuántica para sistemas muy pequeños como los átomos, electrones, etc. -> 1 eV = 1,602176462 × 10-19 J. 7. (Difícil) Una línea de la serie de Balmer en el espectro del átomo de hidrogeno se presenta a 434.05 nm. ¿Entre que dos valores de n tiene lugar la transición asociada a esta línea? Sol: 5->2 8. Los átomos de bario dan color verde a la llama debido a la transición electrónica que da luz a 554nm. ¿Cuál es la diferencia de energía para esta transición? Módelos de Bohr y Schrödinger Sol: 216 kJ/mol 9. ¿Qué es un orbital? Explica las diferencias entre órbita en el átomo de Bohr y orbital en la Mecánica cuántica. ¿Por qué apareció este nuevo concepto y se desecho el de órbita? 10. ¿En qué se parecen y en qué se diferencian: (a) Los orbitales 1s y 2s de un átomo. (b) Los orbitales 2px y 2py de un átomo?. 11. Para que las siguientes expresiones sean correctas en el espacio en blanco hay que situar la palabra orbital o subnivel. Indica qué palabra situarías en cada caso y en qué casosse pueden situar las dos. Justifica la respuesta. a) El electrón puede ocupar el _________________ 2s. b) Hay un ______________ que se llama 2p. c) El electrón puede estar en el _____________ 3p. d) En el ______________ 3d puede haber 10 electrones e) Para los mismos valores de n siempre hay tres ______________ p diferentes. f) Un _______________ dado nunca puede tener más de dos electrones. 12. (difícil) Calcula en ergios/átomo y en electrónvoltio/átomo la diferencia de energía entre los orbitales 1s y 2p del átomo de cobre a partir de los siguientes datos: Frecuencia de la radiación emitida en la transición 2p al 1s : 1,95·1012 Hz; constante de Planck, h = 6,62·10-34 J.s; carga del electrón, e= 1,6·10-19C. Sol:1,209.10-14erg. Configuración electrónica y números cuánticos 13. Indica los valores de los números cuánticos correspondientes a los electrones que ocupan el segundo nivel energético de un átomo. 14. ¿Cuántos electrones caben en este nivel? ¿Y en el nivel 3? ¿Y cuantos electrones caben en el subnivel p de la tercera capa electrónica? 15. Razona cuáles de los siguientes conjuntos de valores de (n, l, m) no son posibles: a) (3, -1, 1) b) (3, 0, 0) c) (1, 1, 0) d) (0, 0, 1) 16. Dados los siguientes grupos de números cuánticos (n, l, m): (3, 2, 0); (3,3,2); (3 ,0 , 0); (2, -1, 1); (4, 2, 0). Indica cuáles no son permitidos. 17. (2, 3, 0); ¿Son posibles los estados representados por los siguientes números cuánticos?: (2 , 0 , 0 , -1/2) (3 , 1 , -1 , 1/2) (1 , 1 , 0 , 1/2) (4 , 0 , 1 –1/2) 18. ¿Cuál es el número máximo de electrones que puede alojar un átomo en el que el valor más alto del número cuántico principal sea 4? ¿Qué principio determina este número de electrones? 19. ¿Cuántos subniveles energéticos contiene el nivel n=3? ¿Qué valores de los números cuánticos determina cada uno de esos subniveles? Nota: Un subnivel energético lo constituyen todos los orbitales del mismo tipo en ese nive 20. ¿Pueden existir orbitales 2d? Justifica la respuesta 21. ¿Cuántos orbitales componen un subnivel energético f? 22. Dadas las siguientes configuraciones electrónicas 2 2 2 1 2 2 2 3 2 2 6 3Li: 1s 2s 5B: 1s 2s 2p 7N: 1s 2s 2p 8O: 1s 2s 2p a. ¿Cuáles corresponden a iones? b. ¿Cuáles representan un estado excitado? Nota: Recuerda un ión es un átomo que ha ganado (o perdido) algún electrón, y un átomo está en un estado excitado cuando alguno de sus electrones a pasado de los orbitales de mínima energía a algún orbital de energía superior 23. Justifica si las siguientes configuraciones electrónicas representan un estado fundamental, excitado o prohibido: a) 1s2 2s2 2px2py2pz1 3s1 b) 1s2 2s3 2px2py2pz1 c) 1s2 2s2 2p6 d) 1s2 2s2 2p6 3s1 24. ¿Qué relación existe entre un grupo de la clasificación periódica y el número de electrones de la última capa de los átomos de elementos pertenecientes al mismo?. 25. ¿Qué tienen en común todos lo elementos del mismo periodo de la tabla periódica? 26. Para cada caso, ¿cuál es el número total de electrones en un átomo si el último orbital que esta lleno corresponde a los siguientes valores de los números cuánticos? a. n=3, l=1 b. n=3, l=1, m=-1 27. El sodio, elemento del Grupo 1 y Periodo 3, tiene la configuración electrónica 1s2 2s2 2p6 3s1. ¿Cuántos electrones del átomo de sodio tienen a. m= -1 b. l= -1? 28. Escribe la configuración electrónica de los elementos de número atómico 16, 26 y 92. Indica el grupo y periodo al que pertenecen y el bloque del Sistema Periodico en que se encuentran 29. Escribe las configuraciones electrónicas de las siguientes especies químicas: K+, Cl-, Mg2+ y B Nota: Ten en cuenta que un ión simplemente es un átomo que ha ganado (o perdido) algún electrón 30. Contesta a. ¿cuál es la configuración electrónica del estado fundamental del boro? b. ¿qué números cuánticos asignarías a los electrones de la última capa de ese átomo c. propón una configuración para un estado excitado 31. Considerando un átomo representado por 39 19 X indica a. Número atómico b. número másico c. número de electrones d. número de protones e. masa atómica aproximada f. configuración electrónica g. periodo y grupo al que pertenece h. ión monoatómico más estable que formará previsiblemente 32. Indica a. número de protones, neutrones y electrones en un átomo neutro del isótopo 14 del nitrógeno b. ¿en qué se convertiría si se añadiese un protón más a su núcleo? c. ¿Y si se eliminase un electrón de su nivel exterior? d. ¿En qué se transformaría ese átomo si se añadiese un protón a su núcleo? e. la configuración electrónica de cada una de las especies químicas anteriores 33. Justifica cómo las siguientes configuraciones electrónicas se relacionan con el elemento Z= 8 a) 1s2 2s2 2p4 b) 1s2 2s2 2p3 3s1 c) 1s2 2s22p3 34. En qué se parecen y en qué se diferencian las configuraciones electrónicas de los elementos de número atómico 8, 16 y 34 35. ¿A qué periodo pertenece un elemento que posee la configuración 1s2 2s22p6 3s23p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d4?. Razona si se trata de un metal, de un elemento de transición o de un elemento de transición interna 36. ¿Qué tienen en común a. los isótopos de un mismo elemento b. los elementos de un grupo de la tabla periódica c. Los elementos de un mismo periodo d. los elementos de transición 37. Escribe la configuración electrónica general de a. un metal alcalino (1ª columna de la tablar) b. un halógeno (penúltima columna de la tabla) c. un gas noble (última columna de la tabla) d. un ión negativo de un halógeno e. un ión positivo de un metal alcalino 38. Dadas las siguientes configuraciones electrónicas indica el número atómico de cada elemento, así como el periodo y el grupo al que pertenecen cada uno a. [Ne] 3s23p2 b. [Ne] 3s23p5 c. [Kr] 5s2 d. [He] 2s22p5 39. ¿Es posible que la configuración electrónica de un átomo sea 1s2 2s22p6 4s1? ¿Por qué? 40. Escribe las configuraciones electrónicas del estado fundamental del nitrógeno, argón, magnesio, hierro, ión hierro(II) e ion hierro(III) e identifica los electrones desapareados que existen en cada uno de los átomos e iones. 41. Ordena según los radios atómicos crecientes los elementos cuyas configuraciones electrónicas son a. 1s2 b. 1s2 2s1 c. 1s22s22p1 d. 1s2 2s2 42. Tres elementos tienen de número atómico 19, 35 y 54, indica a. configuración electrónica b. grupo y periodo de cada uno c. el de mayor afinidad electrónica d. el de menor potencial de ionización 43. Indica en cada caso el elemento que corresponde a la característica reseñada a) su configuración electrónica es 1s2 2s22p6 3s23p4 b) es el alcalino de mayor tamaño c) es el elemento del grupo del nitrógeno con mayor energía de ionización d) es el elemento cuyo ión positivo posee la configuración [Kr] 4d6 44. Quién tiene en su ultima capa 8 electrones? a. Fe b. S2c. Mg2+ d. O 45. Cuantos electrones caben en los orbitales del nivel n: 3? Dibuja el diagrama de niveles (con cajas) con los electrones. 46. Escribe la estructura electrónica de los elementos de números atómicos 11, 14, 35, 38, 54 y conteste: a) A que grupo del sistema periódico pertenece cada uno? b) Cuales son metales y cuales no metales? c) Cuál será más electronegativo y cual más electropositivo? 47. Identificar las siguientes configuraciones electrónicas con los correspondientes elementos: a) 1s2.2s2.2p3. b) 1s2.2s2.2p2. c) 1s2.2s2.2p6.3s2.3p3. d) 1s2.2s2.2p4.