modelos atómicos QGI 1
Anuncio
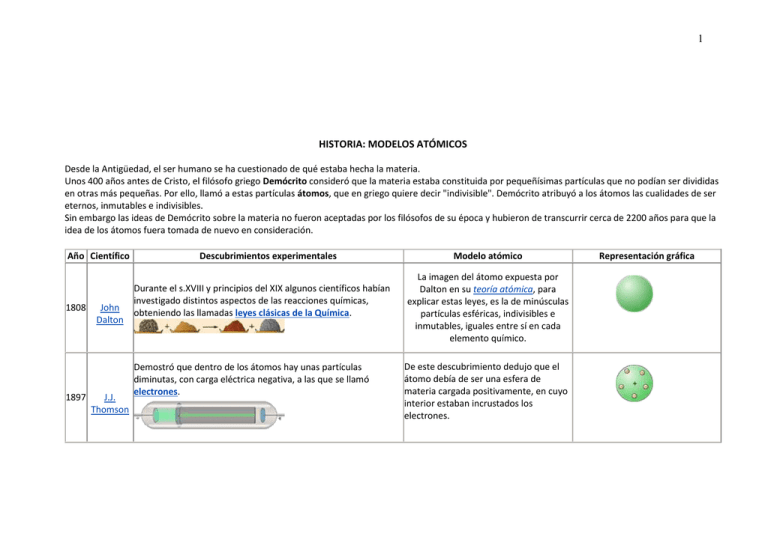
1 HISTORIA: MODELOS ATÓMICOS Desde la Antigüedad, el ser humano se ha cuestionado de qué estaba hecha la materia. Unos 400 años antes de Cristo, el filósofo griego Demócrito consideró que la materia estaba constituida por pequeñísimas partículas que no podían ser divididas en otras más pequeñas. Por ello, llamó a estas partículas átomos, que en griego quiere decir "indivisible". Demócrito atribuyó a los átomos las cualidades de ser eternos, inmutables e indivisibles. Sin embargo las ideas de Demócrito sobre la materia no fueron aceptadas por los filósofos de su época y hubieron de transcurrir cerca de 2200 años para que la idea de los átomos fuera tomada de nuevo en consideración. Año Científico 1808 1897 John Dalton J.J. Thomson Descubrimientos experimentales Durante el s.XVIII y principios del XIX algunos científicos habían investigado distintos aspectos de las reacciones químicas, obteniendo las llamadas leyes clásicas de la Química. Demostró que dentro de los átomos hay unas partículas diminutas, con carga eléctrica negativa, a las que se llamó electrones. Modelo atómico La imagen del átomo expuesta por Dalton en su teoría atómica, para explicar estas leyes, es la de minúsculas partículas esféricas, indivisibles e inmutables, iguales entre sí en cada elemento químico. De este descubrimiento dedujo que el átomo debía de ser una esfera de materia cargada positivamente, en cuyo interior estaban incrustados los electrones. Representación gráfica 2 1911 1913 E. Rutherford Demostró que los átomos no eran macizos, como se creía, sino que están vacíos en su mayor parte y en su centro hay un diminuto núcleo. Espectros atómicos discontinuos originados por la radiación emitida por los átomos excitados de los elementos en estado gaseoso. Niels Bohr Dedujo que el átomo debía estar formado por una corteza con los electrones girando alrededor de un núcleo central cargado positivamente. Propuso un nuevo modelo atómico, según el cual los electrones giran alrededor del núcleo en unos niveles bien definidos. 3 TEORÍA ATÓMICA DE DALTON En 1808, Dalton publicó sus ideas sobre el modelo atómico de la materia las cuales han servido de base a la química moderna. Los principios fundamentales de esta teoría son: 1. La materia está formada por minúsculas partículas indivisibles llamadas átomos. 2. Hay distintas clases de átomos que se distinguen por su masa y sus propiedades. Todos los átomos de un elemento poseen las mismas propiedades químicas. Los átomos de elementos distintos tienen propiedades diferentes. 3. Los compuestos se forman al combinarse los átomos de dos o más elementos en proporciones fijas y sencillas. De modo que en un compuesto los de átomos de cada tipo están en una relación de números enteros o fracciones sencillas. 4. En las reacciones químicas, los átomos se intercambian de una a otra sustancia, pero ningún átomo de un elemento desaparece ni se transforma en un átomo de otro elemento. LEYES CLASICAS DE LA QUÍMICA Puede decirse que la química nace como ciencia a finales del siglo XVIII y principios del XIX, con la formulación por Lavoisier, Proust y el propio Dalton, tras la experimentación cuantitativa de numerosos procesos químicos, de las llamadas leyes clásicas de la química: 1. En el siglo XVIII, Antoine Lavoisier, considerado el padre de la química moderna, estableció la ley de la conservación de la masa, formulada en su libro "Elementos químicos" (1789). En ella se dice que no se produce un cambio apreciable de la masa en las reacciones químicas. Dicho de otra manera: Las reacciones químicas son cambios en la disposición de los átomos. Los átomos no se crean, ni se destruyen, ni cambian. 2. La ley de la composición definida o constante. Esta ley, establecida en 1801 por el químico francés Joseph Proust, nos dice que un compuesto contiene siempre los mismos elementos en la misma proporción de masas. O expresada de otra manera, cuando dos elementos se combinan para dar un determinado compuesto lo hacen siempre en la misma relación de masas. 3. La ley de las proporciones múltiples. Formulada por el propio Dalton, se aplica a dos elementos que forman más de un compuesto: Establece que las masas del primer elemento que se combinan con una masa fija del segundo elemento, están en una relación de números enteros sencillos. DESCUBRIMIENTO DEL ELECTRÓN 4 La primera evidencia de la existencia de partículas subatómicas y por tanto de que los átomos no eran indivisibles como postulaba la teoría atómica de Dalton, se obtuvo de los estudios de la conductividad eléctrica de gases a bajas presiones. Los gases son aislantes para voltajes bajos, sin embargo, frente a voltajes elevados se vuelven conductores. Cuando en un tubo de vidrio que contiene un gas se hace parcialmente el vacío y se aplica un voltaje de varios miles de voltios, fluye una corriente eléctrica a través de él. Asociado a este flujo eléctrico, el gas encerrado en el tubo emite unos rayos de luz de colores, denominados rayos catódicos, que son desviados por la acción de los campos eléctricos y magnéticos. Mediante un estudio cuidadoso de esta desviación, J. J. Thomson demostró en 1897 que los rayos estaban formados por una corriente de partículas cargadas negativamente, que llamó electrones. MODELO ATOMICO DE THOMSON La identificación por J.J. Thomson de unas partículas subatómicas cargadas negativamente, los electrones, a través del estudio de los rayos catódicos, y su posterior caracterización, le llevaron a proponer un modelo de átomo que explicara dichos resultados experimentales. Se trata del modelo conocido informalmente como el pudín de ciruelas, según el cual los electrones eran como 'ciruelas' negativas incrustadas en un 'pudín' de materia positiva. DESCUBRIMIENTO DEL NÚCLEO ATÓMICO Los experimentos llevados a cabo en 1911 bajo la dirección de Ernest Rutherford modificaron las ideas existentes sobre la naturaleza del átomo. Rutherford y sus colaboradores bombardearon una fina lámina de oro con partículas alfa (núcleos de helio) procedentes de un elemento radiactivo. Observaban, mediante una pantalla fluorescente, en qué medida eran dispersadas las partículas. La mayoría de ellas atravesaba la lámina metálica sin cambiar de dirección; sin embargo, unas pocas eran reflejadas hacia atrás con ángulos pequeños. Éste era un resultado completamente inesperado, incompatible con el modelo de átomo macizo existente. Mediante un análisis matemático de las fuerzas involucradas, Rutherford demostró que la dispersión era causada por un pequeño núcleo cargado positivamente, situado en el centro del átomo de oro. De esta forma dedujo que la mayor parte del átomo es espacio vacío, lo que explicaba por qué la mayoría de las partículas que bombardeaban la lámina de oro, pasaran a través de ella sin desviarse. MODELO ATOMICO DE RUTHERFORD Rutherford, basándose en los resultados obtenidos en sus experimentos de bombardeo de láminas delgadas de metales, estableció el llamado modelo atómico de Rutherford o modelo atómico nuclear. El átomo está formado por dos partes: núcleo y corteza. El núcleo es la parte central, de tamaño muy pequeño, donde se encuentra toda la carga positiva y, prácticamente, toda la masa del átomo. Esta carga positiva del núcleo, en la experiencia de la lámina de oro, es la responsable de la desviación de las partículas alfa (también con carga positiva). La corteza es casi un espacio vacío, inmenso en relación con las dimensiones del núcleo. Eso explica que la mayor parte de las partículas alfa atraviesan la lámina de oro sin desviarse. Aquí se encuentran los electrones con masa muy pequeña y carga negativa. Como en un diminuto sistema solar, los electrones 5 giran alrededor del núcleo, igual que los planetas alrededor del Sol. Los electrones están ligados al núcleo por la atracción eléctrica entre cargas de signo contrario. ESPECTROS ATÓMICOS En el siglo XVII, Isaac Newton demostró que la luz blanca visible procedente del sol puede descomponerse en sus diferentes colores mediante un prisma. El espectro que se obtiene es continuo; contiene todas las longitudes de onda desde el rojo al violeta, es decir, entre unos 400 y 700 nm (1 nm -nanómetro- = 10-9 m). En cambio la luz emitida por un gas incandescente no es blanca sino coloreada y el espectro que se obtiene al hacerla pasar a través de un prisma es bastante diferente. Es un espectro discontinuo que consta de líneas o rayas emitidas a longitudes de onda específicas. Cada elemento (es decir cada tipo de átomos) posee un espectro característico que puede utilizarse para identificarlo. Por ejemplo, en el del sodio, hay dos líneas intensas en la región amarilla a 589 nm y 589,6 nm. Uno de los espectros atómicos más sencillos, y que más importancia tuvo desde un punto de vista teórico, es el del hidrógeno. Cuando los átomos de gas hidrógeno absorben energía por medio de una descarga de alto voltaje, emiten radiaciones que dan lugar a 5 líneas en la región visible del espectro: El modelo atómico de Rutherford no podía explicar estas emisiones discretas de radiación por los átomos. Además presentaba el inconveniente de ser inestable: Según la física clásica una carga en movimiento emite continuamente energía por lo que los electrones radiarían energía continuamente hasta "caer" en el núcleo, con lo que el átomo se destruiría. MODELO ATOMICO DE BOHR En 1913 Bohr publicó una explicación teórica para el espectro atómico del hidrógeno. Basándose en las ideas previas de Max Plank, que en 1900 había elaborado una teoría sobre la discontinuidad de la energía (Teoría de los cuantos), Bohr supuso que el átomo solo puede tener ciertos niveles de energía definidos. Bohr establece así, que los electrones solo pueden girar en ciertas órbitas de radios determinados. Estas órbitas son estacionarias, en ellas el electrón no emite energía: la energía cinética del electrón equilibra exactamente la atracción electrostática entre las cargas opuestas de núcleo y electrón. El electrón solo puede tomar así los valores de energía correspondientes a esas órbitas. Los saltos de los electrones desde niveles de mayor energía a otros de menor energía o viceversa suponen, respectivamente, una emisión o una absorción de energía electromagnética (fotones de luz). Sin embargo el modelo atómico de Bohr también tuvo que ser abandonado al no poder explicar los espectros de átomos más complejos. La idea de que los electrones se mueven alrededor del núcleo en órbitas definidas tuvo que ser desechada. Las nuevas ideas sobre el átomo están basadas en la mecánica cuántica, que el propio Bohr contribuyó a desarrollar. ESTRUCTURA DEL ÁTOMO En el átomo distinguimos dos partes: el núcleo y la corteza. - El núcleo es la parte central del átomo y contiene partículas con carga positiva, los protones, y partículas que no poseen carga eléctrica, es decir son neutras, los neutrones. La masa de un protón es aproximadamente igual a la de un neutrón. 6 Todos los átomos de un elemento químico tienen en el núcleo el mismo número de protones. Este número, que caracteriza a cada elemento y lo distingue de los demás, es el número atómico y se representa con la letra Z. - La corteza es la parte exterior del átomo. En ella se encuentran los electrones, con carga negativa. Éstos, ordenados en distintos niveles, giran alrededor del núcleo. La masa de un electrón es unas 2000 veces menor que la de un protón. Los átomos son eléctricamente neutros, debido a que tienen igual número de protones que de electrones. Así, el número atómico también coincide con el número de electrones. ISÓTOPOS La suma del número de protones y el número de neutrones de un átomo recibe el nombre de número másico y se representa con la letra A. Aunque todos los átomos de un mismo elemento se caracterizan por tener el mismo número atómico, pueden tener distinto número de neutrones. Llamamos isótopos a las formas atómicas de un mismo elemento que se diferencian en su número másico. Para representar un isótopo, hay que indicar el número másico (A) propio del isótopo y el número atómico (Z), colocados como índice y subíndice, respectivamente, a la izquierda del símbolo del elemento. Z 23 A X ( Na) 11 ISÓBAROS: Por otro lado, si dos núcleos tienen distinto número de protones, pero igual nuemro másico, pertenecen a distintos elementos y se denominan isóbaros Actividades: 1. Los átomos de un mismo elemento químico tienen todos en su núcleo el mismo número de 2. Un átomo tiene 12 protones, 13 neutrones y 12 electrones. ¿Cuál es su número atómico? 12; 13; 24; 25. 3. Los isótopos oxígeno-16, oxígeno-17 y oxígeno-18, se diferencian en: 1. 2. 3. 4. El número de protones El número atómico El número de neutrones El número de electrones 5. Un átomo de volframio (W) tiene 74 protones y 108 neutrones. ¿Cuál es su representación adecuada? 7 6. Señala las afirmaciones correctas: 1. 2. 3. 4. 5. El número másico de un átomo es la suma del número de protones, neutrones y electrones Todos los átomos de un mismo elemento químico tienen el mismo número de neutrones Los isótopos de un elemento químico tienen el mismo número atómico Los isótopos de un elemento químico tienen el mismo número másico Los isótopos de un elemento químico tienen distinto número de neutrones LOS CONCEPTOS DE IONES Entendemos por iones a las moléculas o átomos que se encuentran con una carga determinada. Esta puede ser positiva o negativa. Si la carga es positiva el ión se denomina catión, si es negativa, anión. Muchas sustancias pueden ser separadas en iones. A estas sustancias se las llama electrolitos. Los metales forman cationes, ya que tienen mucha tendencia a perder los electrones de su última órbita quedando cargados positivamente. Podemos citar como ejemplos a los del grupo 1 y 2 de la tabla periódica de los elementos. Según la teoría del octeto de Lewis, a los metales les es más fácil perder los electrones de la capa externa, que ganar los electrones que les falta para llegar a los 8. Por este motivo tendrán protones en exceso en el núcleo. Por ejemplo, el sodio cuyo número atómico es 11 significa que tiene 11 protones en el núcleo y 11 electrones. Como pertenece al grupo 1 tiene un solo electrón en su capa más externa. Al perderlo, queda con 11 protones y 10 electrones. O sea con 11 cargas positivas en el núcleo y 10 negativas alrededor del núcleo. Por lo tanto su carga neta será de una positiva. De esta manera otros como el calcio se cargan con 2 cargas positivas al perder 2 electrones. Los aniones lo forman átomos con tendencia a aceptar electrones, podemos citar como ejemplos a los halógenos, como el cloro, bromo, iodo. Estos son elementos del grupo 7, solo aceptan un electrón para llegar a 8 formando iones con una sola carga negativa IONES CATIONES Los iones cargados positivamente se llaman cationes. Ejemplos: H+, Ca2+, Na+, Fe3+. Indican que tienen un defecto de electrones respecto a su estado neutro. Un ion sodio (catión) se forma de la siguiente manera: Na (1s 2, 2s2p6, 3s1) - 1e- --> Na+ (1s2, 2s2p6). Para nombrar estos iones positivos o cationes, basta anteponer la palabra ion, o más concretamente catión, al nombre del elemento. Si éste puede adoptar varios estados de oxidación, se recomienda utilizar la notación de Stock. CATIÓN SISTEMÁTICA TRADICIONAL K catión(ion) potasio ion potasio Ca2+ catión calcio ion calcio Fe3+ catión hierro (III) ion férrico catión níquel (II) ion niqueloso (NH3 + H+) ion amonio + 2+ Ni cationes poliatómicos NH4+ PH4+ + (PH3 + H ) ion fosfonio AsH4+ (AsH3 + H+) ion arsonio H3O+ (H2O + H+) ion oxonio ANIONES 8 Los iones cargados negativamente se llaman aniones. Ejemplos: F-, S2-, NO31-, SO42-. Los aniones poseen un exceso de electrones respecto a su estado neutro, según indica la carga de cada ion. Los aniones monoatómicos se nombran utilizando el sufijo -uro, como indicábamos en los compuestos binarios del hidrógeno. H2O - 1H+ ---> OH- ion hidróxido HNO3- 1H+ ---> NO31- ion nitrato ; [ion trioxonitrato (V)] H2SO4- 2H+ ---> SO42- ion tetraoxosulfato (VI) ; [ion sulfato] Estos iones se nombran, según la IUPAC, en la nomenclatura sistemática, pero también está aceptada y se emplea mucho más la tradicional, basada en las terminaciones ito, ato, según que el ácido de procedencia termine en oso o ico, respectivamente. Los prefijos hipo y per se conservan. FÓRMULA ÁCIDO PROCEDENCIA NOMBRE ION H2SO4 ácido sulfúrico SO42- ion tetraoxosulfato (VI) H2SO3 ácido sulfuroso SO32- ion sulfito ácido nitroso NO21- ion dioxonitrato (III) ácido carbónico CO32- ion trioxocarbonato (IV) HNO2 H2CO3 HClO HClO3 ION - ClO SO4 2- ClO3 SO3 1- 2- BrO31SeO4 2- 1- ácido hipocloroso ClO ácido clórico ClO3 1- ion hipoclorito ion clorato SISTEMÁTICA TRADICIONAL ion oxoclorato (I) ion hipoclorito ion tetraoxosulfato (VI) ion sulfato ion trioxoclorato (V) ion clorato ion trioxosulfato (IV) ion sulfito ion trioxobromato (V) ion bromato ion tetraoxoseleniato (VI) ion seleniato S2O72- ion heptaoxodisulfato (VI) ion disulfato MnO41- ion tetraoxomanganato (VII) ion permanganato Cr2O72- ion heptaoxodicromato (VI) ion dicromato Cl1- ion cloruro ion cloruro ion sulfuro ion sulfuro ion trioxosulfato (IV) ion sulfito S2SO3 2- Cuando un ácido tiene varios hidrógenos en su molécula puede formar varios aniones según pierda uno o varios hidrógenos. Para nombrarlos se colocan los prefijos hidrógeno, dihidrógeno, trihidrógeno, etc., según queden en el ion uno, dos, tres, etc. átomos de hidrógeno (N. sistemática). H2SO4 HSO41- ion bisulfato ion hidrogenosulfato H3PO4 HPO42- --- ion hidrogenofosfato H3PO4 H2PO42- --- ion dihidrogenofosfato

