ELEMENTO Y ESTRUCTURA ATÓMICA SÍMBOLOS QUÍMICOS
Anuncio
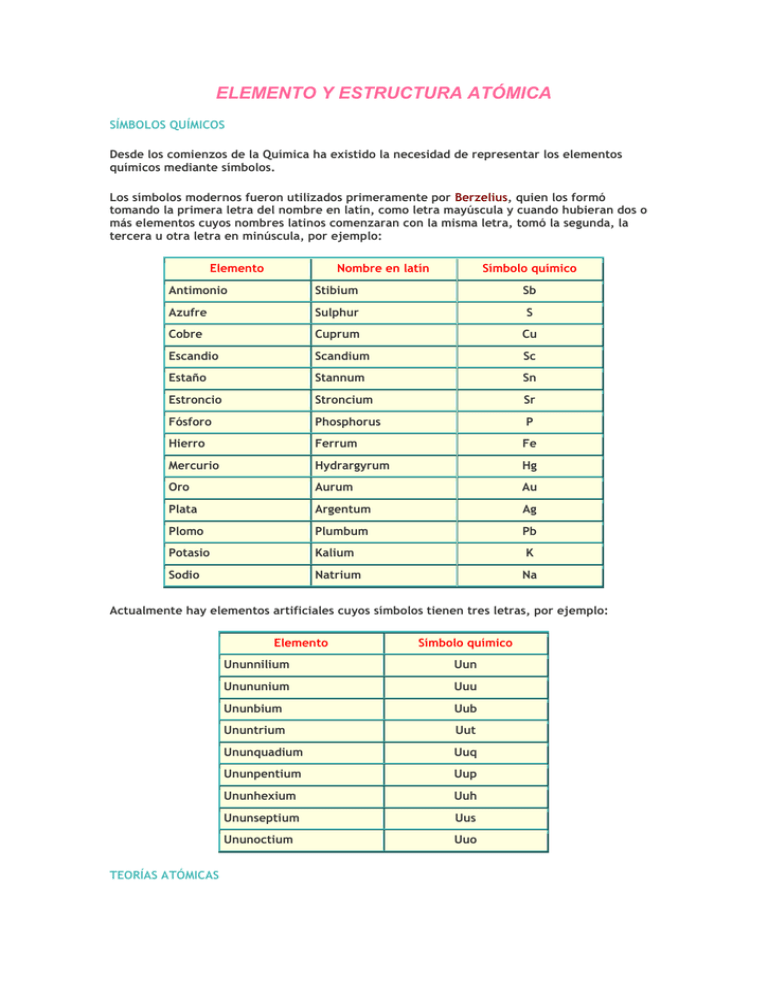
ELEMENTO Y ESTRUCTURA ATÓMICA SÍMBOLOS QUÍMICOS Desde los comienzos de la Química ha existido la necesidad de representar los elementos químicos mediante símbolos. Los símbolos modernos fueron utilizados primeramente por Berzelius, quien los formó tomando la primera letra del nombre en latín, como letra mayúscula y cuando hubieran dos o más elementos cuyos nombres latinos comenzaran con la misma letra, tomó la segunda, la tercera u otra letra en minúscula, por ejemplo: Elemento Nombre en latín Símbolo químico Antimonio Stibium Sb Azufre Sulphur S Cobre Cuprum Cu Escandio Scandium Sc Estaño Stannum Sn Estroncio Stroncium Sr Fósforo Phosphorus P Hierro Ferrum Fe Mercurio Hydrargyrum Hg Oro Aurum Au Plata Argentum Ag Plomo Plumbum Pb Potasio Kalium K Sodio Natrium Na Actualmente hay elementos artificiales cuyos símbolos tienen tres letras, por ejemplo: Elemento TEORÍAS ATÓMICAS Símbolo químico Ununnilium Uun Unununium Uuu Ununbium Uub Ununtrium Uut Ununquadium Uuq Ununpentium Uup Ununhexium Uuh Ununseptium Uus Ununoctium Uuo Los griegos El concepto de átomo nació con los griegos Leucipo y su discípulo Demócrito ( siglos V a IV a. C. ), quienes decían que cada cosa puede dividirse hasta un cierto límite, que llamaron átomo ( sin división ). Otro filósofo griego, Empédocles afirmó que existían 4 elementos, agua, aire, fuego y tierra. Aristóteles, posteriormente, agregó un quinto elemento, éter, a esta otra visión de la materia. Dalton Dalton, en 1803, desarrolló la primera teoría atómica que explicaba satisfactoriamente las leyes químicas enunciadas hasta ese momento. Esta teoría puede resumirse en: 1 ) Todos los elementos están constituidos por átomos, consistentes en partículas materiales separadas e indestructibles. 2 ) Todos los átomos de un mismo elemento son iguales en masa y en las demás propiedades. 3 ) Los átomos de elementos distintos son diferentes en masa y en las demás propiedades. 4 ) Los compuestos se forman por la unión de átomos de los correspondientes elementos en una relación numérica sencilla. Thomson Thomson, en 1898, postuló que el átomo está constituido por una esfera de carga eléctrica positiva, en la cual están incrustadas partículas de carga eléctrica negativa, que neutralizan dicha carga. Esto explicaba el hecho de que cuando se hacía pasar corriente eléctrica con un elevado voltaje, en un tubo de descarga, a baja presión, se observaba luminiscencia en el gas contenido. Esto lo provocaban haces eléctricos que iban del cátodo al ánodo, llamados rayos catódicos, de carga eléctrica negativa. A las partículas elementales constituyentes de esos rayos se les llamó electrones ( e – ). Posteriormente, Goldstein en 1886, demostró la existencia de rayos positivos, los cuales son diferentes para distintos gases introducidos en los tubos de descarga. A los constituyentes elementales de dichos rayos, cuando se utilizaba hidrógeno, se les llamó protones ( p + ). Rutherford Para comprobar la veracidad del modelo atómico de Thomson, Lord Rutherford, en 1911, realizó experimentos que consistieron en “bombardear” delgadas láminas metálicas de oro con partículas alfa ( ). A pesar de que éstas poseen carga eléctrica positiva, por su gran energía no tendrían mayor inconveniente en atravesar la lámina, porque se suponía que la carga eléctrica positiva estaría uniformemente repartida. La mayoría de las partículas atravesaron la lámina en línea recta, pero hubo algunas que se desviaron bastante de su trayectoria e incluso un pequeño porcentaje “rebotó” en la lámina. Esto sólo podía explicarse suponiendo que el átomo era en su mayor parte “vacío” y que prácticamente toda la masa se encontrara concentrada en un núcleo atómico, responsable de la carga eléctrica positiva, y los electrones estuvieran girando alrededor de él a distancias relativamente grandes. Bohr Pero el modelo atómico de Rutherford era contradictorio con las leyes del electromagnetismo, porque el electrón al girar alrededor del núcleo emitiría energía radiante, lo cual traería como consecuencia un acercamiento cada vez mayor del electrón al núcleo hasta chocar con él. Para superar esta dificultad, Niels Bohr propuso en 1913 la siguiente teoría atómica: 1 ) Cualquiera sea la órbita descrita por el electrón, éste no emite energía radiante. 2 ) Solamente algunas órbitas son permitidas. 3 ) Cuando un electrón pasa a una órbita más cercana al núcleo, emite energía radiante y para pasar a una órbita más lejana, debe absorber energía radiante. Sommerfeld, en 1916 propuso que el electrón no solamente describe órbitas circulares, sino que también elípticas. Modelo cuántico La teoría atómica de Bohr-Sommerfeld explica la no-destrucción del átomo y otros fenómenos, pero nuevos hechos trajeron como consecuencia una visión más completa y compleja del átomo. De Broglie en 1924, estableció que las partículas atómicas tenían carácter ondulatorio. Heisenberg en 1927, formuló el principio de incertidumbre o indeterminación, según el cual es imposible determinar simultáneamente la posición y velocidad de una partícula con absoluta precisión. Con esto, no se puede hablar de trayectoria de un electrón, sino más bien, de la probabilidad de encontrarlo en una región vecina al núcleo. Finalmente el descubrimiento del neutrón en 1932, hace más completa la visión del núcleo atómico. Esta partícula no posee carga eléctrica. Para concluir, se dice que el átomo está constituido por un núcleo de carga eléctrica positiva, conformado por protones ( eléctricamente positivos ) y neutrones ( eléctricamente neutros ). Y alrededor de ese núcleo existe una “nube”, eléctricamente negativa, compuesta por electrones. El diámetro del átomo es del orden de 10 –8 [ cm ]. ESTRUCTURA NUCLEAR Núcleo atómico El núcleo atómico es el constituyente central del átomo y posee casi la totalidad de la masa de éste. Diámetro: del orden de 10 – 13 Densidad: del orden de 10 14 Carga eléctrica: positiva, del orden de 10 – 19 a 10 Masa: del orden de 10 – 22 [g] – 24 a 10 – 12 [ cm ] [ g / ml ] a 10 – 17 [C] Observación: Para tener una idea aproximada de la relación de tamaños entre átomo y su núcleo, se puede afirmar que si el átomo tuviera un diámetro aproximado de 100 [ m ] , su núcleo tendría un diámetro aproximado de 1 [ mm ]. A pesar de que hay diversas teorías sobre la estructura nuclear, se puede considerar que el núcleo atómico está conformado por partículas elementales: protones y neutrones. Ambas reciben el nombre de nucleones. En la figura 4 se tiene una representación del modelo de núcleo atómico: Protón ( p + ) El protón es una partícula elemental cuya masa en reposo es 1,673 × 10 – 27 [ kg ]. Posee carga eléctrica positiva de +1,602 × 10 – 19 [ C ]. Es el causante de la carga eléctrica del núcleo. Neutrón ( n º ) El neutrón es una partícula elemental cuya masa en reposo es 1,675 × 10 carga eléctrica. – 27 [ kg ]. No posee El número de estas partículas identifica al átomo de un elemento, para lo cual se han definido los siguientes dos números: Número atómico ( Z ) El número atómico de un átomo es el número de protones que posee en su núcleo. Número másico o de masa ( A ) El número másico de un átomo es el número de protones y neutrones que posee en su núcleo. Ejemplo: El átomo más abundante de litio posee en su núcleo 3 protones y 4 neutrones, por lo tanto su número atómico es 3 ( Z = 3 ) y su número másico es 7 ( A = 7 ). Simbólicamente se representa así: En un átomo eléctricamente neutro, el número de protones y de electrones es el mismo, por lo tanto en el ejemplo anterior el número de electrones es 3. Todos los átomos de un mismo elemento poseen el mismo número de protones, pero el de neutrones generalmente varía. Esto nos conduce a los conceptos de isótopos e isóbaros. Isótopos Los isótopos son átomos de un mismo elemento que poseen distinto número de neutrones, es decir igual Z , pero distinto A. Ejemplo: Isóbaros Los isóbaros son átomos de distintos elementos que tienen igual número másico, es decir distinto Z, pero igual A. Ejemplo: Masa atómica relativa Para los cálculos químicos es necesario asignarle una masa atómica a cada elemento. Debido a la existencia de isótopos, esta masa es un promedio donde la masa de cada isótopo se pondera según su porcentaje de abundancia. Se mide en unidades de masa atómica ( uma ). 1 [ uma ] es 1 / 12 de la masa del isótopo de carbono – 12 , al cual se le asigna una masa de 12 [ uma ]. Ejemplo: Los isótopos más abundantes del Cloro son Cl 35 ( 75 % ) y Cl 37 ( 25 % ) , entonces: masa atómica del Cl = 35 [ uma ] × 0,75 + 37 [ uma ] × 0,25 = 35,5 [ uma ] Observación: 1 [ uma ] = 1,66 × 10 – 24 [g]