COLORACIÓN A LA LLAMA Práctica No. 2
Anuncio

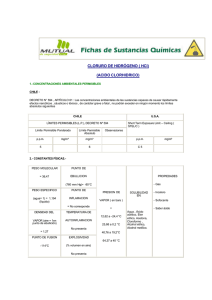
Laboratorio de Química. Química I COLORACIÓN A LA LLAMA Práctica No. 2 COMPETENCIA A DESARROLLAR. Relaciona el modelo atómico de Bohr con la coloración de la llama característica al quemar sales de diversos metales. FUNDAMENTO. ° Investiga qué es un espectro de emisión y a qué se debe. ° Escribe las características del modelo de Bohr. ° Anota las características generales de los metales. EXPERIMENTACIÓN. MATERIAL. Por equipo: 1 Mechero Bunsen. 1 1 Lápiz HB (u otro de punta de grafito).* Exacto o cuter.* 1 Encendedor o cerillos. Por grupo: 1 Gradilla metálica. 8 Tubos de ensaye. 7 Cucharillas metálicas. 1 Pipeta de 10 ml. SUSTANCIAS. Por grupo: 5 ml Ácido Clorhídrico (HCl). 5g Cloruro de Estroncio (SrCl2). 5g 5g 5g 5g 5g 5g 5g Cloruro de Cobalto II (CoCl2). Cloruro de Bario (BaCl2). Cloruro de Calcio (CaCl2). Cloruro de Sodio (NaCl). Cloruro de Cobre II (CuCl2). Cloruro de Potasio (KCl). Cloruro de Estroncio (SrCl2). Nota: Todas las sustancias y material señalados con asterisco (*) deberán ser proporcionadas por los alumnos. TÉCNICA EXPERIMENTAL. 1. Sumergir la punta del lápiz en ácido clorhídrico 2. Introducir el lápiz mojado en la sal y ponerla a la flama 3. Observar el color y registrarlo. 4. Enjuagar el lápiz con agua y posteriormente con el ácido 5. Repetir el procedimiento con cada sal y registrar el color de cada metal. CONCLUSIONES. 1. ¿En qué aplicación se utiliza el color característico de los metales? 2. ¿Cómo explicó Bohr el color que adquiere la llama al quemar las sales? 3. ¿En qué parte de la tabla periódica se localizan los metales? 4. ¿Qué objetivo tiene el ácido clorhídrico en la práctica? 5. ¿Por qué la sal de cobre da dos tonos diferentes en la llama? BIBLIOGRAFÍA. ° Reporta la bibliografía de los libros, revistas, láminas, etc., empleados en la investigación de esta práctica. MVZ Ariadna Arango MVZ Erika Olivares G.