Preparar disoluciones de sulfato de cobre y hidróxido de sodio (el
Anuncio
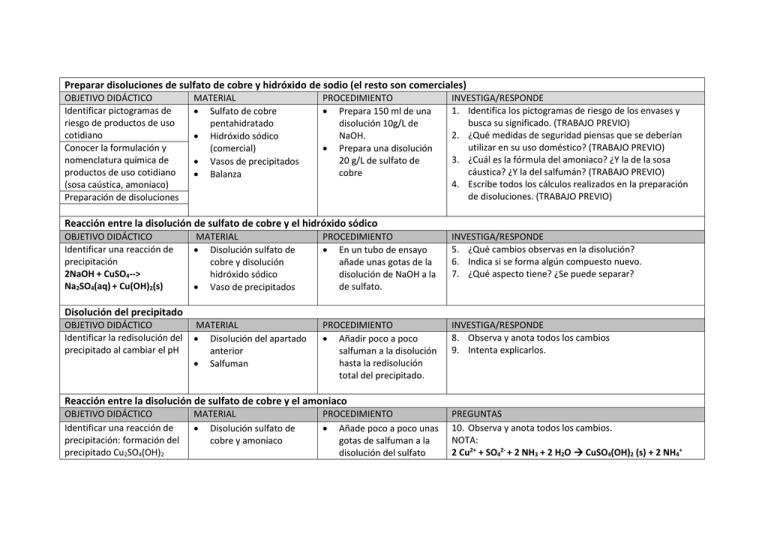
Preparar disoluciones de sulfato de cobre y hidróxido de sodio (el resto son comerciales) OBJETIVO DIDÁCTICO Identificar pictogramas de riesgo de productos de uso cotidiano Conocer la formulación y nomenclatura química de productos de uso cotidiano (sosa caústica, amoniaco) Preparación de disoluciones MATERIAL Sulfato de cobre pentahidratado Hidróxido sódico (comercial) Vasos de precipitados Balanza PROCEDIMIENTO Prepara 150 ml de una disolución 10g/L de NaOH. Prepara una disolución 20 g/L de sulfato de cobre INVESTIGA/RESPONDE 1. Identifica los pictogramas de riesgo de los envases y busca su significado. (TRABAJO PREVIO) 2. ¿Qué medidas de seguridad piensas que se deberían utilizar en su uso doméstico? (TRABAJO PREVIO) 3. ¿Cuál es la fórmula del amoniaco? ¿Y la de la sosa cáustica? ¿Y la del salfumán? (TRABAJO PREVIO) 4. Escribe todos los cálculos realizados en la preparación de disoluciones. (TRABAJO PREVIO) Reacción entre la disolución de sulfato de cobre y el hidróxido sódico OBJETIVO DIDÁCTICO Identificar una reacción de precipitación 2NaOH + CuSO4--> Na2SO4(aq) + Cu(OH)2(s) MATERIAL Disolución sulfato de cobre y disolución hidróxido sódico Vaso de precipitados PROCEDIMIENTO En un tubo de ensayo añade unas gotas de la disolución de NaOH a la de sulfato. INVESTIGA/RESPONDE 5. ¿Qué cambios observas en la disolución? 6. Indica si se forma algún compuesto nuevo. 7. ¿Qué aspecto tiene? ¿Se puede separar? MATERIAL Disolución del apartado anterior Salfuman PROCEDIMIENTO Añadir poco a poco salfuman a la disolución hasta la redisolución total del precipitado. INVESTIGA/RESPONDE 8. Observa y anota todos los cambios 9. Intenta explicarlos. Disolución del precipitado OBJETIVO DIDÁCTICO Identificar la redisolución del precipitado al cambiar el pH Reacción entre la disolución de sulfato de cobre y el amoniaco OBJETIVO DIDÁCTICO Identificar una reacción de precipitación: formación del precipitado Cu2SO4(OH)2 MATERIAL Disolución sulfato de cobre y amoniaco PROCEDIMIENTO Añade poco a poco unas gotas de salfuman a la disolución del sulfato PREGUNTAS 10. Observa y anota todos los cambios. NOTA: 2 Cu2+ + SO42- + 2 NH3 + 2 H2O CuSO4(OH)2 (s) + 2 NH4+ Reacción entre la disolución de sulfato de cobre y el amoniaco en exceso OBJETIVO DIDÁCTICO Identificar la reacción de formación del complejo MATERIAL Disolución del apartado anterior y amoniaco (en exceso) PROCEDIMIENTO Añadir más amoniaco a la disolución anterior PREGUNTAS 11. ¿Qué cambios observas en la disolución? NOTA: CuSO4(OH)2 (s) + 8 NH3 2 Cu(NH3)42+ + SO42- + 2 OH- PROCEDIMIENTO Sumergir el clavo en la disolución. PREGUNTAS 12. Anota todos los cambios observados. 13. Formula y ajusta la reacción NOTA: Cu2+ + Fe(s) Cu (s) + Fe2+ Reacción redox entre el sulfato de cobre y el hierro OBJETIVO DIDÁCTICO Identificar una reacción redox entre el cobre y el hierro MATERIAL Disolución de sulfato de cobre y clavos de hierro Reacción de disolución de la moneda Cu + H2O2 + 2 H+ Cu2+ + 2 H2O NOTA: los alumnos no saben que la moneda lleva cobre (ver presentación), al final del proceso de disolución de la moneda, deben identificar la presencia del Cu2+, por el color final de la misma. A posteriori se pueden realizar con esta disolución el resto de ensayos descritos anteriormente para identificar el cobre. Recomiendo hacerlas al cabo de unas horas para que se consuma todo el agua oxigenada.
