TEKS CHEM 8E - Pearson Online Learning Exchange
Anuncio
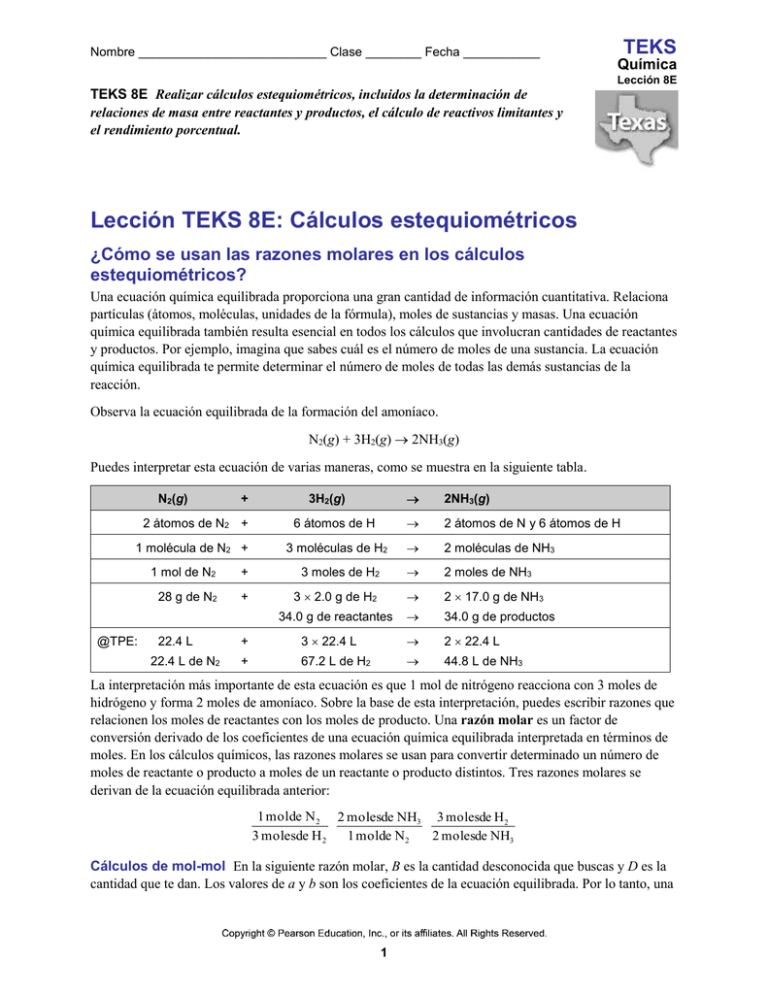
Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E TEKS 8E Realizar cálculos estequiométricos, incluidos la determinación de relaciones de masa entre reactantes y productos, el cálculo de reactivos limitantes y el rendimiento porcentual. Lección TEKS 8E: Cálculos estequiométricos ¿Cómo se usan las razones molares en los cálculos estequiométricos? Una ecuación química equilibrada proporciona una gran cantidad de información cuantitativa. Relaciona partículas (átomos, moléculas, unidades de la fórmula), moles de sustancias y masas. Una ecuación química equilibrada también resulta esencial en todos los cálculos que involucran cantidades de reactantes y productos. Por ejemplo, imagina que sabes cuál es el número de moles de una sustancia. La ecuación química equilibrada te permite determinar el número de moles de todas las demás sustancias de la reacción. Observa la ecuación equilibrada de la formación del amoníaco. N2(g) + 3H2(g) 2NH3(g) Puedes interpretar esta ecuación de varias maneras, como se muestra en la siguiente tabla. N2(g) + 2 átomos de N2 + 1 molécula de N2 + @TPE: 2NH3(g) 6 átomos de H 2 átomos de N y 6 átomos de H 3 moléculas de H2 2 moléculas de NH3 3H2(g) 1 mol de N2 + 3 moles de H2 2 moles de NH3 28 g de N2 + 3 2.0 g de H2 2 17.0 g de NH3 34.0 g de reactantes 34.0 g de productos 22.4 L 22.4 L de N2 + 3 22.4 L 2 22.4 L + 67.2 L de H2 44.8 L de NH3 La interpretación más importante de esta ecuación es que 1 mol de nitrógeno reacciona con 3 moles de hidrógeno y forma 2 moles de amoníaco. Sobre la base de esta interpretación, puedes escribir razones que relacionen los moles de reactantes con los moles de producto. Una razón molar es un factor de conversión derivado de los coeficientes de una ecuación química equilibrada interpretada en términos de moles. En los cálculos químicos, las razones molares se usan para convertir determinado un número de moles de reactante o producto a moles de un reactante o producto distintos. Tres razones molares se derivan de la ecuación equilibrada anterior: 1 mol de N 2 2 molesde NH3 3 molesde H 2 3 molesde H 2 1 molde N 2 2 molesde NH3 Cálculos de mol-mol En la siguiente razón molar, B es la cantidad desconocida que buscas y D es la cantidad que te dan. Los valores de a y b son los coeficientes de la ecuación equilibrada. Por lo tanto, una 1 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E solución general para un problema de mol-mol como el siguiente problema de ejemplo se da de esta manera: Problema de ejemplo: calcular los moles de un producto ¿Cuántos moles de NH3 se forman cuando 0.60 moles de nitrógeno reaccionan con hidrógeno? 1. Analizar Enumera los datos y la incógnita. La conversión es moles de N2 moles de NH3. Recuerda la ecuación equilibrada de la formación del amoníaco: N2(g) + 3H2(g) 2NH3(g) De acuerdo con la ecuación equilibrada, 1 mol de N2 se combina con 3 moles de H2 y forma 2 moles de NH3. Para determinar el número de moles de NH3, la cantidad de N2 que te dan se multiplica por la forma de la razón molar de la ecuación equilibrada que permite que se simplifiquen las unidades dadas. Datos • moles de nitrógeno = 0.60 moles de N2 Incógnita • moles de amoníaco = ? moles de NH3 2. Calcular Halla el valor de la incógnita. Escribe la razón molar que te permitirá convertir moles de N2 a moles de NH3. 2 molesde NH3 1 molde N 2 Multiplica la cantidad de N2 que te dan por la razón molar para hallar los moles de NH3. 0.60 molesde N 2 2 molesde NH3 1.2 molesde NH3 1 molde N 2 3. Evaluar ¿Tiene sentido el resultado? La razón de 1.2 moles de NH3 a 0.60 moles de N2 es 2:1, como predijo la ecuación equilibrada. 2 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Cálculos de masa-masa Ninguna balanza de laboratorio puede medir sustancias directamente en moles. En lugar de eso, la cantidad de una sustancia generalmente se determina midiendo su masa en gramos. A partir de la masa de un reactante o un producto, se puede calcular la masa de cualquier otro reactante o producto de una ecuación química determinada. La interpretación molar de la ecuación equilibrada es la base de esta conversión. Si la muestra se mide en gramos, entonces la masa se puede convertir a moles usando la masa molar. Luego la razón molar de la ecuación equilibrada se puede usar para calcular el número de moles de la incógnita. Si lo que se debe determinar es la masa de la incógnita, se puede multiplicar el número de moles de la incógnita por la masa molar. Al igual que en los cálculos mol-mol, la incógnita puede ser un reactante o un producto. Pasos para resolver un problema de masa-masa Los problemas de masa-masa se resuelven básicamente de la misma manera que los problemas de mol-mol. Los pasos para la conversión de cualquier masa dada (D) a cualquier masa que buscas (B) se detallan a continuación. 1. Cambia la masa de D a moles de D (masa de D moles de D) usando la masa molar de D. 1 mol de D masa de D moles de D masa molar de D 2. Cambia los moles de D a moles de B (moles de D moles de B) usando la razón molar de la ecuación equilibrada. b moles de B moles de D moles de B a moles de D 3. Cambia los moles de B a gramos de B (moles de B masa de B) usando la masa molar de B. moles de B masa molar de B masa de B 1 mol de B El siguiente diagrama muestra otra manera de representar los pasos para realizar cálculos estequiométricos de mol-masa y masa-mol. En un problema de mol-masa, la primera conversión (de masa a moles) se saltea. En un problema de masa-mol, la última conversión (de moles a masa) se saltea. Puedes usar partes del proceso de tres pasos que se muestra a continuación si resultan adecuadas al problema que estás resolviendo. 3 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Problema de ejemplo: calcular la masa de un producto Calcula el número de gramos de NH3 formados por la reacción de 5.40 g de hidrógeno con un exceso de nitrógeno. La ecuación equilibrada es la siguiente: N2(g) + 3H2(g) 2NH3(g) 1. Analizar Enumera los datos y la incógnita. Usarás la masa del hidrógeno para hallar la masa del amoníaco: g de H2 g de NH3. Los coeficientes de la ecuación equilibrada muestran que 3 moles de H2 reaccionan con 1 mol de N2 y forman 2 moles de NH3. Los siguientes pasos son necesarios para determinar la masa del amoníaco: g de H2 moles de H2 moles de NH3 g de NH3 Datos • masa del hidrógeno = 5.40 g de H2 • 2 moles de NH3/3 moles de H2 (de la ecuación equilibrada) • 1 mol de H2 = 2.0 g de H2 (masa molar) • 1 mol de NH3 = 17.0 g de NH3 (masa molar) Incógnita • masa del amoníaco = ? g de NH3 2. Calcular Halla el valor de la incógnita. Comienza con la cantidad que te dan y convierte de masa a moles. 5.40 g de H 2 1 molde H 2 2.0 g de H 2 Luego convierte de moles de reactante a moles de producto usando la razón molar correcta. 5.40 g de H 2 1 molde H 2 2 molesde NH3 2.0 g de H 2 3 molesde H 2 Concluye convirtiendo de moles de producto a masa de producto usando la masa molar del NH3. 5.40 g de H 2 1 molde H 2 2 molesde NH3 17.0g de NH3 31g de NH3 2.0 g de H 2 3 molesde H 2 1 molde NH3 g de H2 moles de H2 moles de NH3 g de NH3 3. Evaluar ¿Tiene sentido el resultado? Como en esta solución están involucrados tres factores de conversión, es más difícil estimar una respuesta. Sin embargo, como la masa molar del NH3 es sustancialmente mayor que la masa molar del H2, la respuesta debe tener una masa mayor que la masa dada. La masa debe tener dos cifras significativas. 4 Nombre ___________________________ Clase ________ Fecha ___________ ¿Cuál es el procedimiento general para resolver un problema estequiométrico? TEKS Química Lección 8E Como ya sabes, puedes obtener razones molares a partir de una ecuación química equilibrada. A partir de las razones molares, puedes calcular cualquier unidad de medida que esté relacionada con el mol. La cantidad dada se puede expresar en número de partículas representativas, unidades de masa o volúmenes de gases a TPE. Los problemas pueden incluir cálculos de masa-volumen, partícula-masa y volumen-volumen. En un problema típico de estequiometría, la cantidad que te dan se convierte primero a moles. Luego, la razón molar de la ecuación equilibrada se usa para calcular el número de moles de la sustancia que buscas. Finalmente, los moles se convierten a cualquier otra unidad de medida relacionada con la unidad molar, según lo que el problema pida. Hasta el momento, has aprendido cómo usar la relación entre moles y masa (1 mol = masa molar) para resolver problemas estequiométricos de masa-masa, masa-mol y mol-masa. La relación mol-masa te da dos factores de conversión. masa molar 1 mol y 1 mol masa molar Recuerda que el mol también puede estar relacionado con otras cantidades. Por ejemplo, 1 mol = 6.02 × 1023 partículas representativas y 1 mol de un gas = 22.4 L a TPE. Estas dos relaciones proporcionan cuatro factores de conversión adicionales que puedes usar en los cálculos estequiométricos. 23 1 mol y 6.02 10 partículas 23 1 mol 6.02 10 partículas 1 mol y 22.4 L 22.4 L 1 mol En la siguiente figura se resumen los pasos de un problema estequiométrico típico. Observa que las unidades de la cantidad que te dan no serán necesariamente iguales a las unidades de la cantidad que buscas. Por ejemplo, dada la masa de D, te podrían pedir que calcules el volumen de B a TPE. 5 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Problema de ejemplo: calcular moléculas de un producto ¿Cuántas moléculas de oxígeno se forman cuando se descomponen 29.2 g de agua por electrólisis de acuerdo con esta ecuación equilibrada? ad 2H2O(l ) electricid 2H2 ( g ) + O2 ( g ) 1. Analizar Enumera los datos y la incógnita. Se deben realizar los siguientes cálculos: g de H2O moles de H2O moles de O2 moléculas de O2 La razón molar apropiada que relaciona moles de O2 con moles de H2O de la ecuación equilibrada es 1 mol de O2/2 moles de H2O. Datos • masa del agua = 29.2 g de H2O • 1 mol de O2/2 moles de H2O (de la ecuación equilibrada) • 1 mol de H2O = 18.0 g de H2O (masa molar) • 1 mol de O2 = 6.02 × 1023 moléculas de O2 Incógnita • moléculas de oxígeno = ? moléculas de O2 2. Calcular Halla el valor de la incógnita. Comienza con la cantidad que te dan y convierte de masa a moles. 29.2 g de H 2O 1 molde H 2O 18.0g de H 2O Luego, convierte de moles de reactante a moles de producto. 29.2 g de H 2O 1 molde H 2O 1 molde O2 18.0g de H 2O 2 molesde H 2O Concluye convirtiendo de moles a moléculas. 29.2 g de H2O 1 molde H2O 1 molde O2 6.021023 moléculasde O2 4.881023 moléculasde O2 18.0g de H2O 2 molesde H2O 1 molde O2 g de H2O moles de H2O moles de O2 moléculas de O2 3. Evaluar ¿Tiene sentido el resultado? La masa del agua que te dieron debería formar un poco menos que 1 mol de oxígeno, es decir, un poco menos que el número de Avogadro de moléculas. La respuesta debe tener tres cifras significativas. 6 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E ¿Cómo se determinan los reactivos limitantes? Muchos cocineros siguen una receta cuando preparan un plato nuevo. Saben que deben contar con la cantidad suficiente de todos los ingredientes para poder seguir la receta. Imagina, por ejemplo, que estás preparando tacos. Dispones de una cantidad más que suficiente de carne, queso, lechuga, tomates y salsa. Sin embargo, sólo tienes dos tortillas. En este caso, la cantidad de tortillas que tienes limitará la cantidad de tacos que puedes preparar. Por lo tanto, las tortillas son el ingrediente limitante de esta aventura gastronómica. Un químico muchas veces se enfrenta a una situación similar. En una reacción química, una cantidad insuficiente de cualquiera de los reactantes limitará la cantidad de producto que se forme. Como sabes, una ecuación química equilibrada es la receta del químico. Puedes interpretar la receta a escala microscópica (partículas que interaccionan) o a escala macroscópica (moles que interaccionan). Los coeficientes que se usan para escribir la ecuación equilibrada indican tanto la razón de partículas representativas como la razón molar. Recuerda la ecuación para preparar amoníaco. N2(g) + 3H2(g) 2NH3(g) Cuando una molécula (un mol) de N2 reacciona con tres moléculas (moles) de H2, se forman dos moléculas (moles) de NH3. ¿Qué sucedería si dos moléculas (moles) de N2 reaccionaran con tres moléculas (moles) de H2? ¿Se formarían más de dos moléculas (moles) de NH3? La siguiente tabla muestra las interpretaciones tanto de las partículas como de los moles de este problema. Ecuaciones químicas N2(g) + 3H2(g) 2NH3(g) Receta microscópica: 1 molécula de N2 + 3 moléculas de H2 2 moléculas de NH3 Receta macroscópica: 1 mol de N2 + 3 moles de H2 7 2 moles de NH3 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Antes de que tenga lugar la reacción, el nitrógeno y el hidrógeno están presentes en una razón molecular (mol) de 2:3. La reacción se produce de acuerdo con la ecuación equilibrada. Una molécula (mol) de N2 reacciona con tres moléculas (moles) de H2 y forma dos moléculas (moles) de NH3. En este punto, todo el hidrógeno se ha consumido y la reacción se detiene. Queda una molécula (mol) de nitrógeno sin reaccionar además de las dos moléculas (moles) de NH3 que se han formado en la reacción. En esta reacción, solo el hidrógeno se consume por completo. Este reactante es el reactivo limitante, o el reactante que determina la cantidad de producto que se puede formar mediante una reacción. La reacción se produce solamente hasta que el reactivo limitante se consume. Por el contrario, el reactante que no se consume por completo en una reacción se denomina reactivo en exceso. En este ejemplo, el nitrógeno es el reactivo en exceso porque parte del nitrógeno permanece sin reaccionar. En ocasiones, en los problemas de estequiometría, las cantidades de reactantes están expresadas en unidades distintas a los moles. En estos casos, el primer paso de la solución es convertir a moles la cantidad de cada reactante. Luego se puede definir el reactivo limitante. La cantidad de producto que se forma en una reacción se puede determinar a partir de la cantidad dada del reactivo limitante. Problema de ejemplo: determinar el reactivo limitante El cobre reacciona con el azufre y forma sulfuro de cobre(I) de acuerdo con la siguiente ecuación equilibrada: 2Cu(s) + S(s) Cu2S(s) ¿Cuál es el reactivo limitante cuando 80.0 g de Cu reaccionan con 25.0 g de S? 1. Analizar Enumera los datos y la incógnita. En primer lugar se debe hallar el número de moles de cada reactante. La ecuación equilibrada se usa para calcular el número de moles que se necesitan de un reactante para reaccionar con la cantidad dada del otro reactante. Datos • masa del cobre = 80.0 g Cu • masa del azufre = 25.0 g S • 1 mol de S/2 moles de Cu Incógnita • reactivo limitante = ? 2. Calcular Halla el valor de la incógnita. Comienza con uno de los reactantes y convierte de masa a moles. 80.0 g de Cu 1 molde Cu 1.26 molesde Cu 63.5g de Cu Luego convierte a moles la masa del otro reactante. 25.0 g de S 1 molde S 0.779 molesde S 32.1g de S 8 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Ahora convierte moles de Cu a los moles de S que se necesitan para reaccionar con 1.26 moles de Cu. 1.26 moles de Cu 1 mol de S 0.630 moles de S 2 moles de Cu Compara la cantidad que se necesita de azufre con la cantidad de azufre que tienes. 0.630 moles de S (cantidad necesaria para reaccionar) < 0.779 moles de S (cantidad dada) El azufre está en exceso, por lo tanto, el cobre es el reactivo limitante. 3. Evaluar ¿Tiene sentido el resultado? Como la razón dada de mol de Cu a mol de S era menor que la razón (2:1) de la ecuación equilibrada, el cobre debe ser el reactivo limitante. ¿Cómo se calcula el rendimiento porcentual? Cuando un maestro toma un examen a la clase, todos los estudiantes podrían obtener una calificación del 100 por ciento. Sin embargo, este resultado generalmente no sucede. En lugar de eso, el rendimiento de la clase generalmente está distribuido en un rango de calificaciones. La calificación de tu examen, expresada en forma de porcentaje, es una razón de dos componentes. El primer componente es la cantidad de preguntas que respondiste correctamente. El segundo es la cantidad total de preguntas. Con la calificación se compara tu rendimiento con el rendimiento que habrías alcanzado si hubieras respondido correctamente todas las preguntas. Los químicos realizan cálculos similares en el laboratorio cuando el producto de una reacción química es menor que el esperado de acuerdo con la ecuación química equilibrada. Cuando una ecuación química equilibrada se usar para calcular la cantidad de producto que se formará durante una reacción, el valor calculado representa el rendimiento teórico. El rendimiento teórico es la cantidad máxima de producto que podría formarse a partir de las cantidades dadas de reactantes. Por el contrario, la cantidad de producto que realmente se forma cuando tiene lugar la reacción en el laboratorio se llama rendimiento real. El rendimiento porcentual es la razón del rendimiento real al rendimiento teórico expresada en forma de porcentaje. Rendimient o porcentual = rendimient o real 100 % rendimient o teórico Como el rendimiento real de una reacción química por lo general es menor que el rendimiento teórico, el rendimiento porcentual por lo general es menor que el 100 por ciento. El rendimiento porcentual es una medida de la eficiencia de una reacción que tiene lugar en el laboratorio. Este rendimiento es similar a la calificación de un examen que mide la eficiencia en el aprendizaje o el promedio de bateo que mide la eficiencia al batear la pelota de béisbol. La estequiometría y la conservación de la masa establecen que rendimientos mayores que el 100 por ciento no son posibles. Sin embargo, los errores y la falta de conocimiento de un proceso pueden hacer que una reacción parezca tener un rendimiento mayor que el 100 por ciento. Por ejemplo, si se filtran aire o agua en un sistema, entonces quizás se forme más producto del esperado. Muchos factores pueden hacer que los rendimientos porcentuales sean menores que el 100 por ciento. Las reacciones no siempre llegan a completarse; cuando una reacción es incompleta, se forma menos producto que la cantidad calculada. Los reactantes impuros y algunas reacciones colaterales opuestas pueden causar la formación de productos no deseados. El rendimiento real también puede ser menor que el rendimiento 9 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E teórico debido a una pérdida de producto durante la filtración o en la transferencia entre recipientes. Adicionalmente, si los reactantes o los productos no se han medido cuidadosamente, un rendimiento porcentual de 100 por ciento es poco probable. Problema de ejemplo: calcular el rendimiento teórico de una reacción El carbonato de calcio, que se encuentra en las conchas marinas, se descompone por calentamiento. La ecuación equilibrada de esta reacción es CaCO3 (s) CaO(s) + CO2 (g) ¿Cuál es el rendimiento teórico del CaO si se calientan 24.8 g de CaCO3? 1. Analizar Enumera losdatos y la incógnita. Calcula el rendimiento teórico usando la masa del reactante. Se deben realizar los siguientes cálculos: g de CaCO3 moles de CaCO3 moles de CaO g de CaO Datos • masa del carbonato de calcio = 24.8 g de CaCO3 • 1 mol de CaO/1 mol de CaCO3 (de la ecuación equilibrada) Incógnita • rendimiento teórico = ? g de CaO 2. Calcular Halla el valor de la incógnita. Comienza con la masa del reactante y convierte a moles de reactante. 24.8 g de CaCO3 1 molde CaCO3 100.1g de CaCO3 A continuación, convierte a moles de producto usando la razón molar. 24.8 g de CaCO3 1 molde CaCO3 1 molde CaO 100.1g de CaCO3 1 molde CaCO3 Concluye convirtiendo de moles a masa del producto. 24.8 g de CaCO3 1 molde CaCO3 1 molde CaO 56.1g de CaO 13.9 g de CaO 100.1g de CaCO3 1 molde CaCO3 1 molde CaO g de CaCO3 moles de CaCO3 moles de CaO g de CaO 3. Evaluar ¿Tiene sentido el resultado? La razón molar de CaO a CaCO3 es 1:1. La razón de las masas en la reacción debe ser igual a la razón de las masas molares, que apenas es mayor que 1:2. El resultado de los cálculos muestra que la masa del CaO es un poco mayor que la mitad de la masa del CaCO3. 10 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Problema de ejemplo: calcular el rendimiento porcentual de una reacción ¿Cuál es el rendimiento porcentual si efectivamente se forman 13.1 g de CaO cuando se calientan 24.8 g de CaCO3? CaCO3 (s) CaO(s) + CO2 (g) 1. Analizar Enumera los datos y la incógnita. Usa la ecuación del rendimiento porcentual. El rendimiento teórico de este problema se calculó en el problema de ejemplo anterior. Datos • rendimiento real = 13.1 g de CaO • rendimiento teórico = 13.9 g de CaO (del problema de ejemplo anterior) Incógnita • rendimiento porcentual = ? % 2. Calcular Halla el valor de la incógnita. En la ecuación del rendimiento porcentual, sustituye rendimiento real y rendimiento teórico con los valores. rendimient o porcentual = rendimient o real 100 % rendimient o teórico rendimiento porcentual= 13.1g de CaO 100% 94.2% 13.9g de CaO 3. Evaluar ¿Tiene sentido el resultado? En este ejemplo, el rendimiento real es apenas menor que el rendimiento teórico. Por lo tanto, el rendimiento porcentual debe ser un tanto menor que el 100 por ciento. 11 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E Comprobación de la lección 1. Calcular relaciones molares entre reactantes y productos La siguiente ecuación describe la formación del óxido de aluminio, que se encuentra sobre la superficie de los objetos de aluminio expuestos al aire. 4Al(s) + 3O2(g) → 2Al2O3(s) a. Escribe las seis razones molares que pueden derivarse de esta ecuación. b. ¿Cuántos moles de aluminio se necesitan para formar 3.7 moles de Al2O3? 2. Calcular relaciones de masa entre reactantes y productos El gas acetileno (C2H2) se produce agregando agua al carburo de calcio (CaC2). CaC2(s) + 2H2O(l) C2H2(g) + Ca(OH)2(aq) ¿Cuántos gramos de acetileno se forman al agregar agua a 5.00 g de CaC2? 12 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E 3. Calcular relaciones de masa entre reactantes y productos El metal hierro (Fe) puede obtenerse a partir del mineral de hierro (Fe2O3) mediante la siguiente reacción: Fe2O3(s) + 3CO(g) 2Fe(s) + 3CO2(g) ¿Cuánto mineral de hierro se necesita para obtener 92.8 gramos de metal hierro? 4. Calcular relaciones de masa entre reactantes y productos El metanol (CH3OH) se usa en la elaboración de varios compuestos químicos. El metanol se forma haciendo reaccionar monóxido de carbono e hidrógeno a temperatura y presión elevadas. CO(g) + 2H2(g) CH3OH(g) Calcula la cantidad de gramos que se necesitan de cada reactante para formar 64.1 g de CH3OH. 5. Definir ¿Qué es un reactivo limitante? ¿Qué es un reactivo en exceso? _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ _______________________________________________________________________________ 13 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E 6. Calcular el reactivo limitante La siguiente ecuación describe la combustión completa del eteno (C2H4): C2H4(g) + 3O2(g) 2CO2(g) + 2H2O(g) Si 2.70 moles de C2H4 reaccionan con 6.30 moles de O2, calcula el reactivo limitante. 7. Calcular el reactivo limitante En una cámara de reacción, se mezclan 3.0 moles de aluminio con 5.3 moles de Cl2 que luego reaccionan. La siguiente ecuación química equilibrada describe la reacción: 2Al(s) + 3Cl2(g) 2AlCl3(s) Identifica el reactivo limitante de la reacción. Luego calcula el número de moles de reactivo en exceso que quedan después de la reacción. 8. Calcular el reactivo limitante El gas hidrógeno se puede formar mediante la reacción del metal magnesio con el ácido clorhídrico. Mg(s) + 2HCl(aq) MgCl2(aq) + H2(g) Calcula el reactivo limitante si 6.00 g de HCl reaccionan con 5.00 g de Mg. 14 Nombre ___________________________ Clase ________ Fecha ___________ TEKS Química Lección 8E 9. Calcular el rendimiento porcentual Si 50.0 g de dióxido de silicio se calientan con un exceso de carbono, se forman 27.9 g de carburo de silicio. SiO2(s) + 3C(s) SiC(s) + 2CO(g) ¿Cuál es el rendimiento porcentual de esta reacción? 10. Calcular el rendimiento porcentual Si 15.0 g de nitrógeno reaccionan con 15.0 g de hidrógeno, se forman 10.5 g de amoníaco. ¿Cuál es el rendimiento porcentual de esta reacción? 11. Calcular el rendimiento porcentual ¿Cuál es el rendimiento porcentual si se forman 4.65 g de cobre cuando 1.87 g de aluminio reacciona con un exceso de sulfato de cobre(II)? 2Al(s) + 3CuSO4(aq) Al2(SO4)3(aq) + 3Cu(s) 15
