determinacion del calor específico
Anuncio
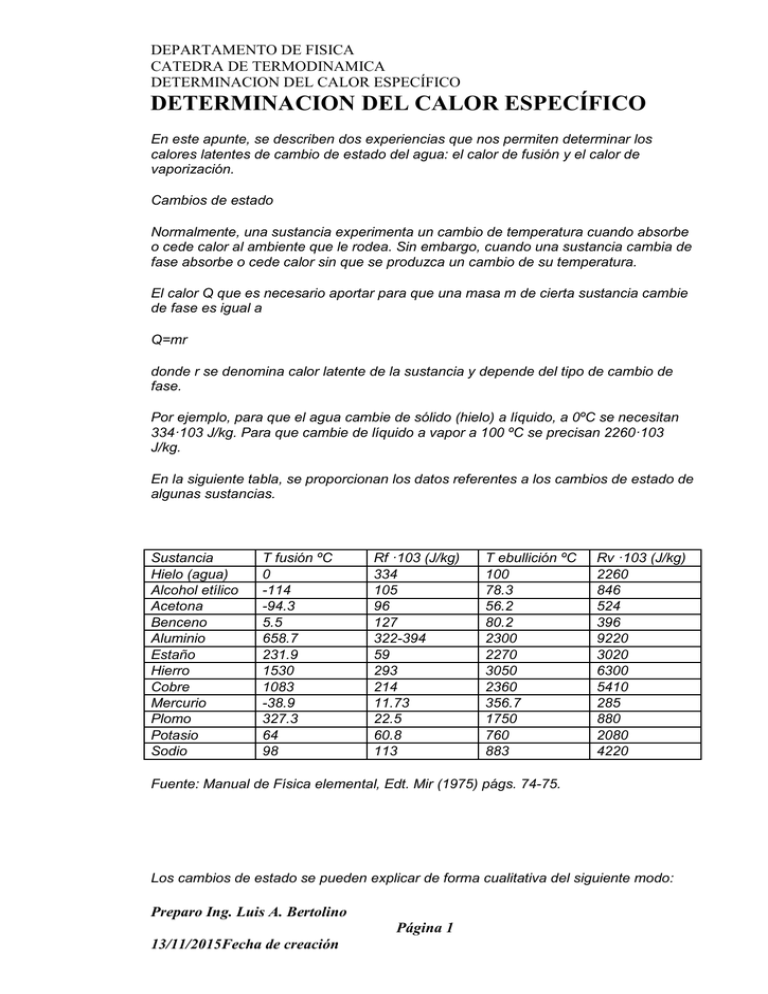
DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO DETERMINACION DEL CALOR ESPECÍFICO En este apunte, se describen dos experiencias que nos permiten determinar los calores latentes de cambio de estado del agua: el calor de fusión y el calor de vaporización. Cambios de estado Normalmente, una sustancia experimenta un cambio de temperatura cuando absorbe o cede calor al ambiente que le rodea. Sin embargo, cuando una sustancia cambia de fase absorbe o cede calor sin que se produzca un cambio de su temperatura. El calor Q que es necesario aportar para que una masa m de cierta sustancia cambie de fase es igual a Q=mr donde r se denomina calor latente de la sustancia y depende del tipo de cambio de fase. Por ejemplo, para que el agua cambie de sólido (hielo) a líquido, a 0ºC se necesitan 334·103 J/kg. Para que cambie de líquido a vapor a 100 ºC se precisan 2260·103 J/kg. En la siguiente tabla, se proporcionan los datos referentes a los cambios de estado de algunas sustancias. Sustancia Hielo (agua) Alcohol etílico Acetona Benceno Aluminio Estaño Hierro Cobre Mercurio Plomo Potasio Sodio T fusión ºC 0 -114 -94.3 5.5 658.7 231.9 1530 1083 -38.9 327.3 64 98 Rf ·103 (J/kg) 334 105 96 127 322-394 59 293 214 11.73 22.5 60.8 113 T ebullición ºC 100 78.3 56.2 80.2 2300 2270 3050 2360 356.7 1750 760 883 Rv ·103 (J/kg) 2260 846 524 396 9220 3020 6300 5410 285 880 2080 4220 Fuente: Manual de Física elemental, Edt. Mir (1975) págs. 74-75. Los cambios de estado se pueden explicar de forma cualitativa del siguiente modo: Preparo Ing. Luis A. Bertolino Página 1 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO En un sólido los átomos y moléculas ocupan las posiciones fijas de los nudos de una red cristalina. Un sólido tiene en ausencia de fuerzas externas un volumen fijo y una forma determinada. Los átomos y moléculas vibran, alrededor de sus posiciones de equilibrio estable, cada vez con mayor amplitud a medida que se incrementa la temperatura. Llega un momento en el que vencen a las fuerzas de atracción que mantienen a los átomos en sus posiciones fijas y el sólido se convierte en líquido. Los átomos y moléculas siguen unidos por las fuerzas de atracción, pero pueden moverse unos respecto de los otros, lo que hace que los líquidos se adapten al recipiente que los contiene pero mantengan un volumen constante. Cuando se incrementa aún más la temperatura, se vencen las fuerzas de atracción que mantienen unidos a los átomos y moléculas en el líquido. Las moléculas están alejadas unas de las otras, se pueden mover por todo el recipiente que las contiene y solamente interaccionan cuando están muy próximas entre sí, en el momento en el que chocan. Un gas adopta la forma del recipiente que lo contiene y tiende a ocupar todo el volumen disponible. Un ejemplo clásico en el que se usan los conceptos de calor específico y calor latente es el siguiente: Ejemplo : Determinar el calor que hay que suministrar para convertir 1g de hielo a -20 ºC en vapor a 100ºC. Los datos son los siguientes: Calor específico del hielo ch=2090 J/(kg K) Aprox.: ½ del Agua. Calor de fusión del hielo Rf=334·103 J/kg Calor específico del agua c=4180 J/(kg K) Calor de vaporización del agua Rv=2260·103 J/kg Etapas: Se eleva la temperatura de 1g de hielo de -20ºC a 0ºC Q1=0.001·2090·(0-(-20))=41.8 J Se funde el hielo Q2=0.001·334·103=334 J Se eleva la temperatura del agua de 0º C a 100 ºC Q3=0.001·4180·(100-0)=418 J Preparo Ing. Luis A. Bertolino Página 2 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Se convierte 1 g de agua a 100ºC en vapor a la misma temperatura Q4=0.001·2260·103=2260 J El calor total Q=Q1+Q2+Q3+Q4=3053.8 J. En la figura, se muestra cómo se va incrementando la temperatura a medida que se aporta calor al sistema. La vaporización del agua requiere de gran cantidad de calor como podemos observar en la gráfica (no está hecha a escala) y en los cálculos realizados en el ejemplo. Si disponemos de una fuente de calor que suministra una energía a razón constante de q J/s podemos calcular la duración de cada una de las etapas Medida del calor de fusión Para determinar el calor de fusión del hielo se pueden seguir dos procedimientos: Se mide la energía (potencia por tiempo) suministrada por un calentador eléctrico a una masa m de hielo a 0º C que se convierte en agua a la misma temperatura. Se introduce una masa m de hielo a un calorímetro con agua a una temperatura T ligeramente por encima de la temperatura ambiente Ta y se agita la mezcla hasta que el hielo se funde completamente. Se elige la masa m del hielo de modo que la temperatura Te de equilibrio esté ligeramente por debajo de la temperatura ambiente, es decir, de modo que T-Ta≈T-Te. De este modo, el calor cedido al ambiente en la primera etapa de la experiencia se compensa con el calor ganado en la segunda etapa. En la experiencia que se describe a continuación, se emplea el procedimiento de las mezclas pero no se tiene en cuenta las pérdidas o ganancias de calor entre el calorímetro y el medio ambiente. Preparo Ing. Luis A. Bertolino Página 3 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Una masa ma de agua a la temperatura inicial Ta se mezcla con una masa mh de hielo a 0º C en un calorímetro. La mezcla de agua y hielo se agita hasta que se alcanza una temperatura final de equilibrio Te. Pueden ocurrir dos casos Se funde una parte m de la masa inicial mh de hielo, quedando una mezcla formada por hielo (mh-m) y agua (ma+m) a la temperatura final de Te=0ºC. El calor absorbido por el hielo es Q1=m·Lf El calor cedido por el agua es Q2=ma·c·(0-Ta) Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que Q1+ Q2=0 (1) Si se funde todo el hielo, el estado final es una masa (mh+ma) de agua a la temperatura final Te>0. Preparo Ing. Luis A. Bertolino Página 4 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Ahora tenemos que tener en cuenta que la masa mh de hielo se convierte en agua y a continuación eleva su temperatura de 0ºC a Te. Por otra parte, el calorímetro (su masa equivalente en agua k) eleva su temperatura de 0º C a Te. El calor absorbido por el hielo es Q1=mh·Lf+ mh·c·(Te-0) Calor absorbido por el calorímetro Q2= k·c·(Te-0) El calor cedido por el agua es Q3=ma·c·(Te-Ta) Si el calorímetro está perfectamente aislado, no pierde ni gana calor, se cumplirá que Q1+Q2+ Q3=0 (2) En la página “calor específico de un sólido”, ya se ha explicado el significado de masa equivalente k en agua del calorímetro. Actividades Medida del equivalente en agua del calorímetro Introducimos los siguientes datos: Masa M de agua en gramos en el calorímetro, Temperatura T0 inicial del calorímetro Masa m de agua en gramos en una probeta Temperatura T del agua Preparo Ing. Luis A. Bertolino Página 5 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Se pulsa el botón titulado Preparar, los termómetros y las escalas graduadas de medida del volumen de agua reflejan los datos introducidos. Si estamos conformes, se pulsa el botón titulado Calcular. La masa m de agua se vierte en el calorímetro, y en el termómetro podemos leer la temperatura final de equilibrio Te. Ejemplo: Sea M=170 g, T0=92.7 ºC Sea m=170 g, y T=2.7 ºC La temperatura de equilibrio es Te=54.2ºC El equivalente en agua del calorímetro será Medida del calor de fusión Introducimos los siguientes datos: Masa mh de hielo en gramos en el calorímetro, Temperatura inicial del hielo se fija en 0ºC Masa ma del agua en gramos Temperatura Ta del agua Se pulsa el botón titulado Preparar. Preparo Ing. Luis A. Bertolino Página 6 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Si estamos conformes, se pulsa el botón titulado Calcular. El agua se vierte en el calorímetro, y en su termómetro podemos leer la temperatura final de equilibrio Te. En el caso de que solamente una parte del hielo se fundiese, la temperatura final sería Te=0ºC. Se podría extraer el hielo del calorímetro, y pesarlo en una balanza. Conocida la masa m de hielo se determina el calor de fusión mediante la fórmula (1). Cuando se produzca esta situación, se incrementa la masa de agua o su temperatura o ambas cosas a la vez, hasta conseguir que todo el hielo del calorímetro se funda. Ejemplo: Hielo: mh=128 g, Agua, ma=170 g, y Ta=80ºC Se funde todo el hielo y la temperatura final de equilibrio es Te=9.5 ºC La masa equivalente en agua del calorímetro la hemos calculada en el apartado anterior k=57.4 g Medida del calor de vaporización Para medir el calor de vaporización se coloca un recipiente metálico con una masa m de agua sobre un hornillo eléctrico de potencia P. Sea la temperatura inicial del agua es Ta. A medida que transcurre el tiempo se va elevando la temperatura del agua, hasta que entra en ebullición a 100 ºC. Anotamos el tiempo t1. El agua se evapora, disminuyendo el nivel de agua en el recipiente hasta que toda el agua se ha convertido en vapor. Anotamos el tiempo t2 que transcurre desde el comienzo de la ebullición hasta que se consume el agua. Preparo Ing. Luis A. Bertolino Página 7 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Tendremos las siguientes relaciones P·t1=m·c·(100-Ta) P·t2=m·Lv donde Lv es el calor de evaporación del agua que trataremos de determinar, Eliminamos la cantidad desconocida P en el sistema de dos ecuaciones, y despejamos Lv. Preparo Ing. Luis A. Bertolino Página 8 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO La medida del calor latente de evaporación del agua es problemática, en primer lugar, es difícil determinar el momento en el que el agua entra en ebullición, y el momento en el que el agua se evapora completamente. Las pérdidas de calor son importantes (ley de enfriamiento de Newton) ya que la diferencias de temperatura entre el agua en ebullición y el ambiente es muy grande. Habría que tener en cuenta también, el calor absorbido por el recipiente, el agua que se evapora durante el proceso de calentamiento y el agua que se condensa en las paredes del recipiente. Si tenemos en cuenta las pérdidas de calor las ecuaciones se escribirían P·t1=m·c·(100-Ta)+Q1 P·t2=m·Lv+Q2 Q1 es el calor perdido en el proceso de calentamiento del agua desde la temperatura inicial Ta hasta que entra en ebullición. Q2 es el calor perdido en el proceso de cambio de fase de líquido a vapor. Actividades Para evitar una excesiva complejidad en la simulación de la experiencia, se ha supuesto que las pérdidas de calor Q1 y Q2 son despreciables. Como en una experiencia real, solamente una parte de la energía suministrada por el hornillo eléctrico, sobre el que se pone el recipiente de agua, se emplea en calentarla, el resto va a la atmósfera. La potencia efectiva empleada en el calentamiento es igual a la potencia consumida menos una proporción seleccionada aleatoriamente y comprendida entre el 10% y el 30%. Se introduce La potencia del calentador eléctrico en W, actuando en la barra de desplazamiento titulada Potencia. Masa m de agua en gramos en el recipiente Temperatura inicial Ta del agua Se pulsa el botón titulado Empieza Se observa como la temperatura del agua se va incrementando con el tiempo hasta que en el instante t1 el agua empieza a hervir. A partir de ese momento, el agua se va evaporando a la temperatura constante de 100ºC, empleando un tiempo t2 en dicho proceso. Usando los botones titulados Pausa/Continua y Paso se miden los tiempos t1 y t2. Preparo Ing. Luis A. Bertolino Página 9 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Ejemplo: Potencia 1000 W Masa de agua: m=200 g Temperatura inicial, y Ta=20ºC El agua alcanza la temperatura de 100º C en el instante t=78 s. El agua se ha evaporado completamente en el instante t=604 s Tenemos que t1=78s y t2=604-78=526 s La potencia efectiva P del hornillo eléctrico que se ha empleado en calentar y evaporar el agua es algo menos de 1000 W. DETERMINACION DEL CALOR ESPECIFICO DE UN SOLIDO En esta página, se simula una experiencia de laboratorio poco usual, la medida del calor específico de un cuerpo metálico empleando la ley del enfriamiento de Newton. Para ello, tenemos que conocer el calor específico de un cuerpo de las misma forma y dimensiones que tomamos como referencia. Ley del enfriamiento de Newton Cuando la diferencia de temperaturas entre un cuerpo y su medio ambiente no es demasiado grande, el calor transferido en la unidad de tiempo hacia el cuerpo o desde el cuerpo por conducción, convección y radiación es aproximadamente proporcional a la diferencia de temperatura entre el cuerpo y el medio externo. Preparo Ing. Luis A. Bertolino Página 10 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Donde a es el coeficiente de intercambio de calor y S es el área del cuerpo. Si la temperatura T del cuerpo es mayor que la temperatura del medio ambiente Ta, el cuerpo pierde una cantidad de calor dQ en el intervalo de tiempo comprendido entre t y t+dt, disminuyendo su temperatura T en dT. dQ=-m·c·dT donde m=r V es la masa del cuerpo (r es la densidad y V es el volumen), y c el calor específico. La ecuación que nos da la variación de la temperatura T del cuerpo en función del tiempo es o bien, Integrando esta ecuación con la condición inicial de que en el instante t=0, la temperatura del cuerpo es T0. Obtenemos la relación lineal siguiente. ln(T-Ta)=-k·t +ln(T0-Ta) Despejando T obtenemos Medida del calor específico de una sustancia En la deducción anterior, hemos supuesto que el calor específico c no cambia con la temperatura, manteniéndose aproximadamente constante en el intervalo de temperaturas en la que se realiza el experimento. Si medimos la temperatura del cuerpo durante su enfriamiento a intervalos regulares de tiempo, y realizamos una representación gráfica de ln(T-Ta) en función de t, veremos que los puntos se ajustan a una línea recta, de pendiente –k. Preparo Ing. Luis A. Bertolino Página 11 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Podemos medir el área S de la muestra, determinar su masa m=r V mediante una balanza, y a partir de k calculamos el calor específico c. Pero tenemos una cantidad desconocida, el coeficiente a , que depende de la forma y el tamaño de la muestra y el contacto entre la muestra y el medio que la rodea. Sin embargo, para varias sustancias metálicas en el aire, a tiene el mismo valor si las formas y los tamaños de todas las muestras son idénticas. Así, se puede determinar a para una sustancia metálica de calor específico conocido y luego, emplear este valor para determinar el calor específico de otra sustancia metálica de la misma forma y tamaño. En la experiencia simulada, la forma de las muestras ensayadas es cúbica de lado d. El área de las caras de un cubo es S=6d2 y su volumen V=d3. La expresión de la constante k será ahora La muestra que nos va a servir de referencia es el Aluminio cuya densidad es rAl=2700 kg/m3 y calor específico cAl=880 J/(K·kg). Determinamos en una experiencia el valor de kAl para una muestra de Aluminio de forma cúbica de lado d. Determinamos en otra experiencia la el valor de kx de una muestra de otro material, de densidad rx conocida, de calor específico cx desconocido, que tenga la misma forma cúbica y del mismo tamaño d. Como el valor de a es el mismo. El valor del calor específico desconocido cx lo podemos obtener a partir de la siguiente relación. Actividades En primer lugar, tenemos que elegir el Aluminio como sustancia de referencia en el control selección titulado Material. Introducimos los siguientes datos: La temperatura inicial T0 (menor de 100ºC) en el control de edición titulado Temperatura. Preparo Ing. Luis A. Bertolino Página 12 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO El tamaño de la muestra cúbica, la longitud de su lado d en cm, en el control de edición titulado Dimensión. Se pulsa en le botón titulado Empieza La temperatura ambiente se ha fijado en el programa interactivo, Ta=20ºC. En la parte izquierda, se observa un cubo de aluminio y un termómetro que indica su temperatura. En la parte derecha del grafico, se observa la evolución de su temperatura T a lo largo del tiempo t. Se toman medidas de la temperatura cada 50 s. Estas medidas se guardan en el control área de texto situado a la izquierda del grafico Se representa en el eje vertical ln (T-T0), y en el eje horizontal el tiempo t en s. Se representan los datos "experimentales" mediante puntos y la recta que ajusta a estos datos. Anotamos el valor de la pendiente, kAl, la densidad del Aluminio rAl=2700 kg/m3, y el calor específico del Aluminio cAl=880 J/(K·kg) Observamos la evolución de su temperatura T en función del tiempo t. Cuando se ha acabado de tomar los datos, se pulsa en el botón titulado Gráfica. Apuntamos el valor de la pendiente de la recta kx y el valor de la densidad del material rx. Para obtener el valor del calor específico de muestra metálica cx aplicamos la fórmula Ejemplo: Determinar el calor específico del Hierro conocido el calor específico del Aluminio. Sustancia de referencia Aluminio Temperatura inicial T0=100ºC Tamaño de la muestra d=10 cm Valor de la pendiente kAl=0.00530 Densidad rAl=2700 kg/m3 Calor específico cAl=880 Jl/(K·kg) Sustancia Hierro Temperatura inicial T0=100ºC Tamaño de la muestra d=10 cm Valor de la pendiente kx=0.00355 Preparo Ing. Luis A. Bertolino Página 13 13/11/2015Fecha de creación DEPARTAMENTO DE FISICA CATEDRA DE TERMODINAMICA DETERMINACION DEL CALOR ESPECÍFICO Densidad rx=7880 kg/m3. El calor específico del Hierro es Preparo Ing. Luis A. Bertolino Página 14 13/11/2015Fecha de creación
