comparativa ciclos teóricos termodinámicos mep, mec y
Anuncio

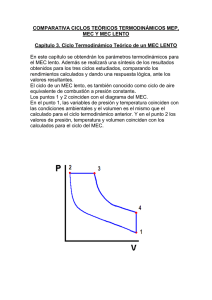
COMPARATIVA CICLOS TEÓRICOS TERMODINÁMICOS MEP, MEC Y MEC LENTO Capítulo 2. Ciclo Termodinámico Teórico de un MEC Los puntos 1 y 2 coinciden con el diagrama del MEP. En el punto 1, las variables de presión y temperatura coinciden con las condiciones ambientales y el volumen es el mismo que el calculado para el ciclo termodinámico anterior. Y en el punto 2 los valores de presión, temperatura y volumen coinciden con los calculados para el ciclo del MEP. Para este ciclo, la presión en la combustión está limitada a 70 bar. Para los puntos 3, 3A y 4 será necesario el cálculo de los nuevos parámetros que definen los procesos termodinámicos. Punto 1. El pistón se encuentra en el PMI, preparado para realizar la carrera de compresión, y en dicho instante, los valores de presión y temperatura son los siguientes: P1 1bar T1 30 273 303K Según la ecuación de Clapeyron o de los gases perfectos aplicada en el punto 1, se obtiene: P v R T P1 v1 R T1 v1 R T1 0.287Kj / Kg K 303K v1 0.87m 3 / Kg 2 P1 1 100KN / m Los valores de presión, temperatura y volumen específicos para el punto 1 quedan de la siguiente forma. P1 1bar T1 30ºC V1 0.87m3/Kg Punto 2. El pistón ha realizado la carrera de compresión, desplazándose desde el PMI, hasta el PMS. Durante este proceso no se cede calor a las paredes el cilindro, por tanto se considera un proceso adiabático. Haciendo uso de la ecuación que rige los procesos adiabáticos entre los puntos 1 y 2, se obtiene la presión, al final de la compresión. P1 v1 P2 v2 Cp Cv Relación termodinámica de calores específicos Cp 1Kj / Kg K Calor específico del aire como gas ideal, a presión constante. Cv 0.713Kj / Kg K Calor específico del aire como gas ideal, a volumen constante. Cp 1 1.4 Cv 0.713 Observando la ecuación de las adiabáticas, para poder obtener P2 , es necesario conocer antes v2 . Rc v1 v 0.87 11 v2 1 0.079m 3 / Kg v2 Rc 11 Aplicamos ahora la ecuación de las adiabáticas y despejamos P2 : P1 v1 P2 v2 P2 v1 Rc P2 P1 Rc 1 111.4 28.88bar P1 v 2 Para obtener la temperatura, se aplica la ecuación de los gases perfectos en el punto 2 y se despeja T2 P v R T P2 v2 R T2 T2 P2 v2 2888KN / m 2 0.079m 3 / Kg 795.48K R 0.287KJ / KgK T2 795.48 273 522.5º C Los parámetros termodinámicos al final de la compresión son los siguientes: P2 28.88bar T2 522.5ºC V2 0.079m3/Kg Punto 3. El pistón se encuentra en el PMS y se ha realizado parte de la combustión a volumen constante. El aporte de calor tiene lugar mediante un proceso isócoro 2-3. Del punto 3, conocemos su presión, ya que como se observa en el diagrama, la presión máxima del ciclo se alcanza en este punto y debe ser 70 bares. El volumen del punto 3 coincide con el volumen del punto 2. Utilizando la ecuación de los gases perfectos, se obtiene la temperatura en el punto 3. P v R T P3 v3 R T3 T3 P3 v3 7000KN / m 2 0.079m 3 / Kg 553 1928K 1655º C R 0.287KJ / Kg K 0.287 P3 70bar T3 1655ºC V3 0.079m3/Kg Punto 3A. El pistón comienza su descenso, realizando el final de la combustión a presión constante. El aporte de calor tiene lugar mediante un proceso isóbaro 3-3A. Del punto 3A, conocemos su presión, ya que como se observa en el diagrama, es la misma que el punto 3. Para obtener la temperatura y el volumen en el punto 3A, hacemos uso del balance de calor aportado al ciclo. Dicho calor se aporta entre 2 y 3A. Los procesos 1-2 y 3A-4 son adiabáticos y el proceso 4-1 representa el calor cedido al foco frío. El calor aportado al ciclo es dato del problema, por lo que si Cv es el calor específico a volumen constante, y Cp es el calor específico a presión constante, se tiene que: Calor aportado a volumen constante Qav Cv T T T3 T2 Qav Cv T Cv T3 T2 Calor aportado a presión constante Qap Cp T T T3 A T3 Qap Cp T Cp T3 A T3 Calor total aportado al ciclo Qa Cv T Cp T Cv (T 3 T 2) Cp (T 3A T 3) Se despeja T3A T 3A Qa Cv(T 3 T 2) 2200 0.713 (1928 795.48) T3 1928 3320.57K 3047.5º C Cp 1 Conocidas la presión y temperatura, aplicamos la ecuación de los gases perfectos y se obtiene el volumen específico en dicho punto. P v R T P3 A v3 A R T3 A Se despeja el volumen v3 A R T3 A 0.287 3320.57 0.136m 3 / Kg P3 A 7000 Los parámetros termodinámicos al final de la combustión son los siguientes: P3A 70bar T3A 3047.5ºC V3A 0.136m3/Kg Punto 4. Se ha producido la carrera de expansión o trabajo durante el proceso 3A-4, considerado adiabático porque no existe cesión de calor. El pistón se encuentra en el PMI a una presión superior a la atmosférica. Del punto 4 se puede deducir rapidamente su volumen, ya que debe coincidir con el volumen del punto 1. El resto de parámetros, como son la presión y temperatura, se resuelven mediante la ecuación de las adiabáticas y la ecuación de Clapeyron o de los gases perfectos respectivamente. Para calcular las coordenadas del punto 4, tenemos dos datos, la evolución 3A-4 que es adiabática, por la propia definición del ciclo y el volumen v4 v1 , así pues; v4 v1 0.87m3 / Kg Haciendo uso de la ecuación en el proceso adiabático 3A-4, se obtiene la presión en el punto 4. P3 A v3 A P4 v4 v P4 v3 A 0.136 P4 P3 A 3 A 70000KN / m 2 ; P3 A v4 v 0 . 87 4 1.4 P4 70000KN / m 2 0.1561.4 5195KN / m 2 5.195bar Con la ecuación de los gases perfectos aplicada en el punto 4, se obtiene la temperatura; P v R T P4 v4 R T4 Se despeja la temperatura; P4 v4 5195KN / m 2 0.87m 3 / Kg T4 1574.16K 1301º C R 0.287KJ / Kg K Las coordenadas del punto cuatro son las siguientes: P4 5.195bar T4 1301ºC V4 0.87m3/Kg En la siguiente figura se observa el ciclo completo de un MEC lento, así como los procesos de aporte y cesión de calor. Una vez obtenidos los valores de presión, temperatura y volumen específico, en cada uno de los puntos del ciclo y conociendo el calor aportado por el combustible (que es un dato), se puede aplicar el primer principio de la termodinámica, para obtener el trabajo específico; W Qa Qc W Trabajo específico Qa Calor aportado Qc Calor cedido El calor aportado es un dato; Qa 2200Kj / Kg Se calcula ahora el calor cedido en el escape; Qc Cv T Cv T4 T1 0.713KJ / KgK 1574.16 303 906.33KJ / kg El trabajo específico resultante es; W Qa Qc 2200 906.33 1293.67KJ / Kg El rendimiento termodinámico es; tMEC Qa Qc W 1293.67 0.588 Qa Qa 2200 Resultados obtenidos para el ciclo teórico de un MEC MEC 1 2 3 3A 4 P(bar) 1 28.88 70 70 5.195 T(K) 303 795.48 1928 3047.5 1574.16 V(m3/Kg) 0.87 0.079 0.079 0.136 0.87 η=0.588