Tema 9: Nitrógeno y su grupo
Anuncio

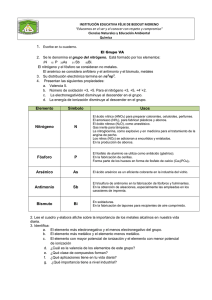
Tema 9: Nitrógeno y su grupo - nitrógeno (N) se encuentra en el grupo grupo V.A (15. grupo principal sel sistema periódico) con fósforo (P), arsenico (As), antimonio (Sb) y bismuto (Bi) - tiene 5 electrones en la capa de valencia y su configuración electrónica es ns2 np3 - nitrógeno es gaseoso, los demás son sólidos - el nitrógeno puede tener solamente 4 enlaces, pero otros elementos tienen d orbitales y pueden formar hasta 6 enlaces - con el número atómico Z aumenta el carácter metálico, o sea dentro del grupo aparecen tanto las propiedades de metales como las de no metales: N y P son no metales, As y Sb metaloides y Bi es un metal - N y P son bioelementos, los otros no podemos encontrar tan fácilmente 1. el nitrógeno (N) - el nitrógeno es el elemento, en forma no elemental, más abundante en nuestro planeta, se encuentra principalmente en la atmósfera, donde constituye el 78.1 % en volumen - tiene configuración 2s2 2p3 y puede tener solamente 4 enlaces - es un gas incoloro, sin olor y sabor - forma molecula N2 - es muy estable, porque tiene enlace triple y la energía de enlace es muy grande, solo reacciona a altas temperaturas uso: La mayor parte del nitrógeno utilizado en la industria química se obtiene por destilación del aire líquido, y se usa para sintetizar amoníaco. A partir de este amoníaco se preparan una gran variedad de productos químicos, como fertilizantes, ácido nítrico o aminas. También se usa el amoníaco para elaborar óxido nitroso (N2O), un gas incoloro conocido popularmente como gas de la risa (rajský plyn). Este gas, mezclado con oxígeno, se utiliza como anestésico en cirugía. El nitrógeno líquido tiene una aplicación muy extendida en el campo de la criogenia (kryogenika, věda zabývající se dosahováním velmi nízkých teplot) como agente enfriante. El nitrógeno líquido también se utiliza para la congelación de alimentos, para el tratamiento de verrugas y los bancos de semen utilizan nitrógeno líquido para conservar el material genético. preparación: el nitrógeno se obtiene a partir del aire por licuación (kapalnění) de éste y posterior destilación fraccionada en el laboratorio se obtiene por oxidación del amoniaco con óxido de cobre (II): 2 NH (g) + 3 CuO(s) → 3 3 Cu(s) + 3 H O(g) + N (g). 2 2 por calentamiento del nitrito de amonio: NH NO (s) → 2 H O(g) + N (g). 4 2 2 2 compuestos: nitruros El nitruro es un compuesto de nitrógeno con un elemento menos electronegativo, donde el nitrógeno tiene un estado de oxidación de -3 (N-3). Las reacciones son en general explosivas. 1 ejemplo: · K3N Nitruro de potasio · Mg3N2 Nitruro de magnesio · Cu3N2 Nitruro de cobre · BN Nitruro de boro · SbN Nitruro de antimonio N-3 amoníaco NH3 - es el compuesto de nitrógeno y hidrógeno más importante - es un gas formado por la combinación de un átomo de nitrógeno y tres átomos de hidrógeno - es incoloro, más ligero que el aire y tiene un olor desagradable que irrita los ojos y las vías respiratorias - se disocia muy bien en el agua y puede enlazar H+, pues tiene caracter básico uso: - la disolución del amoniaco se emplea en usos domésticos - elimina la dureza temporal del agua, o sea se emplea para limpiar y lavar - fabricacion de acido nítrico y de abonos producción: - obtención industrial: por el proceso de Haber - Bosch, que es la reacción de nitrógeno e hidrógeno gaseosos para producir amoníaco - 90% de amoniaco producido se emplea en la síntesis de abono (sales amónicas, urea y cianamida) - en la naturaleza se produce durante la degradacion de compuestos orgánicos sales de amoniaco - estas sales se forman durante la reacción con los ácidos - son las compuestos cristalinoc, blancos, bien solubles - se utilizan como el abono ((NH4)2SO4 o NH4NO4 ) oxidos oxido de nitrogeno I - N2O - gas de la risa - provoca haluciaciones o perdidas de memoria - antes se utilizaba como el narcotico de quirurgía oxido de nitrogeno II - NO - venenoso - es un interproducto en la produccion de acido nitrico oxido de nitrogeno III - N2O3 - líquido de color azul - no es estable, se descompone formando NO y NO2 oxido de nitrogeno IV - NO2 - rojo/maron 2 - muy venenoso - uno de los interproductos de la fabricaccion de acido nitrico oxido de nitrogeno V - N2O5 - no es estable acido nítrico - HNO3 - es un acido muy fuerte y un agente oxidante poderoso - los alquimistas medievales lo conocían como "el agua fuerte" - se obtiene por la acción del ácido sulfúrico sobre nitrato de sodio y también se puede preparar por oxidación catalítica del amoniaco - en forma anhidra está incoloro, pero cuando se desintegrada, el NO2 da color naranja - se desintegra (agua, O2, NO2) por culpa de la luz, por esto se almanece en botellas oscuras - es un oxidante muy fuerte, oxida casi todos metales excepto oro y platina o Fe, Cr y Al - se utiliza como el abono (los abonos nitrogenados contienen nitrógeno como la principal materia nutritiva de los vegetales) o explosivo sales de acido nítrico - nitratos - bien solubles en el agua y desprenden O2 al calentar ácido nitroso - HNO2 - es estable solamente en disoluciones acuosas frías y al calentarse o incrementar su concentración discomponen: 3HNO2 + HNO3 + 2NO + H2O - se utiliza para la fabricación de colorantes 2. el fósforo (P) - se presenta en varias modificaciones alotropicas (se diferencian en la reactividad) - se oxida espontaneamente en el aire, emitiendo luz - fenomeno de fosforescencia - nunca se encuentra en el estado elemental, sino combinado, y principalmente como fosfato - se encuentra en los microorganismos marinos o (en forma de fosfato de calcio) en los huesos y dientes aplicaciones: - la mayoría se utiliza para la fabricación de ácido fosfórico y de los fosfatos - también se utiliza para la fabricación de fósforo de cobre, cerillas de seguridad, material incendario militar etc. a) fosforo blanco - sustancia translúcida y blanda - moleculas de P4 - el más reactivo, en el aire se se inflama espontáneamente y ardiendo con llama blanca y formando vapores de color blanco de P2O5 - es venenoso b) fosforo rojo - es un "polvo" amorfo rojo que no se inflama espontáneamente y arde solamente a partir de los 260 °C - no es venenoso porque es practicamente insoluble c) fosforo negro 3 - es el más estable - presenta brillo metálico, tiene estructura parecida a grafito y conduce electricidad o el calor compuestos: oxido de fosforo - P4O10 - es un sólido blanco que se forma durante la combustión de fosforo molecular - muy higroscopico, se usa como secante (,,vysoušedlo") - por la reacción con el agua forma acido fosforico acido trihidrogenfosfórico - H3PO4 - una sustancia cristalina incolora a la temperatura ambiente - muy soluble en agua - es un ácido bastantre fuerte, es estable y no tiene propiedades oxidantes - no disuelve a la mayoría de los metales, porque en sus superficies se forma la "costra de fosfatos indisolubles" uso: - se utiliza en el laboratorio debido a su resistencia a la oxidación, a la reducción y a la evaporación; se emplea como ingrediente de bebidas no alcohólicas, como pegamento de prótesis dentales, como catalizador, como ablandadores de agua, fertilizantes y detergentes, abonosabonos (superfosfato Ca(H2PO4)2, KH2PO4, (NH4)2PO4), proteccion de metales (fosfatacion), industria alimentaria (Coca-cola) o medicamentos compuestos orgánicos: - en el organismo hay iones fosforicos - RNA, DNA, ATP (viz. grupo fosfato) 3. el arsénico (As) - este elemento es considerado como uno de los más tóxicos que existen - se encuentra en la frontera entre los metales y no metales pero su modificación más estable presenta carácter metálico - se encuentra de forma natural sobre la Tierra (como mineral del cobalto o junto a otros minerales como el azufre o ciertos metales) en la superficie de las rocas - dentro de las comidas que lo contienen se encuentran los pescados y mariscos, sin embargo, se trata de un arsénico poco peligroso para la salud porque el contacto con arsénico tóxico puede provocar la irritación del estómago, baja producción de glóbulos rojos y blancos y a medida que el contacto con el arsénico se eleva, aumentan las probabilidades de contraer cáncer - existen tres formas en las que se puede encontrar al arsénico, las que se denominan alótropos: 1. arsénico gris: - forma una masa quebradiza (křehký) de cristales de color gris - se vuelve negro al pasar largo tiempo al aire - puede conducir la electricidad (como los metales) 4 2. arsénico amarillo: - masa cristalina translúcida y blanda - se forma al enfriar el vapor de As y un ligero suministro energético (luz o calentamiento) lo transforma en la modificación gris 3. arsénico amorfo: - tiene color negro y se presenta en diferentes formas uso: - la mayor parte del consumo actual de arsénico se encuentra en la fabricación de plaguicidas (prostředky proti hmyzu), prohibidos ya en muchos países desarrollados, y en la fabricación de pigmentos combinaciones: - hidruro de arsénico (AsH3) - gas incoloro, venenoso, con olor a ajo - sulfuros de arsénico (monosulfuro: As4S4, trisulfuro: As4S6) - monosulfuro: As4S4: masa vítrea roja que se vuelve negra al calentarla - trisulfuro: As4S6: masa de color amarillo, insoluble en agua y en ácidos, por lo tanto no es venenosa; al calentarlo se vuelve rojo y se emplea como pigmento colorante 4. el antimonio (Sb): - elemento cristalino de color blanco - no es un elemento abundante en la naturaleza; raras veces se encuentra en forma natural - también presenta diferentes formas alotrópicas (y de ellas la forma amarilla, que se compone de moléculas Sb4 y se encuentra en el vapor de antimonio, y la forma gris se transforman al calentarlas en la modificación estable metálica) uso: - principalmente se emplea en aleaciones (slévání) metálicas y algunos de sus compuestos para dar resistencia contra el fuego, en pinturas, cerámicas, esmaltes, vulcanización del caucho o fuegos artificiales. combinaciones: - hidruro de antimonio (SbH3) - sustancia gaseosa de olor desagradable y venenosa que se origina mediante la acción de los ácidos sobre el metal - es muy inestable - trisulfuro de antimonio - estibina (Sb2S3) - forma largos cristales de color gris - es la sustancia más importante para la obtención de Sb elemental - se utiliza en pirotecnica o para la fabricación de vidrios coloreados 5. bismuto (Bi): - es el elemento más metálico en este grupo - es un metal cristalino, blanco, duro y quebradizo y uno de los pocos metales que se expanden al solidificarse - su conductividad térmica y eléctrica es menor que la de cualquier otro metal (con excepción del mercurio) y es fuertemente dimagnético - al contrario que los demás elementos del grupo, presenta una sola modificación 5 uso: - es principalmente un componente de las aleaciones de bajo punto de fusión - también se utiliza como el catalizador en la producción de fibras artificiales o en la fabricación de elementos termoeléctricos o cosméticos y farmaceuticos 6