SUSTANCIAS ÁCIDAS, BÁSICAS Y NEUTRAS
Anuncio

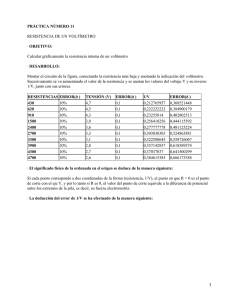
PROGRAMA SENIOR (PRÁCTICA 6) CURSO: 2012-13 NOMBRE DEL TALLER: LABORATORIO DE QUÍMICA EN EL AULA NOMBRE DEL ALUMNO: REACCIONES DE OXIDACIÓN-REDUCCIÓN ESPONTÁNEAS (PILAS) MATERIAL Vasos de precipitados de 100 mL Pipetas Pasteur o cuentagotas Pinzas de cocodrilo Rotuladores para vidrio Voltímetro REACTIVOS Vinagre (ácido acético: CH3-COOH), limón (ácido cítrico), alcohol (etanol: CH3-CH2OH), agua desionizada, azúcar, sal común (cloruro sódico: NaCl). Cobre (Cu), magnesio (Mg), cinc (Zn), clavo de hierro (Fe), aluminio (Al), grafito (C). PROCEDIMIENTO A) CONSTRUIR PILAS Introducir una pequeña cantidad de cada reactivo en disolución en cada uno de los vasos de precipitados. Sujetar los electrodos de cobre y hierro con pinzas de cocodrilo conectadas a un voltímetro. Anotar la lectura del voltímetro (V) en la Tabla 1. En el vaso que contiene el vinagre introducir de dos en dos los metales sujetos con pinzas de cocodrilo y conectadas a un voltímetro. Por ejemplo: Cobre y Hierro; Cobre y Magnesio; Cobre y Aluminio. Anotar la lectura del voltímetro (V) en la Tabla 2. CUESTIONES 1.- Consultar la tabla de potenciales normales de reducción de cada metal y calcular la diferencia de potencial normal de cada pila. Compararla con la pila construida. ¿Por qué son distintas? 2.- Escribir una ecuación química que explique la conductividad de los electrolitos. 3.- Escribir una ecuación química que explique la no conductividad de los no electrolitos. Tabla 1. Electrolitos y no electrolitos. Diferencias de potencial medidas con los electrodos cobre(Cu) y hierro (Fe). Sustancia Vinagre Agua desionizada Agua con azúcar Agua con sal Etanol Limón ¿Es conductor? SI/NO E(V) B) CONSTRUIR UNA PILA CON FRUTAS MATERIAL Pinzas de cocodrilo Rotuladores para vidrio Bombilla Voltímetro REACTIVOS Limón o naranja (ácido cítrico). Cobre (Cu), magnesio (Mg), cinc (Zn), clavo de hierro (Fe), aluminio (Al). PROCEDIMIENTO Tomar una naranja o un limón. Apretar y girar suavemente para ablandarla. Pinchar con un hilo de cobre, un clavo de hierro, un trozo de aluminio, un trozo de magnesio. Conectar un voltímetro a dos de los metales clavados en la naranja o limón. Anotar la diferencial de potencial (voltios) en la Tabla 2. Conectar dos de los metales a una bombilla. Construir varias pilas con los electrodos que mayor diferencia de potencial se haya observado. CUESTIONES Tabla 2. Diferencias de potencial con distintos electrodos introducidos en un limón o naranja. Electrodos (Me/Me) Cobre/Cinc Cobre/Aluminio Cobre/ Magnesio Cobre/Hierro Hierro/Cinc E(V) CONSTRUCCIÓN DE LA PILA DANIELL MATERIAL Vasos de precipitados de 100 mL Tubo de vidrio en forma de U Pipetas Pasteur o cuentagotas Rotuladores para vidrio Pinzas de cocodrilo Algodón Voltímetro REACTIVOS Agua desionizada, sal común (cloruro sódico: NaCl). Cobre (Cu), cinc (Zn). Disolución de sulfato de cobre (II) 1M (CuSO4). Disolución de sulfato de cinc (II) 1M (ZnSO4). PROCEDIMIENTO En un vaso de precipitados poner 50 mL de disolución de sulfato de cobre 1M. Introducir el electrodo de cobre en el vaso. En el otro vaso poner 50 mL de disolución de sulfato de cinc 1M. Introducir el electrodo de cinc. Poner en comunicación ambos vasos a través del puente salino formado por el tubo en U, lleno de disolución saturada de NaCl. Para ello, poner tapones de algodón en sus extremos, invertirlo e introducirlo. Medir la diferencia de potencial entre los electrodos con un voltímetro. CUESTIONES 1. Escribe la reacción que tiene lugar. 2. Escribe las semireacciones que tienen lugar en el ánodo y en el cátodo. 3. Dibuja el esquema de la pila y el movimiento de los electrones y de los iones. 4. Mide la diferencia de potencial (V, voltios) al inicio. Al cabo de dos días ¿La diferencia de potencial sería mayor, menor o igual?.