Guía de Química - Resumen Nomenclatura Inorgánica
Anuncio
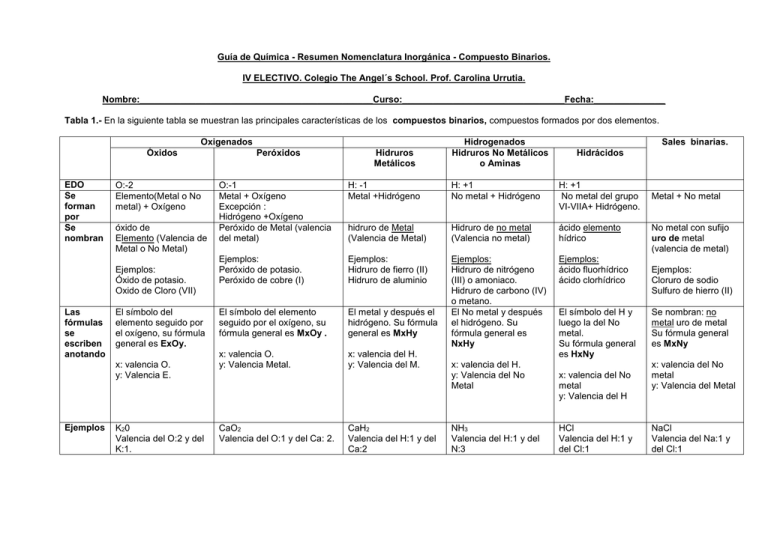
Guía de Química - Resumen Nomenclatura Inorgánica - Compuesto Binarios. IV ELECTIVO. Colegio The Angel´s School. Prof. Carolina Urrutia. Nombre:______________________________________________Curso:________________________________Fecha:______________ Tabla 1.- En la siguiente tabla se muestran las principales características de los compuestos binarios, compuestos formados por dos elementos. Oxigenados Óxidos EDO Se forman por Se nombran O:-2 Elemento(Metal o No metal) + Oxígeno óxido de Elemento (Valencia de Metal o No Metal) Ejemplos: Óxido de potasio. Oxido de Cloro (VII) Las fórmulas se escriben anotando El símbolo del elemento seguido por el oxígeno, su fórmula general es ExOy. x: valencia O. y: Valencia E. Ejemplos K20 Valencia del O:2 y del K:1. Peróxidos Hidruros Metálicos Hidrogenados Hidruros No Metálicos o Aminas Sales binarias. Hidrácidos O:-1 Metal + Oxígeno Excepción : Hidrógeno +Oxígeno Peróxido de Metal (valencia del metal) H: -1 Metal +Hidrógeno H: +1 No metal + Hidrógeno H: +1 No metal del grupo VI-VIIA+ Hidrógeno. hidruro de Metal (Valencia de Metal) Hidruro de no metal (Valencia no metal) ácido elemento hídrico Ejemplos: Peróxido de potasio. Peróxido de cobre (I) Ejemplos: Hidruro de fierro (II) Hidruro de aluminio Ejemplos: ácido fluorhídrico ácido clorhídrico El símbolo del elemento seguido por el oxígeno, su fórmula general es MxOy . El metal y después el hidrógeno. Su fórmula general es MxHy Ejemplos: Hidruro de nitrógeno (III) o amoniaco. Hidruro de carbono (IV) o metano. El No metal y después el hidrógeno. Su fórmula general es NxHy x: valencia O. y: Valencia Metal. x: valencia del H. y: Valencia del M. CaO2 Valencia del O:1 y del Ca: 2. CaH2 Valencia del H:1 y del Ca:2 x: valencia del H. y: Valencia del No Metal NH3 Valencia del H:1 y del N:3 El símbolo del H y luego la del No metal. Su fórmula general es HxNy x: valencia del No metal y: Valencia del H HCl Valencia del H:1 y del Cl:1 Metal + No metal No metal con sufijo uro de metal (valencia de metal) Ejemplos: Cloruro de sodio Sulfuro de hierro (II) Se nombran: no metal uro de metal Su fórmula general es MxNy x: valencia del No metal y: Valencia del Metal NaCl Valencia del Na:1 y del Cl:1 Otros: Respecto a los óxidos: Cuando el elemento puede formar óxidos con 2 EDO se puede usar la terminación oso para la menor y la terminación ico para el mayor. Ejemplo: Cu2O óxido cuproso, óxido de cobre (I) CuO óxido cúprico, óxido de cobre (II). Si el elemento forma óxidos con 4 EDO el de menor estado de oxidación se nombra con el prefijo hipo y el sufijo oso, el con segundo estado de oxidación con el sufijo oso, el siguiente con sufijo ico y el con el mayor EO con el prefijo per y el sufijo ico. Cl2O Óxido hipocloroso Cl2O3 Óxido cloroso Cl2O5 Óxido clórico Cl2O7 Óxido perclórico Respecto a los peróxidos: Los peróxidos son un grupo especial de compuestos binarios en los que interviene el oxígeno con un número de oxidación aparente de -1. Estos compuestos contienen el grupo peróxido: O22-. Este grupo está constituido siempre por dos átomos de oxígeno y por tanto no se puede “simplificar” para dar O-. El grupo peróxido se combina con metales que posean número de oxidación +1 o +2. Según la nomenclatura de Stock los peróxidos se nombran así: Con un metal X de número de oxidación +1 el peróxido que se forma tiene cómo fórmula X 2O2. Así el peróxido de litio es Li2O2, y el peróxido de cobre (I) sería el Cu2O2. Si el metal X tiene como número de oxidación +2 basta un átomo del mismo para compensar el –2 del grupo peróxido y la fórmula será XO2. Por ejemplo el peróxido de cobre (II) es CuO2 y el peróxido de bario BaO2. Actividad: Luego de leer y comprender la tabla de contenidos anterior, resuelva los siguientes ejercicios de Nomenclatura inorgánica, pero antes anote sus dudas y comentarios en el siguiente espacio: ----------------------------------------------------------------------------------------------------------------------------- ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ ------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------------ ---------------------------------------------------------------------------------------------------------------------------------------------- -------------------------------------------------------------------------------------------------------------------------------- --------------------------------------------------------------------------------------------------------------------------------------- ----------1. Calcula los estados de oxidación de los átomos que intervienen en los siguientes iones o compuestos. a) CH4 e) SnO2 b) MgS f) BeI2 c) SO3 g) SnCl4 d) MnO42. Escribe la formula química o nombre, Clasificación (óxidos, hidruros, etc) EDO y valencia de los siguientes compuestos binarios: Nombre Fórmula Química Cu2O Clasificación Oxido de nitrógeno (V) Hidruro de sodio Hidruro de Calcio HBr Ácido sulfhídrico Yoduro de bismuto (III) CuBr2 Peróxido de litio Peróxido de calcio Oxido de oro (I) HSe Nitruro de niquel (II) Yoduro de Rubidio MgH2 3 EDO de cada elemento Valencia de cada elemento

