formulación y nomenclatura de química
Anuncio
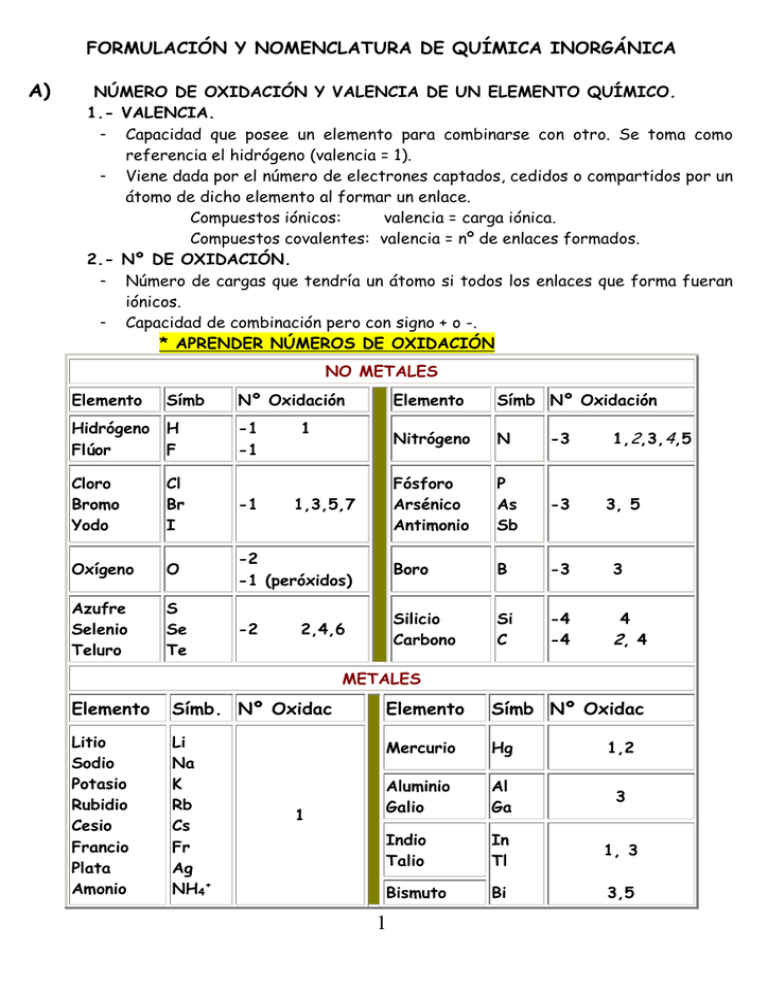
FORMULACIÓN Y NOMENCLATURA DE QUÍMICA INORGÁNICA A) NÚMERO DE OXIDACIÓN Y VALENCIA DE UN ELEMENTO QUÍMICO. 1.- VALENCIA. - Capacidad que posee un elemento para combinarse con otro. Se toma como referencia el hidrógeno (valencia = 1). - Viene dada por el número de electrones captados, cedidos o compartidos por un átomo de dicho elemento al formar un enlace. Compuestos iónicos: valencia = carga iónica. Compuestos covalentes: valencia = nº de enlaces formados. 2.- Nº DE OXIDACIÓN. - Número de cargas que tendría un átomo si todos los enlaces que forma fueran iónicos. - Capacidad de combinación pero con signo + o -. * APRENDER NÚMEROS DE OXIDACIÓN NO METALES Elemento Símb Nº Oxidación Elemento Símb Nº Oxidación Hidrógeno H Flúor F -1 -1 Nitrógeno N -3 Cloro Bromo Yodo Cl Br I -1 Fósforo Arsénico Antimonio P As Sb -3 Oxígeno O -2 -1 (peróxidos) Boro B -3 3 Azufre Selenio Teluro S Se Te -2 Silicio Carbono Si C -4 -4 2, 4 1 1,3,5,7 2,4,6 1,2,3,4,5 3, 5 4 METALES Elemento Símb. Nº Oxidac Elemento Símb Nº Oxidac Litio Sodio Potasio Rubidio Cesio Francio Plata Amonio Li Na K Rb Cs Fr Ag NH4+ Mercurio Hg 1,2 Aluminio Galio Al Ga 3 Indio Talio In Tl 1, 3 Bismuto Bi 3,5 1 1 Berilio Magnesio Calcio Estroncio Bario Radio Cinc Be Mg Ca Sr Ba Ra Zn 2 Cadmio Cd 2 Germanio Estaño Plomo Ge Sn Pb 2,4 Oro Au 1,3 METALES DE TRANSICIÓN (4º PERÍODO) Escandio Titanio Vanadio Cromo Manganeso B) C) Sc Ti V Cr Mn 3 2, 3, 4 2, 3, 4, 5 2,3,4,5 ,6,7 2,3,4,5,6,7 Hierro Cobalto Níquel Fe Co Ni 2,3 Cobre Cu 1, 2 Cinc Zn 2 FÓRMULA QUÍMICA. - Representación escrita de una molécula o compuesto iónico. Formas de representar una fórmula química. 1. FÓRMULA EMPÍRICA: Elementos que constituyen la molécula y en qué proporción se encuentran. 2. FÓRMULA MOLECULAR: indica el nº total de átomos que forman la molécula. 3. FÓRMULA DESARROLLADA: Señala gráficamente cómo están unidos los átomos. NOMENCLATURA: NORMAS DE LA IUPAC. - Internacional Union of Pure and Applied Chemistry. Organismo que establece las normas internacionales de formulación y nomenclatura. - La nomenclatura aceptada por la IUPAC: Nomenclatura Sistemática. - Para determinados compuestos se admite la Nomenclatura Tradicional. - A veces también se usa la Nomenclatura Stock. NORMAS PRÁCTICAS PARA FORMULAR: 1. Escribe siempre en primer lugar el símbolo del elemento que sea Metal o grupo que actúe como tal. Al nombrarlos se hace en orden inverso. 2. Piensa en los respectivos números de oxidación con los que actúan los elementos o grupos de elementos. 2 3. Intercambia los números de oxidación, sin signo, colocándolos como subíndice en los demás átomos o grupos de átomos. 4. Si se puede, se simplifica, teniendo en cuenta que los subíndices deben ser números enteros y que el subíndice 1 no se escribe. 5. Una vez que tenemos la fórmula, el subíndice será el número de átomos del elemento que hay en la sustancia. O2 (2 átomos de oxígeno); N2O3 (2 átomos de nitrógeno y 3 átomos de oxígeno) D) ELEMENTOS. Átomos de un mismo elemento pueden unirse entre ellos. Gases monoatómicos. (Gases Nobles) He, Ne, Ar, Kr, Xe. Moléculas. (Pequeño número de átomos). H2, F2, P4, … Tradicional Sistemática H2 Hidrógeno Dihidrógeno F2 Flúor Diflúor Cl2 Cloro Dicloro Br2 Bromo Dibromo I2 Yodo Diyodo N2 Nitrógeno Dinitrógeno O2 Oxígeno Dioxígeno O3 Ozono Trioxígeno S8 Azufre λ Ciclo-octaazufre P4 Fósforo blanco Tetrafósforo E) COMPUESTOS BINARIOS DEL OXÍGENO. El oxígeno se combina con todos los elementos excepto con Gases Nobles. Oxígeno + Metales --› Óxidos Básicos Oxígeno + No Metales Óxidos Ácidos Compuestos con oxígeno. En casi todos, el nº de oxidación es -2 (O-2) En Peróxidos, el nº de oxidación es -1 (O2-2) 1.- ÓXIDOS. FORMULACIÓN. Se escribe en 1º lugar el símbolo del otro elemento y después el del oxígeno. - Se intercambian los números de oxidación sin signo, colocándolos en forma de subíndices. - Si se puede, se simplifica. 3 NOMENCLATURA SISTEMÁTICA: ÓXIDO precedido de los prefijos griegos (mono, di, tri, tetra, penta, hexa, hepta,….) según el nº de átomos de oxígeno en la fórmula + de + otro elemento precedido igualmente que el oxígeno, por los prefijos correspondientes. Ej; Fe2O3 Trióxido de dihierro; NOMENCLATURA STOCK: Óxido + de + nombre del (metal o no metal) con su nº de oxidación entre paréntesis en números romanos. Para saber el número de oxidación, se debe hacer un balance de cargas: Fe2O3 [2 átomos de hierro ∙ (nº oxidac. Hierro) + 3 átomos de oxígeno ∙ (-2) = 0] (Se iguala a cero siempre y cuando el compuesto no tenga carga). Se despeja la incógnita (nº de oxidación del hierro) y se llega a la conclusión de que es III. A continuación, lo escribimos en el nombre en nomenclatura STOCK. Ej; Fe2O3 Óxido de hierro (III) 2.- PERÓXIDOS. Cuando el oxígeno actúa con nº de oxidación -1, cuyo grupo característico es el O2-2. Se antepone el prefijo PER- al nombre del óxido. FORMULACIÓN. Se escribe en 1º lugar el símbolo del otro elemento y después el del oxígeno como peróxido. - Se intercambian los números de oxidación sin signo, colocándolos en forma de subíndices. - Si se puede, se simplifica. El subíndice 2 del oxígeno es INTOCABLE!!! Recomendaciones: Poner un paréntesis en el grupo peróxido que después quitaréis. Sólo se podrá simplificar lo que esté fuera de ese paréntesis. Ej.: Ca2+ O2-2 Ca2(O2)2 CaO2 (Se han podido simplificar los dos de fuera) Ej.: Al3+ O2-2 Al2(O2)3 Al2O6 (No se han podido simplificar los dos números de fuera del paréntesis). NOMENCLATURA SISTEMÁTICA: Óxido (Prefijos) + de + elemento (Prefijos) NO LA ACEPTO 4 NOMENCLATURA STOCK: Peróxido + de + Elemento (nº de oxidación en números romanos) Cuando hagamos el balance de cargas en los peróxidos, tomaremos el número de oxidación de cada oxígeno que forma parte del peróxido (-1). Ej.: H2O2 Dióxido de dihidrógeno (NO) Peróxido de hidrógeno. CuO2 Dióxido de cobre (NO) Peróxido de cobre (II) 1 átomo de cobre ∙ (nº de ox. del cobre) + 2 átomos de oxígeno ∙ (-1) = 0 Nº de ox. del cobre = 2 Si no estamos seguros de que sea un peróxido o un óxido tendremos que probar con los dos números de oxidación. Hay un indicio claro de que pueda ser un peróxido: cuando su subíndice es 2 o múltiplo de 2. F) COMBINACIONES BINARIAS DEL HIDRÓGENO. 1.- HIDRUROS METÁLICOS. H + METAL nº de oxidación del H -1 HIDRURO. FORMULACIÓN: 1º Se escribe el nombre del metal y luego el del Hidrógeno. 2º Se intercambian las valencias. NOMENCLATURA SISTEMÁTICA: HIDRURO + DE + METAL (Prefijos). STOCK: HIDRURO + DE + METAL (valencia en números romanos si tiene más de una) Ej.: FeH3 Trihidruro de hierro Hidruro de hierro (III) 2.- HIDRUROS NO METÁLICOS. H + NO METAL nº de oxidación del H +1 NO METALES DE LOS GRUPOS 16 Y 17 FORMULACIÓN: 1º Símbolo del H y a continuación el del no metal. 2º Se intercambian los números de oxidación (subíndices). 5 NOMENCLATURA SISTEMÁTICA: NO METAL TERMINADO EN –URO+DE+ HIDRÓGENO. Ej.: H2S H2Se H2Te Sulfuro de hidrógeno Seleniuro de hidrógeno Telururo de hidrógeno HF HCl HBr HI Fluoruro de hidrógeno Cloruro de hidrógeno Bromuro de hidrógeno Yoduro de hidrógeno TRADICIONAL: (EN DISOLUCIÓN ACUOSA) Dan disoluciones ácidas y se llaman ÁCIDOS HIDRÁCIDOS. Ejemplo con elementos del grupo 16: H2S Ácido sulfhídrico Ejemplo con elementos del grupo 17: HCl Ácido clorhídrico NO METALES DE LOS GRUPOS 13, 14 Y 15 Existen combinaciones binarias del hidrógeno con algunos elementos concretos. G) TRADICIONAL SISTEMÁTICA Amoniaco Hidrazina Fosfina Arsina Estibina Metano Silano Borano Diborano Disilano Trihidruro de nitrógeno Tetrahidruro de dinitrógeno Trihidruro de fósforo Trihidruro de Arsénico Trihidruro de antimonio Tetrahidruro de Carbono Tetrahidruro de Silicio Trihidruro de Boro Hexahidruro de diboro Hexahidruro de disilicio FÓRMULA NH3 N2H4 PH3 AsH3 SbH3 CH4 SiH4 BH3 B2H6 Si2H6 SALES BINARIAS. Entre Metal y No Metal o entre dos No Metales. FORMULACIÓN: Metal + No Metal Símbolo Metal + Símbolo No Metal. Dos No Metales Símbolos de los elementos se colocan de izquierda a derecha según la siguiente ordenación. 6 B, Si, C, Sb, As, P, N, Te, Se, S, I, Br, Cl, F. Se intercambian los números de oxidación (subíndices) y se simplifica si se puede. NOMENCLATURA. SISTEMÁTICA: Elemento a la derecha -URO+prefijos mono, di, tri,… STOCK: Se añade la terminación –URO al no metal (dcha) + nombre del metal o no metal (izq.) y el número de oxidación en números romanos entre paréntesis si tiene más de una. Ej.: MgCl2 Dicloruro de magnesio H) Cloruro de magnesio. HIDRÓXIDOS. Combinación de catión metálico con anión hidróxido (-1). FORMULACIÓN: 1º Catión 2º Hidróxido. Se intercambian las valencias (subíndices). NOMENCLATURA. SISTEMÁTICA: nº de iones hidróxido mono, di, tri… + Nombre del metal. STOCK: Hidróxido + de + metal. (nº de oxidación en números romanos). Ej.: Hg (OH)2 Dihidróxido de mercurio/ Hidróxido de mercurio (II) Fe(OH)3 Trihidróxido de hierro/ Hidróxido de hierro (III). I) ÁCIDOS OXOÁCIDOS. FORMULACIÓN Compuestos ternarios H + No metal o metal de transición con nº de oxidación elevados + Oxígeno. HxXyOz X a veces, puede ser un metal de transición (Cr, Mn) con nº de oxidación elevado. Cuando se encuentran en disolución acuosa, dejen iones H+ en libertad propiedades ácidas a las disoluciones. 7 Habitualmente se obtienen añadiendo al óxido correspondiente una o más moléculas de agua. NOMENCLATURA La IUPAC admite la nomenclatura tradicional. SISTEMÁTICA: (PREF) OXO + nombre del átomo central + ATO + (nº de oxidac) + de HIDRÓGENO STOCK: ÁCIDO (PREF) OXO + nombre del átomo central + ICO + (nº de oxidac.) Ej.: H2SO4 Tetraoxosulfato (VI) de hidrógeno Ácido tetraoxosulfúrico (VI). TRADICIONAL: Se usan los prefijos HIPO y PER y los sufijos OSO e ICO. 1. OXOÁCIDOS DE LOS HALÓGENOS. 1.- Saber el estado de oxidación del átomo X.: Σ (nº átomos elemento)*(nº oxidación elemento) =0 HClO HClO2 HClO3 HClO4 HIO4 Ácido hipocloroso Ácido cloroso Ácido clórico Ácido perclórico Ácido metaperyódico HBrO HIO HBrO2 HIO2 HBrO3 HIO3 HBrO4 H5IO6 Ácido ortoperyódico El ácido yodoso: no se conoce el ácido ni ningún derivado suyo. Los dos últimos son ácidos periódicos (nº de oxidación del yodo en dos compuestos es igual a +VII) pero el contenido de agua es diferente (META- menor contenido en agua y ORTO- mayor contenido en agua). 2. OXOÁCIDOS DE LOS CALCÓGENOS O ANFÍGENOS. Los más estables H2SO3 (ácido sulfuroso), H2SO4 (ácido sulfúrico) Otros menos estables (a veces el azufre en estados de oxidación realmente curiosos) H2SO2 Ácido sulfoxílico H2S2O7 Ácido disulfúrico (pirosulfúrico)2(H2SO4) – H2O = H2S2O7 H2S2O5 Ácido disulfuroso 2(H2SO3) – H2O = H2S2O5 8 H2S2O3 H2S2O2 H2SO5 H2SeO3 H2SeO4 H2Se2O7 H2TeO3 H6TeO6 3. Ácido tiosulfúrico Ácido tiosulfuroso Ácido peroxosulfúrico Ácido selenioso Ácido selénico Ácido diselénico Ácido teluroso Ácido ortotelúrico TeO3 + 3 H2O OXOÁCIDOS DE LOS NITROGENOIDEOS. Los más comunes HNO3 (ácido nítrico) y HNO2 (ácido nitroso) Otros con estados de oxidación menos comunes: H2N2O2 Ácido hiponitroso H2NO2 Ácido nitroxíllico (N II) HNO4 Ácido peroxonítrico H3PO4 Ácido ortofosfórico o fosfórico P2O5 + 3H2O H4P2O7 Ácido pirofosfórico o difosfórico 2 H3PO4 - H2O H3PO5 Ácido peroxofosfórico H3PO2 Ácido fosfínico H3PO3 Ácido fosfónico u ortofosfónico (antes fosforoso) H4P2O5 Ácido difosfónico 2 H3PO3 - H2O H4P2O5 H3AsO3 Ácido arsenioso H3AsO3 Ácido arsénico 4. OXOACIDOS DEL CARBONO Y DEL SILICIO El estado de oxidación del del carbono y del silicio en sus ácidos, es el normal de estos elementos ( +IV) H2CO3 Ácido carbónico H4SiO4 Ácido ortosilícico SiO2 + 2H2O H2SiO3 Ácido metasilícico 5. OXOÁCIDOS DEL BORO El estado de oxidación normal del boro cuando está unido a un elemento más electronegativo (oxígeno) es +III. HBO2 Ácido metabórico B2O3 + H2O H3BO3 Ácido ortobórico B2O3 + 3H2O 6. OXOÁCIDOS DE LOS METALES DE TRANSICIÓN 9 El elemento metálico se encuentra en su estado de oxidación mas alto o más altos. H2MnO4 Ácido mangánico HMnO4 Ácido permangánico H2CrO4 Ácido crómico H2Cr2O7 Ácido dicrómico HVO3 Ácido metavanádico V 2 O5 + H 2 O H3VO4 Ácido ortovanádico V2O5 + 3H2O H3V3O9 Ácido trivanádico 7. ÁCIDOS CON ENLACES CARBONO – NITRÓGENO. HCN Cianuro de hidrógeno Ácido cianhídrico (del grupo de HCl, H2S…) ISÓMEROS. HOCN HNCO HCNO Ácido ciánico Ácido isociánico Ácido fulmínico * REGLAS PARA AYUDAR A FORMULAR: 1.- Prestar atención al sufijo (oso, ico) y al posible prefijo (hipo, per) del compuesto que nos dicen, y obtendremos el estado de oxidación del elemento. 2.- Tener en cuenta que el prefijo META o el ORTO indican distinto grado de hidratación, y que los prefijos DI o PIRO, TRI, TETRA,... nos indican el grado de polimerización. ( Ej.: Ácido trimetafosfórico trímero del ácido fosfórico en su inferior grado de hidratación: (HPO3)3 ) 3.- En los casos más conflictivos: Todos los oxoácidos del grupo del cloro tienen 1 HIDRÓGENO en su fórmula, con excepción del Ácido ortoperyódico. Todos los oxoácidos del grupo del azufre tienen 2 HIDRÓGENOS en su fórmula, con excepción del ácido ortotelúrico Las formas ORTO de los ácidos del fósforo y del arsénico tienen 3 HIDRÓGENOS en su fórmula. 4.- Sabiendo el estado de oxidación del elemento y el número de átomos de hidrógeno, se calcula el número de átomos de oxígeno. 10 Para los ácidos que no son polímeros, (di, tri...) se cumple: Si el número de oxidación del elemento central es impar, el número de hidrógenos en la fórmula ha de ser impar. Si en número de oxidación del elemento central es par, el número de hidrógenos en la fórmula ha de ser par. J) IONES MONOATÓMICOS Y POLIATÓMICOS. CATIONES: Para nombrar estas “especies químicas” basta anteponer la palabra catión o ion al nombre del elemento. En los casos en que el átomo puede adoptar distintos estados de oxidación se indica entre paréntesis. Algunos ejemplos son H+ Ión hidrógeno Li+ Ión litio Cu+ Ión cobre (I) Cu+2 Ión cobre (II) Fe+2 Ión hierro (II) Fe+3 Ión hierro (III) Sn+2 Ión estaño (II) Pb+4 Ión plomo (IV) Hay bastantes compuestos –como, por ejemplo, el amoníaco– que disponen de electrones libres, no compartidos. Estos compuestos se unen al catión hidrógeno, para dar una especie cargada positivamente. Para nombrar estas especies cargadas debe añadirse la terminación –onio tal como se ve en los siguientes ejemplos: NH4+ Ión amonio PH4+ Ión fosfonio AsH4+ Ión arsonio H 3 O+ Ión oxonio ANIONES MONOATÓMICOS a) Nombres de iones negativos monoatómicos (aniones). C22– acetiluro O3 – Ozónido O 2– O22– Óxido O2 – Hiperóxido o superóxido Peróxido O2– Óxido 11 ANIONES: Para nombrar los iones monoatómicos se utiliza la terminación –uro, como en los siguientes ejemplos: H– Ión hidruro S–2 Ión sulfuro F– Ión fluoruro Se–2 Ión seleniuro Cl– Ión cloruro N–3 Ión nitruro Br– Ión bromuro P–3 Ión fosfuro I– Ión yoduro As–3 Ión arseniuro S22– Disulfuro HClO Ácido hipocloroso ClO– Ión hipoclorito H2SO3 Ácido sulfuroso SO3–2 Ión sulfito HClO3 Ácido clórico ClO3– Ión clorato HClO4 Ácido perclórico ClO4– Ión perclorato H2SO4 Ácido sulfurico SO4–2 Ión sulfato Los aniones poliatómicos se pueden considerar como provenientes de otras moléculas por pérdida de uno o más iones hidrógeno. El ion de este tipo más usual y sencillo es el ion hidroxilo (OH–) que procede de la pérdida de un ion hidrógeno del agua. Sin embargo, la gran mayoría de los aniones poliatómicos proceden –o se puede considerar que proceden– de un ácido que ha perdido o cedido sus hidrógenos. Para nombrar estos aniones se utilizan los sufijos –ito y –ato según que el ácido de procedencia termine en –oso o en –ico, respectivamente. 12 A menudo, para “construir” el nombre del anión, no se reemplazan simplemente las terminaciones oso-ico por ito-ato, sino que la raíz del nombre se contrae. Por ejemplo, no se dice iones sulfurito y sulfurato sino iones sulfito y sulfato. K) SALES OXOÁCIDAS (TERCIARIAS) Metal + no metal o metal de transición con nº de oxidación elevados + Oxígeno. Resultado de la reacción de un hidróxido con un oxoácido: NaOH + HClO4 NaClO4 + H2O Cuando el anión procede de un oxoácido : Ácido en OSO anión en ITO Ácido en ICO anión en ATO Si hay más aniones de ese mismo elemento con otros números de oxidación se utilizan los prefijos HIPO y PER, como en los correspondientes ácidos. FORMULACIÓN: - Escribimos primero el catión y luego el anión. M3+ XOc- Asignamos a cada ion el subíndice necesario para que la suma de los números de oxidación o de las cargas sea cero: . M3+ (XOc-)3 - Escribimos la fórmula definitiva. Ej: H2SO4 Na2SO4 (Tanto el sodio como el hidrógeno valen lo mismo). NOMENCLATURA. SISTEMÁTICA: (PREF) OXO + nombre del átomo central + ATO + (nº de oxidac) + de METAL + (nº de oxidación). STOCK y TRADICIONAL: • Los prefijos PER e HIPO se mantienen. • Los sufijos OSO------------ITO + de + metal (nº oxidación en romanos) • Ya no se nombra la palabra ÁCIDO. 13 ICO-------------ATO Ej.: KNO3 Proviene del ácido nítrico Nitrato de Potasio. Sn(ClO4)2 Proviene del ácido perclórico Perclorato de estaño (II) (NH4)2SO4 Fe(IO)3 sulfato de amonio tetraoxosulfato (VI) de amonio hipoyodito de hierro (III) o hipoyodito férrico ; [monooxoyodato (I)] de hierro (III) tris L) SALES ÁCIDAS Los ácidos con más de un hidrógeno no los ceden todos con igual facilidad, y así es como se originan iones que todavía contienen átomos de H. Para formular las sales ácidas lo haremos igual que en las neutras pero añadiremos el prefijo HIDROGENO O DIHIDROGENO al nombre del anión. H2CO3 Ácido carbónico; HCO3ion hidrogenocarbonato; Ca(HCO3)2 hidrogenocarbonato de calcio H2S HSNaHS M) Ácido sulfhídrico; ion hidrogenosulfuro; Hidrogenosulfuro de sodio ÓXIDOS DOBLES. Existen en la naturaleza algunos óxidos (Fe3O4, Pb3O4….) en los que el metal aparenta hallarse en un estado de oxidación anómalo, intermedio entre los números de oxidación más usuales de dicho metal. Lo que ocurre es que la red cristalina está formada por iones metálicos de distinta carga alternados (hay dos tipos de cationes), por lo que estos compuestos pueden considerarse una combinación de dos óxidos simples: Fe3O4 = FeO • Fe2O3 Pb3O4 = 2PbO • PbO2 Con los cationes la IUPAC recomienda seguir el orden alfabético tanto en lo que respecta a las fórmulas como a los nombres. Dado que los símbolos de algunos metales no coinciden con la letra o letras iniciales de dichos elementos, 14 puede ocurrir que el orden de escritura en la fórmula no coincida con el orden de citación: K2MgO2 = dióxido (doble) de magnesio – dipotasio; dióxido de magnesio y potasio. N) HIDRÓXIDOS DOBLES. AlCa2(OH)7 = Al(OH)3 • 2Ca(OH)2 Heptahidróxido (doble) de aluminio – dicalcio; (heptahidróxido de aluminio y calcio) O) SALES DOBLES, TRIPLES…. Cuando en una sal hay varios cationes, se escriben y citan en orden alfabético. Si hay hidrógenos “ácidos”, éstos se escriben y nombran en base a lo visto anteriormente. AgK(NO3)2 = Nitrato (doble) de plata – potasio LiNaHPO4 = Hidrogenofosfato (doble) de litio-sodio Por otro lado, si la sal contiene varios aniones debe también seguirse con ellos un orden alfabético: BaBrCl Al(NO3)(SO4) = Bromuro – cloruro de bario = Nitrato – sulfato de aluminio Al2(NO3)4(SO4) = Tetrakis(nitrato) – sulfato de aluminio En las fórmulas, los cationes precederán a los aniones e irán en orden alfabético de símbolos. En los nombres se aplicarán las siguientes reglas: - - Los adjetivos doble o triple pueden ser añadidos inmediatamente después del nombre del anión. El número así indicado se refiere al número de tipos de catión presentes y no al número de tales iones. Los cationes o aniones se citarán en orden alfabético que puede ser diferente en fórmulas que en nombres. 15 Ej: KMgF3 Fluoruro de magnesio y potasio. P) OXISALES. Se pueden considerar como la agrupación de un óxido con una sal. Así, el compuesto Pb(CO3)O se puede desdoblar en carbonato de plomo (IV) y óxido de plomo (IV) ½( Pb(CO3)2 + PbO2) El FeClO se puede desdoblar en cloruro de hierro (III) y óxido de hierro (III) 1/3 ( FeCl3 + Fe2O3) Se pueden nombrar como si fueran sales dobles (carbonato – óxido de plomo (IV), cloruro – óxido de hierro (III)) pero lo usual es abreviar sus nombres de la siguiente forma: Oxicarbonato de plomo (IV) Oxicloruro de hierro (III) Ejemplos: Trioxicarbonato de mercurio (II) Hg4(CO3)O3 Oxidifluoruro de mercurio (II) Hg2F2O FORMULACIÓN Y NOMENCLATURA INORGÁNICA (continuación). DE QUÍMICA a) Nombres de iones negativos poliatómicos (aniones). ClO4– perclorato CN– 16 Cianuro ClO3– clorato SCN– tiocianato ClO2– clorito OCN– cianato ClO– hipoclorito NCO- isocianato BrO3– bromato NO2– nitrito IO3– yodato NO4– peroxonitrato SO42– sulfato PHO32– fosfonato (fosfito) HSO4– hidrogenosulfato PH2O2– fosfinato HSO3– hidrogenosulfito PO43– fosfato (orto) S2O52– disulfito HPO42– hidrogenofosfato S2O72– disulfato H2PO4– dihidrogenofosfato SO52– peroxomonosulfato P2O74– S2O82– peroxodisulfato P2O84– peroxodifosfato HS– hidrogenosulfuro C2O42– oxalato S2O32– tiosulfato HCO3– hidrogenocarbonato HSe– hidrogenoselenuro CO32– carbonato SeO32– selenito CH3COO– acetato SeO42– seleniato SiO32– silicato CNS– sulfocianuro SiO44– silicato (orto) CrO42– cromato HCrO4– hidrogenocromato MnO4– permanganato Cr2O72– Dicromato OH– Hidróxido BO33– Borato (orto) HO2– Hidrogenoperóxido BO2– Borato (meta) difosfato b) Nombres de iones positivos poliatómicos (cationes). 17 ClO2+ clorilo VO+ Vanadilo (III) ClO3+ perclorilo VO2+ Vanadilo (IV) H3S+ sulfonio VO3+ Vanadilo (V) CO2+ carbonilo UO2+ Uranilo (V) NH4+ amonio UO22+ Uranilo (VI) PH4+ fosfonio AsH4+ Arsonio SbH4+ Estibonio H3O+ Oxonio SO2+ Tionilo NO+ Nitrosilo SO22+ sulfonilo NO2+ Nitrilo o nitroilo H3S+ sulfonio PO3+ Fosforilo H3Se+ selenonio H2I+ yodonio H2F+ fluoronio c) Compuestos de adición. Compuestos iónicos que retienen moléculas de disolvente al cristalizar. Ej.: Al2O3 · 3H2O 3CdSO4 · 8H2O Óxido de aluminio – agua (1/3) sulfato de cadmio _ agua (3/8) 18
