montero_quimica
Anuncio
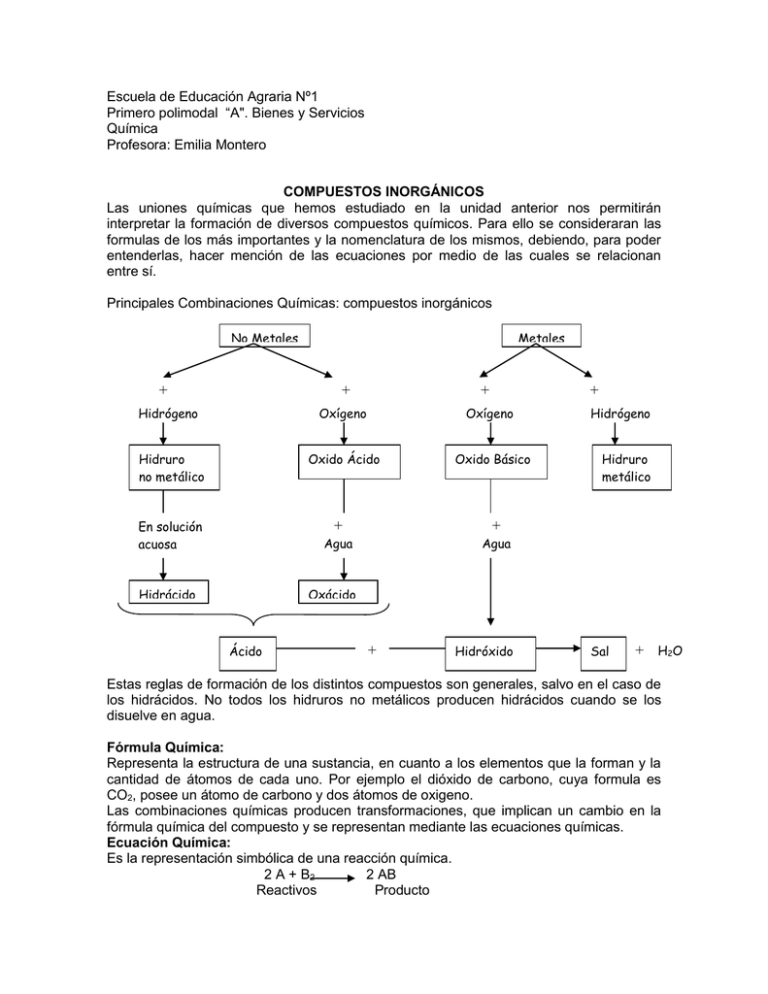
Escuela de Educación Agraria Nº1 Primero polimodal “A". Bienes y Servicios Química Profesora: Emilia Montero COMPUESTOS INORGÁNICOS Las uniones químicas que hemos estudiado en la unidad anterior nos permitirán interpretar la formación de diversos compuestos químicos. Para ello se consideraran las formulas de los más importantes y la nomenclatura de los mismos, debiendo, para poder entenderlas, hacer mención de las ecuaciones por medio de las cuales se relacionan entre sí. Principales Combinaciones Químicas: compuestos inorgánicos No Metales + Metales + + + Hidrógeno Oxígeno Oxígeno Hidruro no metálico Oxido Ácido Oxido Básico En solución acuosa Hidrácido + + Agua Agua Hidrógeno Hidruro metálico Oxácido Ácido + Hidróxido Sal + H 2O Estas reglas de formación de los distintos compuestos son generales, salvo en el caso de los hidrácidos. No todos los hidruros no metálicos producen hidrácidos cuando se los disuelve en agua. Fórmula Química: Representa la estructura de una sustancia, en cuanto a los elementos que la forman y la cantidad de átomos de cada uno. Por ejemplo el dióxido de carbono, cuya formula es CO2, posee un átomo de carbono y dos átomos de oxigeno. Las combinaciones químicas producen transformaciones, que implican un cambio en la fórmula química del compuesto y se representan mediante las ecuaciones químicas. Ecuación Química: Es la representación simbólica de una reacción química. 2 A + B2 2 AB Reactivos Producto IONIZACION DE LOS ACIDOS (Hidrácidos y oxácidos) Los ácidos existen como sustancias covalentes solo en estado gaseoso, pero en la práctica, cuando se las usa como reactivos se las tienen en soluciones acuosas. Cuando los ácidos se disuelven en agua, al ser esta una molécula polar, transforma, en algunos casos, el enlace covalente polar del o de los hidrógenos con el resto de la molécula, en iónico, formándose protones hidrógenos H+ y el anión del ácido correspondiente (en el caso del ejemplo anterior nos quedaría H+ y NO2-) cediendo así iones hidrógenos. Estos iones le dan el carácter de ácido. La ecuación de ionización se expresa así: HNO2 NO3- + H+ En el caso de los hidrácidos: HBr H+ + BrNOCION GENERAL DE ACIDO Ácido es toda sustancia que en solución acuosa se ioniza, liberando iones hidrógeno (protones). Estos protones confieren a los ácidos propiedades que los identifican, y que en conjunto constituyen el carácter ácido. Los ácidos se caracterizan por: Poseer sabor agrio, como el vinagre. Conducir en solución acuosa, la corriente eléctrica. Cambiar el color de ciertas sustancias llamadas indicadoras de PH. En la escala de PH los ácidos se sitúan entre el PH 0 a 6.9. 0 1 7 Sustancias Ácidas Sustancias neutras 14 Sustancias Básicas IONIZACION DE LOS HIDROXIDOS El tipo de unión entre el grupo oxidrilo (OH) y el metal es de tipo iónica, así que cuando los hidróxidos se disuelven en agua o se hallan en estado de fusión se ioniza, formándose un anión oxidrilo OH- y un catión metálico. Ejemplo: Na (OH) Na+ + OHLa liberación de grupo OH por parte de los hidróxidos le confieren las características de bases. Un caso especial lo constituye el Hidróxido de amonio. El amoniaco es un gas muy soluble en agua. Al disolverse reacciona con esta formando un compuesto llamado Hidróxido de amonio. NH3 + H2O NH4 (OH) Amoniaco (o nitruro de hidrógeno) Hidróxido de amonio Uno de los hidrógenos del agua ha formado una unión dativa con el nitrógeno y el otro electrón forma otra unión dativa con el electrón del grupo oxidrilo. El hidróxido de amonio se ioniza de acuerdo con la siguiente ecuación: NH4 (OH) NH4+ + OHCatión amonio NOCION GENERAL DE HIDROXIDO O BASE Hidróxido o base es todo compuesto que en solución acuosa libera aniones oxidrilos. Estos aniones confieren a los hidróxidos propiedades que los identifican, y que en su conjunto constituyen el carácter básico. Los hidróxidos se caracterizan por: Poseer sabor amargo. (el sabor característico se denomina alcalino, nombre que recibían antiguamente estos compuestos) Conducir, en solución acuosa, la corriente eléctrica. Cambiar el color de los indicadores de PH. Sales Hay diferentes métodos de obtención de sales: Primer método: Ácido + Hidróxido Sal + Agua Segundo método: Ácido + óxido básico Sal + Agua Tercer método: Óxido ácido + Hidróxido Cuarto método: Óxido ácido + Óxido básico Sal + Agua Sal Sales obtenidas a partir de la combinación de un Ácido con un Hidróxido Recordemos que el carácter ácido lo brindan los H del ácido y el carácter básico los OH del hidróxido. Esos caracteres (H y OH) se deben neutralizar y lo hacen constituyendo la molécula de agua. H2SO3 + 2 Na (OH) Na2SO3 + 2 H2O Como el ácido posee dos H y el hidróxido un OH, para que se produzca la neutralización se necesita otra molécula de Na (OH), para así obtener 2 OH y 2 H, que formaran 2 moléculas de agua, y la molécula de sal: como utilice dos moléculas de hidróxido necesite 2 Na y un grupo sulfito SO3-. Para nombrar la sal formada a partir de un oxácido se remplaza la terminación oso por ito, e ico por ato y luego el nombre del hidróxido. La sal formada en el ejemplo anterior se formo a partir del ácido sulfuroso y el hidróxido de sodio: Na2SO3 se llama sulfito de sodio. HNO3 + Cu (OH)2 Cu (NO3)2 Ácido Hidróxido Nitrato cúprico nítrico cúprico H2SO4 + 2 NH4 (OH) (NH4)2SO4 + 2 H2O Ácido Hidróxido Sulfato de sulfúrico de amonio amonio Para nombrar una sal formada a partir de un hidrácido y un hidróxido, se reemplaza la terminación hídrico del ácido por uro. (son sales son oxigeno) 2 HCl + Ca (OH)2 Cl2Ca + 2 H2O Ácido Hidróxido de Cloruro de Clorhídrico calcio calcio Sales obtenidas a partir de la combinación de un ácido con un óxido básico Se forma agua a partir del H del ácido y el oxigeno del hidróxido. Luego se suman las cantidades de átomos que se usaron. 2 HNO3 + CaO Ca (NO3)2 + H2O Ácido Óxido de Nitrato de Nítrico calcio calcio Sales obtenidas a partir de la combinación de un oxido ácido y un hidróxido SO2 + Ca (OH)2 CaSO3 + H2O Óxido Hidróxido de Sulfito de sulfuroso calcio calcio Sales obtenidas a partir de la combinación de un Óxido ácido y un Óxido básico Para formar la sal solo se suman la cantidad de átomos de ambos óxidos. SO2 + CaO CaSO3 De todos los métodos presentados prestaremos mas atención a las sales formadas por neutralización de un ácido y un hidróxido. Las sales se clasifican en: neutras, ácidas y mixtas. Sales ácidas: resultan del reemplazo parcial de los hidrógenos de un ácido por átomos metálicos. Se forman con ácidos que presentan dos o más hidrógenos en su molécula, quedando uno de ellos en la sal, y el otro pasa a formar la molécula de agua. H2SO4 + Na (OH) NaHSO4 + H2O Ácido Hidróxido de Sulfato ácido de sodio sulfúrico sodio Sales neutras: Son las sales vistas anteriormente, en donde los H y OH forman agua, y en la sal no quedan ni H, ni OH. H2SO4 + 2 Na (OH) NaSO4 + 2 H2O Ácido Hidróxido de Sulfato de sodio sulfúrico sodio Sales básicas: resultan de reemplazar parcialmente los oxhidrilos de un hidróxido por los aniones de un ácido. Se forman con hidróxidos que presentan 2 o más grupos oxhidrilos en su molécula; así uno de ellos pasa a formar parte de la sal mientras que el otro forma la molécula de agua. HNO3 + Ca(OH)2 Ca (OH) NO3 + H2O Ácido Hidróxido de Nitrato básico de calcio nítrico calcio Sales mixtas: resultan de sustituir los hidrógenos de un ácido por átomos metálicos distintos. Para formar estas sales reaccionan un ácido y 2 hidróxidos distintos. H2SO4 + K(OH) + Na(OH) NaKSO4 + 2 H2O Ácido Hidróxido Hidróxido de Sulfato de sodio y potasio sulfúrico de potasio sodio ACTIVIDADES LUEGO DE ESTUDIAR EL APUNTE: 1) Realice la ecuación de formación balanceada de los siguientes compuestos: a) Ácido Bromhídrico b) Hidróxido de cobre (II) c) Cl2O7 d) FeO e) H2CO3 f) HMnO4 g) Al (OH)3 h) Dióxido de plomo i) Nitrito (III) de Hidrógeno j) Hidróxido de magnesio (II) k) Oxido auroso l) HF 2) Nombre los compuestos: c), d), e), f), g) y l). 3) Nombre a los óxidos por los tres tipos de nomenclatura aprendidas. 4) Realice la sal neutra que se formara entre el Hidróxido de calcio (II) y el Clorito (III) de hidrógeno. 5) Realice un cuadro comparativo entre las sales Neutras, básicas y ácidas. ¿Cómo reconocería en una formula a cada una? 6) Realice un resumen que le permita clasificar, nombrar y formar cada compuesto. 7) Investigue a cerca de las utilizaciones de algunos compuestos. 8) Investigue que compuestos ocasionan la lluvia ácida y el efecto invernadero. Realice una monografía de cada fenómeno.