link - eventszone
Anuncio
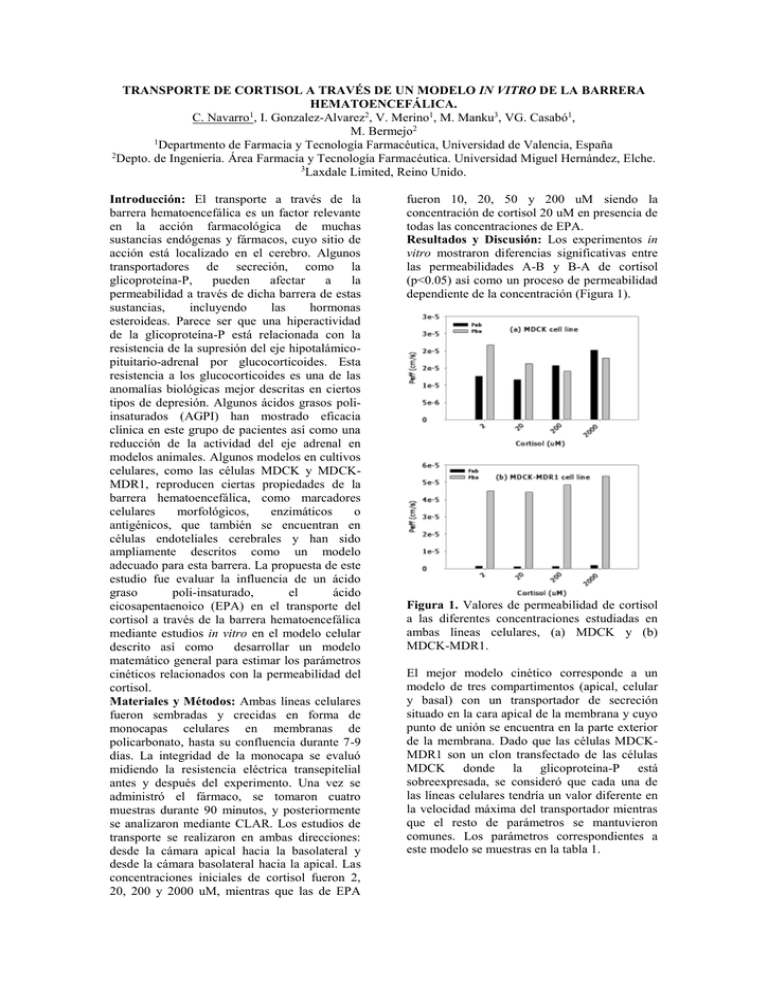
TRANSPORTE DE CORTISOL A TRAVÉS DE UN MODELO IN VITRO DE LA BARRERA HEMATOENCEFÁLICA. C. Navarro1, I. Gonzalez-Alvarez2, V. Merino1, M. Manku3, VG. Casabó1, M. Bermejo2 1 Departmento de Farmacia y Tecnología Farmacéutica, Universidad de Valencia, España 2 Depto. de Ingeniería. Área Farmacia y Tecnología Farmacéutica. Universidad Miguel Hernández, Elche. 3 Laxdale Limited, Reino Unido. Introducción: El transporte a través de la barrera hematoencefálica es un factor relevante en la acción farmacológica de muchas sustancias endógenas y fármacos, cuyo sitio de acción está localizado en el cerebro. Algunos transportadores de secreción, como la glicoproteína-P, pueden afectar a la permeabilidad a través de dicha barrera de estas sustancias, incluyendo las hormonas esteroideas. Parece ser que una hiperactividad de la glicoproteína-P está relacionada con la resistencia de la supresión del eje hipotalámicopituitario-adrenal por glucocorticoides. Esta resistencia a los glucocorticoides es una de las anomalías biológicas mejor descritas en ciertos tipos de depresión. Algunos ácidos grasos poliinsaturados (AGPI) han mostrado eficacia clínica en este grupo de pacientes así como una reducción de la actividad del eje adrenal en modelos animales. Algunos modelos en cultivos celulares, como las células MDCK y MDCKMDR1, reproducen ciertas propiedades de la barrera hematoencefálica, como marcadores celulares morfológicos, enzimáticos o antigénicos, que también se encuentran en células endoteliales cerebrales y han sido ampliamente descritos como un modelo adecuado para esta barrera. La propuesta de este estudio fue evaluar la influencia de un ácido graso poli-insaturado, el ácido eicosapentaenoico (EPA) en el transporte del cortisol a través de la barrera hematoencefálica mediante estudios in vitro en el modelo celular descrito así como desarrollar un modelo matemático general para estimar los parámetros cinéticos relacionados con la permeabilidad del cortisol. Materiales y Métodos: Ambas líneas celulares fueron sembradas y crecidas en forma de monocapas celulares en membranas de policarbonato, hasta su confluencia durante 7-9 días. La integridad de la monocapa se evaluó midiendo la resistencia eléctrica transepitelial antes y después del experimento. Una vez se administró el fármaco, se tomaron cuatro muestras durante 90 minutos, y posteriormente se analizaron mediante CLAR. Los estudios de transporte se realizaron en ambas direcciones: desde la cámara apical hacia la basolateral y desde la cámara basolateral hacia la apical. Las concentraciones iniciales de cortisol fueron 2, 20, 200 y 2000 uM, mientras que las de EPA fueron 10, 20, 50 y 200 uM siendo la concentración de cortisol 20 uM en presencia de todas las concentraciones de EPA. Resultados y Discusión: Los experimentos in vitro mostraron diferencias significativas entre las permeabilidades A-B y B-A de cortisol (p<0.05) así como un proceso de permeabilidad dependiente de la concentración (Figura 1). Figura 1. Valores de permeabilidad de cortisol a las diferentes concentraciones estudiadas en ambas líneas celulares, (a) MDCK y (b) MDCK-MDR1. El mejor modelo cinético corresponde a un modelo de tres compartimentos (apical, celular y basal) con un transportador de secreción situado en la cara apical de la membrana y cuyo punto de unión se encuentra en la parte exterior de la membrana. Dado que las células MDCKMDR1 son un clon transfectado de las células MDCK donde la glicoproteína-P está sobreexpresada, se consideró que cada una de las líneas celulares tendría un valor diferente en la velocidad máxima del transportador mientras que el resto de parámetros se mantuvieron comunes. Los parámetros correspondientes a este modelo se muestras en la tabla 1. Parámetros Valores (CV %) MDCK MDCK-MDR1 Vol. celular 4.00·10-1 (17.78) (mL) PAC (cm/s) 1.06·10-4 (9.36) PCB (cm/s) 1.38·10-3 (46.09) 6.21·10-4 3.40·10-3 Vm 2 (nmol/s·cm ) (39.77) (19.97) Km (µM) 1.61·10+1 (37.52) Tabla 1: Parámetros cinéticos in vitro obtenidos en las líneas celulares MDCK y MDCK-MDR1. Por otra parte, los experimentos en presencia de EPA mostraron diferencias significativas en los valores de permeabilidad a las concentraciones más altas de EPA (p<0.05) pero sólo en la línea celular MDCK, no viéndose afectados los valores de permeabilidad en las células MDCKMDR1 (Tablas 2 y 3). Pab 0 10 20 50 10 NS - - - 20 NS NS - - 50 S NS S - 200 S S S NS Pba 0 10 20 50 10 NS - - - 20 NS NS - - 50 S NS NS - S S S S 200 Tabla 2: Resultado de la comparación múltiple de las permeabilidades apical-basal y basalapical para las distintas concentraciones de EPA ensayadas en la línea celular MDCK. Pab 0 10 20 50 10 NS - - - 20 NS NS - - 50 NS NS NS - 200 NS NS NS NS Pba 0 10 20 50 10 NS - - - 20 NS NS - - 50 NS NS NS - NS NS NS NS 200 Tabla 3: Resultado de la comparación múltiple de las permeabilidades apical-basal y basalapical para las distintas concentraciones de EPA ensayadas en la línea celular MDCK-MDR1. El cortisol es transportado activamente por la glicoproteína-P en ambas líneas celulares, pero el transportador sólo muestra saturación a las concentraciones ensayadas en MDCK. El ácido graso EPA actúa como inhibidor de la secreción a través de la glicoproteína-P en la línea celular MDCK, mientras que en la línea celular transfectada, la concentración de EPA no es suficientemente alta para mostrar algún efecto. Esto significa que la secreción a través de la glicoproteína-P podría ser el factor dominante para el transporte de cortisol a través de la barrera hemaoencefálica, puesto que las concentraciones fisiológicas de cortisol se encuentran en el ámbito más bajo de las concentraciones ensayadas en este estudio. Referencias: (1) Veronesi B. Characterization of the MDCK cell line for screening neurotoxicants. Neurotoxicology.1996;17(2):433-43. (2) C.M. Pariante et al. Do antidepressants regulate how cortisol affects the brain? Psychoneuroendocrinology. 29:423-447 (2004). Agradecimientos: - MDCK and MDCK-MDR1 cells were provided by Dr. Michael M. Gottesman, Chief, Laboratory of Cell Biology, National Cancer Institute. -This work is supported by Biosim EU grant: LSHB-CT-2004-005137