Determinación cuantitativa de proteínas (Método calorimétrico)
Anuncio
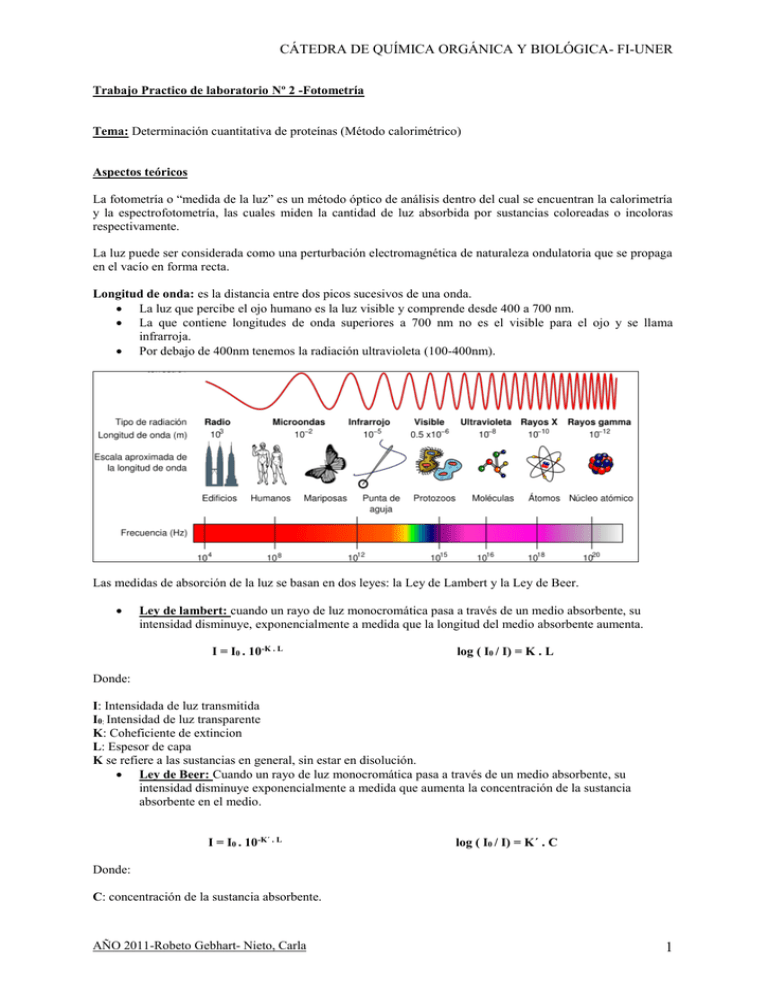
CÁTEDRA DE QUÍMICA ORGÁNICA Y BIOLÓGICA- FI-UNER Trabajo Practico de laboratorio Nº 2 -Fotometría Tema: Determinación cuantitativa de proteínas (Método calorimétrico) Aspectos teóricos La fotometría o “medida de la luz” es un método óptico de análisis dentro del cual se encuentran la calorimetría y la espectrofotometría, las cuales miden la cantidad de luz absorbida por sustancias coloreadas o incoloras respectivamente. La luz puede ser considerada como una perturbación electromagnética de naturaleza ondulatoria que se propaga en el vacío en forma recta. Longitud de onda: es la distancia entre dos picos sucesivos de una onda. La luz que percibe el ojo humano es la luz visible y comprende desde 400 a 700 nm. La que contiene longitudes de onda superiores a 700 nm no es el visible para el ojo y se llama infrarroja. Por debajo de 400nm tenemos la radiación ultravioleta (100-400nm). Las medidas de absorción de la luz se basan en dos leyes: la Ley de Lambert y la Ley de Beer. Ley de lambert: cuando un rayo de luz monocromática pasa a través de un medio absorbente, su intensidad disminuye, exponencialmente a medida que la longitud del medio absorbente aumenta. I = I0 . 10-K . L log ( I0 / I) = K . L Donde: I: Intensidada de luz transmitida I0: Intensidad de luz transparente K: Coheficiente de extincion L: Espesor de capa K se refiere a las sustancias en general, sin estar en disolución. Ley de Beer: Cuando un rayo de luz monocromática pasa a través de un medio absorbente, su intensidad disminuye exponencialmente a medida que aumenta la concentración de la sustancia absorbente en el medio. I = I0 . 10-K´ . L log ( I0 / I) = K´ . C Donde: C: concentración de la sustancia absorbente. AÑO 2011-Robeto Gebhart- Nieto, Carla 1 CÁTEDRA DE QUÍMICA ORGÁNICA Y BIOLÓGICA- FI-UNER Estas dos leyes se combinan en la ley de Lambert-Beer: I = I0 . 10 – ε . C . L log ( I0 / I) = ε . C . L Donde ε: coeficiente de extinción molar. ε es el coeficiente de extinción cuando la solución contiene un mol por litro. El cociente de las intensidades se conoce como transmitancia (T) y se suele expresar como un porcentaje. T=I/Io = 10 – ε . C . L %T = I/Io x 100 La expresión log ( I0 / I) se conoce como absorbancia (A) o densidad óptica (DO) A = DO = log ( I0 / I) = ε . C . L; para L=1 ; A=ε.C T y A quedan relacionados de la forma: A = - log T = 2 – log (%T ) Esquema del aparato Grafica A Técnica operatoria Las proteínas forman complejos coloreados por los iones Cu +2 y la densidad del color desarrollado es proporcional al color de las mismas. En nuestra Experiencia primero calcularemos la absorbancia con un instrumento representado en la grafica A. AÑO 2011-Robeto Gebhart- Nieto, Carla 2 CÁTEDRA DE QUÍMICA ORGÁNICA Y BIOLÓGICA- FI-UNER Después volcaremos los resultados en la tabla 1 que se encuentra mas adelante. Proteinas + Biuret (CuSO4, Na OH) Violeta Absorbancia = K . C Procedimiento 1. Colocar en una gradilla 6 tubos y proceder de acuerdo al siguiente esquema TUBOS Blanco Sto 2g% Sto 4g% Sto 6g% Sto 8g% Muestra Rvo.Biuret 2. Blanco 5ml 2g% 4g% 0.1 5ml 6g% 8g% MUESTRA 0.1 5ml ABSORVANCIA 0.157 0.27-0.157= 0.113 0.384-0.157= 0.227 0.417-0.157= 0.26 0.584-0.157= 0.427 0.384-0.157= 0.227 - 0.1 0.1 0.1 5ml 5ml 5ml Tabla1 Con los resultados obtenidos construimos una curva de calibración donde se representa la absorbancia en función de las concentraciones conocidas. Absorbancia Vs Concentración 0,45 0,4 Absorvancia 0,35 0,3 0,25 0,2 0,15 0,1 0,05 0 0% 2% 4% 6% 8% 10% Concentracíon Nota: Esta variación de la absorbancia, depende de la precisión de las mediciones tomadas y de los errores que pueden cometerse en el pipeteo de las muestras y del reactivo. 3. Para calcular la concentración de la muestra debe ingresarse en el gráfico B con el valor de la absorbancia correspondiente a la misma. La concentración estará expresada en gr% . AÑO 2011-Robeto Gebhart- Nieto, Carla 3 CÁTEDRA DE QUÍMICA ORGÁNICA Y BIOLÓGICA- FI-UNER 4. Alternativamente, calcularemos la concentración de la muestra mediante la determinación de un factor, que se calcula de la siguiente manera: Primero calcularemos los factores con la siguiente expresión: Factor = ag% / Abs g% Con a= 2, 4, 6y 8 g% respectivamente y Abs Muestra = absorbancia de nuestra muestra. Haciendo los cálculos, sus respectivos factores serán: Factor ( 2g%) =(2%) / 0.113= 17.699 Factor ( 4g%) =(4%) / 0.227= 17.621 Factor ( 6g%) =(6%) / 0.26= 23.076 Factor ( 8g%) =(8%) / 0.427= 18.735 Con los cuales calcularemos el promedio general de los factores: Factor promedio =(17.699+17.621+23.076+18.735) / 4= 19.142 Entonces l0.a concentración de la muestra será: [Concentración de la muestra] = Factor promedio. Abs Muestra [Concentración de la muestra] = 19.142*0.227 = 4.9 % AÑO 2011-Robeto Gebhart- Nieto, Carla 4
